ตัวเร่งปฏิกิริยา ตัวเร่ง. ประเภทของตัวเร่งปฏิกิริยา: เป็นเนื้อเดียวกัน, ต่างกัน, ตัวเร่งปฏิกิริยาอัตโนมัติ กลไกของปฏิกิริยาตัวเร่งปฏิกิริยา ตัวเร่งปฏิกิริยาและตัวเร่งปฏิกิริยา หลักการทำงานของตัวเร่งปฏิกิริยาในปฏิกิริยาเคมี
อัตราของปฏิกิริยาเคมีสามารถเพิ่มขึ้นอย่างมากเมื่อมีสารต่างๆ ที่ไม่ใช่ตัวทำปฏิกิริยาและไม่ได้เป็นส่วนหนึ่งของผลิตภัณฑ์ที่ทำปฏิกิริยา ปรากฏการณ์อันน่าทึ่งนี้เรียกว่า ตัวเร่งปฏิกิริยา(จากภาษากรีก "katalysis" - การทำลายล้าง) สารที่เพิ่มอัตราการเกิดปฏิกิริยาในสารผสมเรียกว่า ตัวเร่ง.ปริมาณก่อนและหลังปฏิกิริยายังคงไม่เปลี่ยนแปลง ตัวเร่งปฏิกิริยาไม่ได้เป็นตัวแทนของสารประเภทพิเศษใดๆ ในปฏิกิริยาต่างๆ โลหะ ออกไซด์ กรด เกลือ และสารประกอบเชิงซ้อนสามารถแสดงผลเป็นตัวเร่งปฏิกิริยาได้ ปฏิกิริยาเคมีในเซลล์ของสิ่งมีชีวิตดำเนินไปภายใต้การควบคุมของโปรตีนเร่งปฏิกิริยาที่เรียกว่า เอนไซม์ตัวเร่งปฏิกิริยาควรพิจารณาว่าเป็นปัจจัยทางเคมีที่แท้จริงในการเพิ่มอัตราการเกิดปฏิกิริยาเคมี เนื่องจากตัวเร่งปฏิกิริยาเกี่ยวข้องโดยตรงกับปฏิกิริยา ตัวเร่งปฏิกิริยามักจะมีประสิทธิภาพและมีความเสี่ยงน้อยกว่าในการเร่งปฏิกิริยามากกว่าการเพิ่มอุณหภูมิ สิ่งนี้แสดงให้เห็นอย่างชัดเจนในตัวอย่างของปฏิกิริยาเคมีในสิ่งมีชีวิต ปฏิกิริยา เช่น การไฮโดรไลซิสของโปรตีน ซึ่งในห้องปฏิบัติการจะต้องดำเนินการด้วยความร้อนเป็นเวลานานจนถึงจุดเดือด ในระหว่างการย่อยจะดำเนินการโดยไม่ให้ความร้อนที่อุณหภูมิของร่างกาย
เป็นครั้งแรกที่นักเคมีชาวฝรั่งเศส L.J. Tenard (1777-1857) สังเกตเห็นปรากฏการณ์การเร่งปฏิกิริยาโดยเขาค้นพบว่าออกไซด์ของโลหะบางชนิดเมื่อเติมไฮโดรเจนเปอร์ออกไซด์ลงในสารละลายจะทำให้เกิดการสลายตัว ประสบการณ์ดังกล่าวง่ายต่อการทำซ้ำโดยการเพิ่มผลึกโพแทสเซียมเปอร์แมงกาเนตลงในสารละลายไฮโดรเจนเปอร์ออกไซด์ 3% เกลือ Kmp0 4 เปลี่ยนเป็น Mn0 2 และออกซิเจนจะถูกปล่อยออกจากสารละลายอย่างรวดเร็วภายใต้การกระทำของออกไซด์:
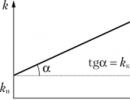
ผลกระทบโดยตรงของตัวเร่งปฏิกิริยาต่ออัตราการเกิดปฏิกิริยาสัมพันธ์กับการลดลงของพลังงานกระตุ้น ที่อุณหภูมิปกติจะลดลง? และ 20 kJ/mol จะทำให้อัตราคงที่เพิ่มขึ้นประมาณ 3000 เท่า ดาวน์เกรด E Lอาจจะแข็งแกร่งกว่ามาก อย่างไรก็ตาม การลดลงของพลังงานกระตุ้นเป็นอาการภายนอกของการกระทำของตัวเร่งปฏิกิริยา ปฏิกิริยามีลักษณะเฉพาะด้วยค่าบางอย่าง อี. วีซึ่งสามารถเปลี่ยนแปลงได้ก็ต่อเมื่อปฏิกิริยาเปลี่ยนแปลงเอง การให้ผลิตภัณฑ์ชนิดเดียวกัน ปฏิกิริยากับสารที่เติมเข้าไปจะดำเนินไปตามเส้นทางที่แตกต่างกัน ผ่านขั้นตอนต่างๆ และด้วยพลังงานกระตุ้นที่แตกต่างกัน หากในเส้นทางใหม่นี้พลังงานกระตุ้นลดลงและปฏิกิริยาเร็วขึ้นตามลำดับ เราก็บอกว่าสารนี้เป็นตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาทำปฏิกิริยากับสารตั้งต้นตัวใดตัวหนึ่ง ก่อตัวเป็นสารประกอบขั้นกลางบางตัว ในขั้นตอนต่อมาของปฏิกิริยา ตัวเร่งปฏิกิริยาจะถูกสร้างขึ้นใหม่ โดยปล่อยให้ปฏิกิริยาอยู่ในรูปแบบเดิม รีเอเจนต์ที่มีส่วนร่วมในปฏิกิริยาตัวเร่งปฏิกิริยายังคงมีปฏิสัมพันธ์ซึ่งกันและกันและไปตามเส้นทางที่ช้าโดยไม่ต้องมีส่วนร่วมของตัวเร่งปฏิกิริยา ดังนั้น ปฏิกิริยาตัวเร่งปฏิกิริยาจึงเป็นของปฏิกิริยาที่ซับซ้อนหลายอย่างที่เรียกว่าอนุกรม-ขนาน ในรูป 11.8 แสดงการขึ้นต่อกันของอัตราคงที่ต่อความเข้มข้นของตัวเร่งปฏิกิริยา กราฟการพึ่งพาอาศัยกันไม่ผ่านศูนย์ เนื่องจากหากไม่มีตัวเร่งปฏิกิริยา ปฏิกิริยาจะไม่หยุด

ข้าว. 11.8.
ค่าคงที่ที่สังเกตได้ kแสดงเป็นผลรวม คุ+ & k c(k)
ตัวอย่าง 11.5. ที่อุณหภูมิ -500 °C ปฏิกิริยาออกซิเดชันของซัลเฟอร์ออกไซด์ (IV)
ซึ่งเป็นหนึ่งในขั้นตอนของอุตสาหกรรมการผลิตกรดซัลฟิวริกที่ช้ามาก อุณหภูมิที่เพิ่มขึ้นอีกเป็นสิ่งที่ยอมรับไม่ได้ เนื่องจากสมดุลเลื่อนไปทางซ้าย (ปฏิกิริยาคายความร้อน) และผลผลิตของผลิตภัณฑ์ลดลงมากเกินไป แต่ปฏิกิริยานี้ถูกเร่งโดยตัวเร่งปฏิกิริยาต่างๆ ซึ่งหนึ่งในนั้นอาจเป็นไนตริกออกไซด์ (II) ขั้นแรก ตัวเร่งปฏิกิริยาจะทำปฏิกิริยากับออกซิเจน: ![]()
แล้วถ่ายโอนอะตอมออกซิเจนไปยังซัลเฟอร์ออกไซด์ (IV):
ดังนั้นผลิตภัณฑ์ขั้นสุดท้ายของปฏิกิริยาจึงถูกสร้างขึ้นและตัวเร่งปฏิกิริยาจะถูกสร้างขึ้นใหม่ สำหรับปฏิกิริยานั้น มีความเป็นไปได้ที่จะไหลไปตามเส้นทางใหม่ ซึ่งค่าคงที่อัตราเพิ่มขึ้นอย่างมีนัยสำคัญ:

แผนภาพด้านล่างแสดงเส้นทางทั้งสองของกระบวนการออกซิเดชัน S0 2 ในกรณีที่ไม่มีตัวเร่งปฏิกิริยา ปฏิกิริยาจะเกิดขึ้นตามเส้นทางที่ช้าเท่านั้น และในที่ที่มีตัวเร่งปฏิกิริยา ทั้งสองข้าง
ตัวเร่งปฏิกิริยามีสองประเภท - เป็นเนื้อเดียวกันและ ต่างกันในกรณีแรก ตัวเร่งปฏิกิริยาและตัวทำปฏิกิริยาจะสร้างระบบที่เป็นเนื้อเดียวกันในรูปแบบของส่วนผสมของก๊าซหรือสารละลาย ตัวอย่างของการเกิดออกซิเดชันของซัลเฟอร์ออกไซด์คือการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน อัตราของปฏิกิริยาเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันขึ้นอยู่กับทั้งความเข้มข้นของสารตั้งต้นและความเข้มข้นของตัวเร่งปฏิกิริยา
ในการเร่งปฏิกิริยาที่ต่างกัน ตัวเร่งปฏิกิริยาจะเป็นของแข็งในรูปแบบบริสุทธิ์หรือรองรับบน ผู้ให้บริการ.ตัวอย่างเช่น แพลตตินั่มเป็นตัวเร่งปฏิกิริยาสามารถแก้ไขได้บนแร่ใยหิน อลูมินา ฯลฯ โมเลกุลของรีเอเจนต์จะถูกดูดซับ (ดูดซับ) จากก๊าซหรือสารละลายที่จุดเฉพาะบนพื้นผิวของตัวเร่งปฏิกิริยา - ศูนย์กลางที่ใช้งานและถูกกระตุ้นในเวลาเดียวกัน หลังจากการเปลี่ยนแปลงทางเคมี โมเลกุลของผลิตภัณฑ์ที่ได้จะถูกดูดซับออกจากพื้นผิวของตัวเร่งปฏิกิริยา การกระทำของการเปลี่ยนรูปอนุภาคจะเกิดขึ้นซ้ำแล้วซ้ำอีกที่ศูนย์แอคทีฟ ท่ามกลางปัจจัยอื่น ๆ อัตราของปฏิกิริยาตัวเร่งปฏิกิริยาต่างกันขึ้นอยู่กับพื้นที่ผิวของวัสดุตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาต่างกันใช้กันอย่างแพร่หลายโดยเฉพาะในอุตสาหกรรม นี่เป็นเพราะความง่ายในการดำเนินการตามกระบวนการเร่งปฏิกิริยาอย่างต่อเนื่องโดยผ่านส่วนผสมของรีเอเจนต์ผ่านเครื่องมือสัมผัสที่มีตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาทำหน้าที่คัดเลือกโดยเร่งปฏิกิริยาประเภทที่เฉพาะเจาะจงมากหรือแม้แต่ปฏิกิริยาเดียวโดยไม่กระทบต่อผู้อื่น ทำให้สามารถใช้ตัวเร่งปฏิกิริยาได้ไม่เพียงแต่เร่งปฏิกิริยาเท่านั้น แต่ยังเปลี่ยนวัสดุตั้งต้นให้เป็นผลิตภัณฑ์ที่ต้องการโดยตั้งใจ มีเทนและน้ำที่อุณหภูมิ 450 ° C ในตัวเร่งปฏิกิริยา Fe 2 0 3 จะถูกแปลงเป็นคาร์บอนไดออกไซด์และไฮโดรเจน:
สารชนิดเดียวกันที่ 850 °C ทำปฏิกิริยากับผิวนิกเกิลเพื่อสร้างคาร์บอนมอนอกไซด์ (II) และไฮโดรเจน:

ตัวเร่งปฏิกิริยาเป็นสาขาวิชาเคมีที่ยังไม่สามารถคาดการณ์ตามทฤษฎีได้อย่างแม่นยำ ตัวเร่งปฏิกิริยาทางอุตสาหกรรมทั้งหมดสำหรับการแปรรูปผลิตภัณฑ์ปิโตรเลียม ก๊าซธรรมชาติ การผลิตแอมโมเนีย และอื่นๆ อีกมากมายได้รับการพัฒนาบนพื้นฐานของการศึกษาทดลองที่ใช้เวลานานและใช้เวลานาน
ความสามารถในการควบคุมความเร็วของกระบวนการทางเคมีมีความสำคัญอย่างยิ่งในกิจกรรมทางเศรษฐกิจของมนุษย์ ในอุตสาหกรรมการผลิตผลิตภัณฑ์เคมี มักจะจำเป็นต้องเพิ่มอัตราของกระบวนการทางเคมีทางเทคโนโลยี และในการจัดเก็บผลิตภัณฑ์ จำเป็นต้องลดอัตราการสลายตัวหรือการสัมผัสกับออกซิเจน น้ำ ฯลฯ สารที่รู้จักซึ่งสามารถชะลอปฏิกิริยาเคมีได้ เรียกว่า สารยับยั้ง, หรือ ตัวเร่งปฏิกิริยาเชิงลบสารยับยั้งโดยพื้นฐานแตกต่างจากตัวเร่งปฏิกิริยาจริงตรงที่พวกมันทำปฏิกิริยากับสปีชีส์ที่ทำงานอยู่ (อนุมูลอิสระ) ที่ไม่ว่าจะด้วยเหตุผลใดก็ตาม เกิดขึ้นในสารหรือสิ่งแวดล้อมของมัน และทำให้เกิดการสลายตัวที่มีคุณค่าและปฏิกิริยาออกซิเดชัน สารยับยั้งจะค่อยๆ ถูกใช้จนหมดสิ้นการกระทำในการป้องกัน สารยับยั้งที่สำคัญที่สุดคือสารต้านอนุมูลอิสระ ซึ่งปกป้องสารต่างๆ จากผลกระทบของออกซิเจน
นอกจากนี้ยังควรได้รับการเตือนถึงสิ่งที่ไม่สามารถทำได้ด้วยความช่วยเหลือของตัวเร่งปฏิกิริยา พวกมันสามารถเร่งปฏิกิริยาที่เกิดขึ้นเองได้เท่านั้น หากปฏิกิริยาไม่เกิดขึ้นเองตามธรรมชาติ ตัวเร่งปฏิกิริยาจะไม่สามารถเร่งปฏิกิริยาได้ ตัวอย่างเช่น ไม่มีตัวเร่งปฏิกิริยาใดที่สามารถทำให้น้ำย่อยสลายเป็นไฮโดรเจนและออกซิเจนได้ กระบวนการนี้สามารถทำได้โดยอิเล็กโทรไลซิสเท่านั้นในขณะที่ใช้งานไฟฟ้า
ตัวเร่งปฏิกิริยายังสามารถเปิดใช้งานกระบวนการที่ไม่ต้องการได้ ในทศวรรษที่ผ่านมา ชั้นโอโซนของบรรยากาศค่อยๆ ถูกทำลายที่ระดับความสูง 20-25 กม. สันนิษฐานว่าสารบางชนิดเกี่ยวข้องกับการสลายตัวของโอโซน เช่น สารไฮโดรคาร์บอนที่มีฮาโลเจนที่ปล่อยสู่บรรยากาศโดยผู้ประกอบการอุตสาหกรรม เช่นเดียวกับที่ใช้สำหรับวัตถุประสงค์ภายในประเทศ
สารานุกรม YouTube
1 / 5
✪ เคมีเชิงฟิสิกส์ การบรรยายที่ 3 จลนพลศาสตร์และการเร่งปฏิกิริยาเคมี
✪ เคมี จลนพลศาสตร์ของปฏิกิริยาเคมี อัตราการเกิดปฏิกิริยาเคมี ศูนย์การเรียนรู้ออนไลน์ Foxford
✪ บทเรียนวิดีโอ "ตัวเร่งปฏิกิริยาและตัวเร่งปฏิกิริยา" - เคมี - 9 เซลล์
✪ การบรรยายที่ 2 "การเร่งปฏิกิริยาในฐานะปรากฏการณ์ทางเคมีและจลนศาสตร์"
✪ ความรู้เบื้องต้นเกี่ยวกับจลนศาสตร์
คำบรรยาย
หลักการพื้นฐานของตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาจะเปลี่ยนกลไกการเกิดปฏิกิริยาไปเป็นกลไกที่เอื้ออาทรมากกว่า กล่าวคือ จะลดพลังงานกระตุ้น ตัวเร่งปฏิกิริยาก่อตัวเป็นสารประกอบขั้นกลางที่มีโมเลกุลของสารตั้งต้นตัวใดตัวหนึ่ง ซึ่งพันธะเคมีจะอ่อนตัวลง สิ่งนี้อำนวยความสะดวกในการทำปฏิกิริยากับรีเอเจนต์ที่สอง สิ่งสำคัญคือต้องสังเกตว่าตัวเร่งปฏิกิริยาเร่งปฏิกิริยาย้อนกลับได้ทั้งในทิศทางไปข้างหน้าและย้อนกลับ จึงไม่เปลี่ยนสมดุลเคมี
ประเภทของตัวเร่งปฏิกิริยา
ตามอิทธิพลของอัตราการเกิดปฏิกิริยา ตัวเร่งปฏิกิริยาจะแบ่งออกเป็นค่าบวก (อัตราการเกิดปฏิกิริยาเพิ่มขึ้น) และค่าลบ (อัตราการเกิดปฏิกิริยาลดลง) ในกรณีหลัง กระบวนการยับยั้งเกิดขึ้น ซึ่งไม่ถือว่าเป็น "ตัวเร่งปฏิกิริยาเชิงลบ" เนื่องจากตัวยับยั้งถูกใช้ในระหว่างปฏิกิริยา
ตัวเร่งปฏิกิริยาเกิดขึ้น เป็นเนื้อเดียวกันและ ต่างกัน(ติดต่อ). ในการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน ตัวเร่งปฏิกิริยาจะอยู่ในเฟสเดียวกับตัวเร่งปฏิกิริยา ในขณะที่ตัวเร่งปฏิกิริยาต่างกันจะแตกต่างกันไปตามเฟส
ตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน
ตัวอย่างของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันคือการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ต่อหน้าไอโอดีนไอออน ปฏิกิริยาดำเนินไปในสองขั้นตอน:
H 2 O 2 + I → H 2 O + IO H 2 O 2 + IO → H 2 O + O 2 + ฉัน
ในการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน การกระทำของตัวเร่งปฏิกิริยาเกิดจากการที่มันทำปฏิกิริยากับสารตั้งต้นเพื่อสร้างสารประกอบขั้นกลาง ซึ่งทำให้พลังงานกระตุ้นลดลง
ตัวเร่งปฏิกิริยาต่างกัน
ในการเร่งปฏิกิริยาที่ต่างกัน การเร่งความเร็วของกระบวนการมักจะเกิดขึ้นบนพื้นผิวของวัตถุที่เป็นของแข็ง - ตัวเร่งปฏิกิริยา ดังนั้นกิจกรรมของตัวเร่งปฏิกิริยาจึงขึ้นอยู่กับขนาดและคุณสมบัติของพื้นผิวของมัน ในทางปฏิบัติ ตัวเร่งปฏิกิริยามักจะได้รับการสนับสนุนด้วยการรองรับรูพรุนที่เป็นของแข็ง
กลไกของตัวเร่งปฏิกิริยาที่แตกต่างกันนั้นซับซ้อนกว่าตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน กลไกของตัวเร่งปฏิกิริยาต่างกันประกอบด้วยห้าขั้นตอน ซึ่งทั้งหมดสามารถย้อนกลับได้
- การแพร่กระจายของสารตั้งต้นสู่พื้นผิวของของแข็ง
- การดูดซับทางกายภาพบนตำแหน่งแอคทีฟของพื้นผิวแข็งของโมเลกุลที่ทำปฏิกิริยาแล้วตามด้วยเคมีดูดซับ
- ปฏิกิริยาเคมีระหว่างโมเลกุลที่ทำปฏิกิริยา
- การดูดซับผลิตภัณฑ์จากพื้นผิวตัวเร่งปฏิกิริยา
- การแพร่กระจายของผลิตภัณฑ์จากพื้นผิวตัวเร่งปฏิกิริยาสู่กระแสทั่วไป
ตัวอย่างของตัวเร่งปฏิกิริยาต่างกันคือการเกิดออกซิเดชันของ SO 2 ถึง SO 3 บนตัวเร่งปฏิกิริยา V 2 O 5 ในการผลิตกรดซัลฟิวริก (วิธีสัมผัส)
ขั้นตอนของปฏิกิริยาบนพื้นผิวของตัวเร่งปฏิกิริยาสามารถแสดงให้เห็นในการทดลองที่แผ่นแพลตตินั่มถูกทำให้ร้อนในเปลวไฟของเตาแก๊สจากนั้นเปลวไฟจะดับลงและไอพ่นของก๊าซจากเตาจะถูกเป่าลงบนจาน ในขณะที่จานกลายเป็นสีแดงอีกครั้ง - มีเทนออกซิเดชันเกิดขึ้นบนพื้นผิวของโลหะ
ตัวเร่งปฏิกิริยาตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาตัวเร่งปฏิกิริยา, มิฉะนั้นพื้นผิว (ตัวเร่งปฏิกิริยา) (ตัวพาหรือตัวรองรับภาษาอังกฤษ) - วัสดุเฉื่อยหรือใช้งานต่ำที่ทำหน้าที่รักษาเสถียรภาพของอนุภาคของเฟสตัวเร่งปฏิกิริยาที่ใช้งานบนพื้นผิวของมัน
บทบาทของตัวสนับสนุนในการเร่งปฏิกิริยาที่แตกต่างกันคือการป้องกันการเกาะตัวเป็นก้อนหรือการเผาผนึกของส่วนประกอบออกฤทธิ์ ซึ่งทำให้สามารถรักษาพื้นที่สัมผัสที่สูงระหว่างสารออกฤทธิ์ (ดูระยะเร่งปฏิกิริยา) กับสารตั้งต้นได้ ปริมาณของตัวพาโดยทั่วไปจะมากกว่าปริมาณของสารออกฤทธิ์ที่ใช้กับสารดังกล่าว ข้อกำหนดหลักสำหรับตัวพาคือพื้นที่ผิวขนาดใหญ่และความพรุน ความเสถียรทางความร้อน ความเฉื่อยของสารเคมี ความแข็งแรงเชิงกลสูง ในบางกรณี ตัวพาจะส่งผลต่อคุณสมบัติของเฟสแอคทีฟ (ผลของ "ปฏิกิริยาระหว่างตัวพาโลหะที่แข็งแกร่ง") ทั้งวัสดุธรรมชาติ (ดินเหนียว หินภูเขาไฟ ไดอะตอมไมต์ แร่ใยหิน ฯลฯ) และวัสดุสังเคราะห์ (ถ่านกัมมันต์ ซิลิกาเจล อะลูมิโนซิลิเกต ออกไซด์ของอะลูมิเนียม แมกนีเซียม เซอร์โคเนียม ฯลฯ) ใช้เป็นพาหะ
เคมีของตัวเร่งปฏิกิริยา
เคมีของตัวเร่งปฏิกิริยาศึกษาสารที่เปลี่ยนแปลงอัตราการเกิดปฏิกิริยาเคมี สารที่ทำให้ปฏิกิริยาช้าลงเรียกว่า สารยับยั้ง. เอนไซม์เป็นตัวเร่งปฏิกิริยาทางชีวภาพ ตัวเร่งปฏิกิริยาไม่อยู่ในความสัมพันธ์เชิงปริมาณสัมพันธ์กับผลิตภัณฑ์ และถูกสร้างขึ้นใหม่หลังจากแต่ละรอบของการแปลงสารตั้งต้นเป็นผลิตภัณฑ์ แม้จะมีวิธีการใหม่ในการกระตุ้นโมเลกุล (เคมีในพลาสมา รังสีและเลเซอร์ และอื่นๆ) ตัวเร่งปฏิกิริยาเป็นพื้นฐานของการผลิตสารเคมี (สัดส่วนสัมพัทธ์ของกระบวนการเร่งปฏิกิริยาคือ 80-90%)
ปฏิกิริยาที่เลี้ยงมนุษยชาติ (การแก้ปัญหาของไนโตรเจนที่ถูกผูกมัด) คือวัฏจักร Haber-Bosch แอมโมเนียผลิตโดยตัวเร่งปฏิกิริยาเหล็กที่มีรูพรุน เกิดขึ้นที่ P = 30 MPaและ Т = 420-500 °C
3H 2 + N 2 \u003d 2NH 3
ไฮโดรเจนสำหรับการสังเคราะห์ NH 3 ได้มาจากกระบวนการเร่งปฏิกิริยาสองขั้นตอนตามลำดับ: การแปลง CH 4 (CH 4 + H 2 O → CO + 3H 2) บน Ni - ตัวเร่งปฏิกิริยาและการแปลงคาร์บอนมอนอกไซด์ที่ได้ (CO + H 2 O → CO 2 + H 2) . เพื่อให้ได้การแปลงระดับสูง ปฏิกิริยาสุดท้ายจะดำเนินการในสองขั้นตอน: อุณหภูมิสูง (315-480 °C) - บน Fe - Cr - ตัวเร่งปฏิกิริยาออกไซด์และอุณหภูมิต่ำ (200-350 °C) - บน Cu - Zn - ตัวเร่งปฏิกิริยาออกไซด์ จากแอมโมเนีย กรดไนตริก และสารประกอบไนโตรเจนอื่นๆ ได้มาจากยาและปุ๋ยไปจนถึงวัตถุระเบิด
แยกแยะการเร่งปฏิกิริยา "" เป็นเนื้อเดียวกัน, ต่างกัน, อินเทอร์เฟซ, ไมเซลล่าร์, เอนไซม์.
พลังงานกระตุ้น อีปฏิกิริยาตัวเร่งปฏิกิริยาจะน้อยกว่าปฏิกิริยาเดียวกันในกรณีที่ไม่มีตัวเร่งปฏิกิริยา ตัวอย่างเช่น สำหรับการสลายตัวที่ไม่ใช่ตัวเร่งปฏิกิริยาของ NH 3 เป็น N 2 + H 2 อี~ 320 กิโลจูล/โมล, สำหรับการสลายตัวแบบเดียวกันต่อหน้าแพลตตินั่ม อี~ 150 กิโลจูล/โมล. ขอบคุณที่ลดค่า อีปฏิกิริยาเร่งปฏิกิริยาจะถูกเร่งเมื่อเปรียบเทียบกับปฏิกิริยาที่ไม่ใช่ตัวเร่งปฏิกิริยา
การประยุกต์ใช้ตัวเร่งปฏิกิริยาในอุตสาหกรรม
ไฮโดรจิเนชัน
ปฏิกิริยาเร่งปฏิกิริยาจำนวนมากเกี่ยวข้องกับการกระตุ้นอะตอมไฮโดรเจนและโมเลกุลอื่นๆ ซึ่งนำไปสู่ปฏิกิริยาทางเคมีของพวกมัน กระบวนการนี้เรียกว่าไฮโดรจิเนชันและรองรับหลายขั้นตอนของการกลั่นน้ำมันและการผลิตเชื้อเพลิงเหลวจากถ่านหิน (กระบวนการเบอร์จิอุส) การผลิตน้ำมันเบนซินสำหรับการบินและเชื้อเพลิงยานยนต์จากถ่านหินได้รับการพัฒนาในเยอรมนีในช่วงสงครามโลกครั้งที่สอง เนื่องจากประเทศนี้ไม่มีแหล่งน้ำมัน กระบวนการเบอร์จิอุสคือการเติมไฮโดรเจนลงในคาร์บอนโดยตรง ถ่านหินถูกทำให้ร้อนภายใต้แรงดันเมื่อมีไฮโดรเจนและได้ผลิตภัณฑ์ที่เป็นของเหลว ซึ่งจะถูกแปรรูปเป็นน้ำมันเบนซินสำหรับการบินและเชื้อเพลิงยานยนต์ ออกไซด์ของเหล็กถูกใช้เป็นตัวเร่งปฏิกิริยาเช่นเดียวกับตัวเร่งปฏิกิริยาจากดีบุกและโมลิบดีนัม ในระหว่างสงคราม ได้รับเชื้อเพลิงเหลวประมาณ 1,400 ตันต่อวันที่โรงงานในเยอรมนี 12 แห่งโดยใช้กระบวนการเบอร์จิอุส กระบวนการอื่น Fischer - Tropsch ประกอบด้วยสองขั้นตอน ประการแรกถ่านหินถูกทำให้เป็นแก๊สนั่นคือทำปฏิกิริยากับไอน้ำและออกซิเจนและได้รับส่วนผสมของไฮโดรเจนและคาร์บอนออกไซด์ ส่วนผสมนี้จะถูกแปลงเป็นเชื้อเพลิงเหลวโดยใช้ตัวเร่งปฏิกิริยาที่มีธาตุเหล็กหรือโคบอลต์ เมื่อสิ้นสุดสงคราม การผลิตเชื้อเพลิงสังเคราะห์จากถ่านหินในเยอรมนีก็หยุดลง เป็นผลมาจากการเพิ่มขึ้นของราคาน้ำมันภายหลังการคว่ำบาตรน้ำมันในปี 2516-2517 มีความพยายามอย่างมากในการพัฒนาวิธีการผลิตน้ำมันเบนซินจากถ่านหินที่ประหยัดได้ ดังนั้น การทำให้ถ่านหินเป็นของเหลวโดยตรงสามารถทำได้อย่างมีประสิทธิภาพมากขึ้นโดยใช้กระบวนการสองขั้นตอน โดยที่ถ่านหินจะถูกสัมผัสครั้งแรกกับตัวเร่งปฏิกิริยาอลูมินา-โคบอลต์-โมลิบดีนัมที่อุณหภูมิค่อนข้างต่ำและที่อุณหภูมิสูงขึ้น ค่าใช้จ่ายของน้ำมันเบนซินสังเคราะห์นั้นสูงกว่าน้ำมันที่ได้จากน้ำมัน
ตัวเร่งปฏิกิริยากรด
กิจกรรมการเร่งปฏิกิริยาของตัวเร่งปฏิกิริยาประเภทใหญ่เกิดจากคุณสมบัติที่เป็นกรด ตามคำกล่าวของ J. Bronsted และ T. Lowry กรดเป็นสารประกอบที่สามารถให้โปรตอนได้ กรดแก่สามารถบริจาคโปรตอนไปยังเบสได้อย่างง่ายดาย แนวคิดเรื่องความเป็นกรดได้รับการพัฒนาเพิ่มเติมในผลงานของ G. Lewis ผู้กำหนดกรดเป็นสารที่สามารถรับคู่อิเล็กตรอนจากสารผู้บริจาคด้วยการก่อตัวของพันธะโควาเลนต์เนื่องจากการขัดเกลาทางสังคมของอิเล็กตรอนคู่นี้ แนวคิดเหล่านี้ร่วมกับแนวคิดเกี่ยวกับปฏิกิริยาที่ก่อให้เกิดคาร์บีเนียมไอออน ช่วยให้เข้าใจกลไกของปฏิกิริยาเร่งปฏิกิริยาต่างๆ โดยเฉพาะอย่างยิ่งที่เกี่ยวข้องกับไฮโดรคาร์บอน
ความแข็งแรงของกรดสามารถกำหนดได้โดยใช้ชุดของเบสที่เปลี่ยนสีเมื่อเติมโปรตอน ปรากฎว่าตัวเร่งปฏิกิริยาที่สำคัญทางอุตสาหกรรมบางตัวทำตัวเหมือนกรดที่แรงมาก ซึ่งรวมถึงตัวเร่งปฏิกิริยาของ Friedel-Crafts เช่น HCl-AlCl 2 O 3 (หรือ HAlCl 4 ) และอะลูมิโนซิลิเกต ความแรงของกรดเป็นคุณลักษณะที่สำคัญมาก เนื่องจากเป็นตัวกำหนดอัตราการโปรตอน ซึ่งเป็นขั้นตอนสำคัญในกระบวนการเร่งปฏิกิริยาของกรด
กิจกรรมของตัวเร่งปฏิกิริยา เช่น อะลูมิโนซิลิเกตที่ใช้ในการแตกตัวของน้ำมันนั้นพิจารณาจากการมีอยู่ของกรดบรอนสเต็ดและลิวอิสบนผิวของพวกมัน โครงสร้างของมันคล้ายกับโครงสร้างของซิลิกา (ซิลิกอนไดออกไซด์) ซึ่งอะตอม Si 4+ บางตัวจะถูกแทนที่ด้วยอะตอม Al 3+ ประจุลบส่วนเกินที่เกิดขึ้นในกรณีนี้สามารถถูกทำให้เป็นกลางโดยไอออนบวกที่เกี่ยวข้อง
กิจกรรมของตัวเร่งปฏิกิริยากรดถูกกำหนดโดยความสามารถในการทำปฏิกิริยากับไฮโดรคาร์บอนด้วยการก่อตัวของคาร์บีเนียมไอออนเป็นผลิตภัณฑ์ขั้นกลาง ไอออนของอัลคิลคาร์บีเนียมประกอบด้วยอะตอมของคาร์บอนที่มีประจุบวกที่ถูกพันธะกับหมู่อัลคิลและ/หรือไฮโดรเจนสามหมู่ พวกมันมีบทบาทสำคัญในฐานะตัวกลางที่เกิดขึ้นในหลายปฏิกิริยาที่เกี่ยวข้องกับสารประกอบอินทรีย์ กลไกการออกฤทธิ์ของตัวเร่งปฏิกิริยากรดสามารถแสดงให้เห็นได้โดยตัวอย่างของปฏิกิริยาไอโซเมอไรเซชัน น-บิวเทนเป็นไอโซบิวเทนต่อหน้า HCl-AlCl 3 หรือ Pt-Cl-Al 2 O 3 ประการแรก โอเลฟิน C 4 H 8 จำนวนเล็กน้อยจับกับไฮโดรเจนไอออนที่มีประจุบวกของตัวเร่งปฏิกิริยากรดเพื่อสร้างคาร์บีเนียมไอออนในระดับอุดมศึกษา จากนั้นไฮไดรด์ไอออนที่มีประจุลบ H - แยกออกจาก น-บิวเทนเพื่อสร้างไอโซบิวเทนและบิวทิลคาร์บีเนียมไอออนทุติยภูมิ อันเป็นผลมาจากการจัดเรียงใหม่กลายเป็นคาร์บีเนียมไอออนระดับอุดมศึกษา สายโซ่นี้สามารถดำเนินต่อไปได้ด้วยการกำจัดไฮไดรด์ไอออนออกจากโมเลกุลถัดไป น- บิวเทน ฯลฯ
อย่างมีนัยสำคัญ คาร์บีเนียมไอออนในระดับอุดมศึกษามีความเสถียรมากกว่าไอออนปฐมภูมิหรือทุติยภูมิ เป็นผลให้ส่วนใหญ่มีอยู่บนพื้นผิวของตัวเร่งปฏิกิริยา ดังนั้นผลิตภัณฑ์หลักของไอโซเมอไรเซชันของบิวเทนคือไอโซบิวเทน
ตัวเร่งปฏิกิริยากรดใช้กันอย่างแพร่หลายในการกลั่นน้ำมัน - การแตกร้าว, alkylation, โพลีเมอไรเซชันและไอโซเมอไรเซชันของไฮโดรคาร์บอน กลไกการออกฤทธิ์ของคาร์บีเนียมไอออนซึ่งมีบทบาทเป็นตัวเร่งปฏิกิริยาในกระบวนการเหล่านี้ได้รับการจัดตั้งขึ้น ในเวลาเดียวกัน พวกมันมีส่วนร่วมในปฏิกิริยาจำนวนหนึ่ง รวมถึงการก่อตัวของโมเลกุลขนาดเล็กโดยการแยกโมเลกุลขนาดใหญ่ การรวมกันของโมเลกุล (โอเลฟินกับโอเลฟินหรือโอเลฟินกับไอโซพาราฟิน) การจัดเรียงโครงสร้างใหม่ด้วยไอโซเมอไรเซชัน การก่อตัวของพาราฟินและอะโรมาติกไฮโดรคาร์บอน โดยการถ่ายโอนไฮโดรเจน
การใช้ตัวเร่งปฏิกิริยากรดในอุตสาหกรรมล่าสุดคือการผลิตเชื้อเพลิงที่มีสารตะกั่วโดยการเติมแอลกอฮอล์ลงในไอโซบิวทิลีนหรือไอโซเอมิลีน การเติมสารประกอบออกซิเจนลงในน้ำมันเบนซินช่วยลดความเข้มข้นของคาร์บอนมอนอกไซด์ในไอเสีย เมทิล- tert-บิวทิลอีเทอร์ (MTBE) ที่มีค่าออกเทนผสม 109 ยังช่วยให้ได้รับเชื้อเพลิงออกเทนสูงที่จำเป็นสำหรับการทำงานของเครื่องยนต์รถยนต์ที่มีอัตราส่วนการอัดสูงโดยไม่ต้องหันไปใช้ตะกั่วเตตระเอทิลในน้ำมันเบนซิน มีการจัดการผลิตเชื้อเพลิงที่มีค่าออกเทน 102 และ 111 ด้วย
ไฮโดรจีเนชั่นของน้ำมันพืช
ปฏิกิริยาไฮโดรจิเนชันที่สำคัญที่สุดอย่างหนึ่งในทางปฏิบัติคือการเติมไฮโดรเจนที่ไม่สมบูรณ์ของน้ำมันพืชเป็นมาการีน น้ำมันปรุงอาหาร และผลิตภัณฑ์อาหารอื่นๆ น้ำมันพืชได้มาจากถั่วเหลือง เมล็ดฝ้าย และพืชผลอื่นๆ พวกเขารวมถึงเอสเทอร์คือไตรกลีเซอไรด์ของกรดไขมันที่มีระดับความอิ่มตัวต่างกัน กรดโอเลอิก CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH มีพันธะคู่หนึ่งตัว C \u003d C กรดไลโนเลอิก - สองและลิโนเลนิก - สาม การเติมไฮโดรเจนเพื่อทำลายพันธะนี้จะป้องกันไม่ให้น้ำมันออกซิไดซ์ (หืน) สิ่งนี้จะเพิ่มจุดหลอมเหลว ความแข็งของผลิตภัณฑ์ส่วนใหญ่ที่ได้รับขึ้นอยู่กับระดับของไฮโดรเจน ไฮโดรจิเนชันจะดำเนินการต่อหน้าผงละเอียดของนิกเกิลที่สะสมอยู่บนพื้นผิวหรือตัวเร่งปฏิกิริยานิกเกิลของ Raney ในบรรยากาศไฮโดรเจนที่มีความบริสุทธิ์สูง
ดีไฮโดรจีเนชัน
ดีไฮโดรจีเนชันยังเป็นปฏิกิริยาเร่งปฏิกิริยาที่มีความสำคัญทางอุตสาหกรรม แม้ว่าสเกลของการใช้งานจะเล็กกว่าอย่างหาที่เปรียบไม่ได้ ด้วยความช่วยเหลือเช่นสไตรีนซึ่งเป็นโมโนเมอร์ที่สำคัญ เมื่อต้องการทำเช่นนี้ dehydrogenate ethylbenzene ต่อหน้าตัวเร่งปฏิกิริยาที่มีเหล็กออกไซด์ โพแทสเซียมและสารทำให้คงตัวของโครงสร้างบางชนิดก็มีส่วนทำให้เกิดปฏิกิริยาเช่นกัน ในระดับอุตสาหกรรม โพรเพน บิวเทน และอัลเคนอื่นๆ จะถูกขจัดไฮโดรเจน การดีไฮโดรจีเนชันของบิวเทนเมื่อมีตัวเร่งปฏิกิริยาอะลูมินา-โครเมียมทำให้เกิดบิวทีนและบิวทาไดอีน
แอมโมเนีย
กระบวนการไฮโดรจิเนชันที่ง่ายที่สุดวิธีหนึ่งจากมุมมองทางเคมีคือการสังเคราะห์แอมโมเนียจากไฮโดรเจนและไนโตรเจน ไนโตรเจนเป็นสารเฉื่อยมาก ในการทำลายพันธะ N-N ในโมเลกุลนั้น จำเป็นต้องมีพลังงาน 200 kcal / mol อย่างไรก็ตาม ไนโตรเจนจับกับพื้นผิวของตัวเร่งปฏิกิริยาเหล็กในสถานะอะตอม และต้องใช้เพียง 20 กิโลแคลอรีต่อโมล ไฮโดรเจนจับกับเหล็กได้ง่ายยิ่งขึ้น
ตัวเร่งปฏิกิริยาพื้นฐาน
กิจกรรมของตัวเร่งปฏิกิริยาถูกกำหนดโดยคุณสมบัติพื้นฐานของพวกมัน ตัวอย่างที่เก่าแก่และเป็นที่รู้จักของตัวเร่งปฏิกิริยาดังกล่าวคือโซเดียมไฮดรอกไซด์ที่ใช้ในการไฮโดรไลซ์หรือซาโปนิฟายไขมันในการผลิตสบู่ และตัวอย่างล่าสุดคือตัวเร่งปฏิกิริยาที่ใช้ในการผลิตพลาสติกโพลียูรีเทนและโฟม ยูรีเทนเกิดขึ้นจากปฏิกิริยาระหว่างแอลกอฮอล์กับไอโซไซยาเนต และปฏิกิริยานี้จะถูกเร่งเมื่อมีเอมีนเป็นเบส ในระหว่างการทำปฏิกิริยา เบสจะยึดติดกับอะตอมของคาร์บอนในโมเลกุลไอโซไซยาเนต อันเป็นผลมาจากการที่มีประจุลบปรากฏบนอะตอมไนโตรเจนและกิจกรรมของอะตอมในส่วนที่เกี่ยวกับแอลกอฮอล์เพิ่มขึ้น ตัวเร่งปฏิกิริยาที่มีประสิทธิภาพโดยเฉพาะคือไตรเอทิลีนไดเอมีน พลาสติกโพลียูรีเทนได้มาจากการทำปฏิกิริยาไดไอโซไซยาเนตกับโพลิออล (polyalcohols) เมื่อไอโซไซยาเนตทำปฏิกิริยากับน้ำ ยูรีเทนที่ก่อตัวก่อนหน้านี้จะสลายตัวโดยปล่อย CO2 เมื่อส่วนผสมของโพลีแอลกอฮอล์และน้ำทำปฏิกิริยากับไดไอโซไซยาเนต โฟมโพลียูรีเทนที่เป็นผลลัพธ์จะมีคาร์บอนไดออกไซด์ก๊าซ CO 2
ตัวเร่งปฏิกิริยาแบบคู่
ตัวเร่งปฏิกิริยาเหล่านี้เร่งปฏิกิริยาสองประเภทและให้ผลลัพธ์ที่ดีกว่าการส่งตัวทำปฏิกิริยาแบบอนุกรมผ่านเครื่องปฏิกรณ์สองเครื่องซึ่งแต่ละเครื่องประกอบด้วยตัวเร่งปฏิกิริยาเพียงประเภทเดียว นี่เป็นเพราะความจริงที่ว่าไซต์ที่ใช้งานของตัวเร่งปฏิกิริยาแบบ double-acting อยู่ใกล้กันมากและผลิตภัณฑ์ขั้นกลางที่เกิดขึ้นจากตัวใดตัวหนึ่งจะกลายเป็นผลิตภัณฑ์สุดท้ายในอีกด้านหนึ่งทันที การรวมตัวเร่งปฏิกิริยากระตุ้นไฮโดรเจนกับไอโซเมอไรเซชันของไฮโดรคาร์บอนที่ส่งเสริมตัวเร่งปฏิกิริยาให้ผลลัพธ์ที่ดี การกระตุ้นของไฮโดรเจนนั้นกระทำโดยโลหะบางชนิด และการทำไอโซเมอไรเซชันของไฮโดรคาร์บอนด้วยกรด ตัวเร่งปฏิกิริยาที่ออกฤทธิ์สองทางที่มีประสิทธิภาพซึ่งใช้ในการกลั่นน้ำมันเพื่อเปลี่ยนแนฟทาเป็นน้ำมันเบนซินนั้นจะถูกกระจายอย่างประณีตแพลตตินัมที่ฝากไว้บนกรดอลูมินา การเปลี่ยนส่วนประกอบแนฟทา เช่น เมทิลไซโคลเพนเทน เมทิลไซโคลเพนเทน (MCP) เป็นเบนซีนจะเพิ่มค่าออกเทนของน้ำมันเบนซิน ประการแรก MCP ถูกดีไฮโดรจิเนตบนส่วนแพลตตินัมของตัวเร่งปฏิกิริยาให้เป็นโอเลฟินที่มีแกนหลักคาร์บอนเดียวกัน จากนั้นโอเลฟินจะผ่านไปยังส่วนที่เป็นกรดของตัวเร่งปฏิกิริยา โดยที่ไอโซเมอไรซ์กับไซโคลเฮกซีน ส่วนหลังผ่านไปยังส่วนแพลตตินัมและดีไฮโดรจีเนตไปยังเบนซีนและไฮโดรเจน ตัวเร่งปฏิกิริยาแบบ Dual Action ช่วยเร่งการปฏิรูปน้ำมันอย่างมีนัยสำคัญ ใช้เพื่อแยกพาราฟินปกติให้เป็นไอโซพาราฟิน การต้มที่อุณหภูมิเดียวกับเศษส่วนของน้ำมันนั้นมีค่าเพราะมีค่าออกเทนสูงกว่าเมื่อเทียบกับไฮโดรคาร์บอนแบบตรง นอกจากนี้ การเปลี่ยนเอ็น-บิวเทนเป็นไอโซบิวเทนจะมาพร้อมกับดีไฮโดรจีเนชัน ซึ่งมีส่วนสำคัญในการผลิต MTBE
การเกิดพอลิเมอไรเซชันแบบสเตอริโอ
เหตุการณ์สำคัญในประวัติศาสตร์ของตัวเร่งปฏิกิริยาคือการค้นพบพอลิเมอไรเซชันตัวเร่งปฏิกิริยาของโอเลฟินส์ด้วยการก่อตัวของพอลิเมอร์แบบสเตอริโอเรกูลาร์ K. Ziegler ค้นพบตัวเร่งปฏิกิริยาโพลีเมอไรเซชันแบบ Stereospecific เมื่อเขาพยายามอธิบายคุณสมบัติที่ผิดปกติของโพลีเมอร์ที่เขาได้รับ J. Natta นักเคมีอีกคนหนึ่งแนะนำว่าเอกลักษณ์ของโพลีเมอร์ Ziegler นั้นพิจารณาจากความสม่ำเสมอของพวกมัน การทดลองการเลี้ยวเบนของรังสีเอกซ์ได้แสดงให้เห็นว่าพอลิเมอร์ที่เตรียมจากโพรพิลีนต่อหน้าตัวเร่งปฏิกิริยา Ziegler จะมีลักษณะเป็นผลึกสูงและมีโครงสร้างแบบสเตอริโอเรกูลาร์ ณัฐฐาแนะนำคำว่า "ไอโซแทคติก" และ "ซินดิโอแทคติก" เพื่ออธิบายโครงสร้างที่ได้รับคำสั่งดังกล่าว เมื่อไม่มีระเบียบก็จะใช้คำว่า "อาถรรพ์"
ปฏิกิริยาความจำเพาะแบบสเตอริโอเกิดขึ้นบนพื้นผิวของตัวเร่งปฏิกิริยาที่เป็นของแข็งที่มีโลหะทรานซิชันของกลุ่ม IVA-VIII (เช่น Ti, V, Cr, Zr) ในสถานะออกซิไดซ์ที่ไม่สมบูรณ์ และสารประกอบใดๆ ที่มีคาร์บอนหรือไฮโดรเจน ซึ่งเกี่ยวข้องกับโลหะจาก กลุ่ม I-III ตัวอย่างคลาสสิกของตัวเร่งปฏิกิริยาดังกล่าวคือการตกตะกอนที่เกิดขึ้นระหว่างการทำงานร่วมกันของ TiCl 4 และ Al(C 2 H 5) 3 ในเฮปเทน โดยที่ไททาเนียมจะลดสถานะเป็นไตรวาเลนต์ ระบบที่แอคทีฟอย่างยิ่งนี้จะเร่งปฏิกิริยาพอลิเมอไรเซชันของโพรพิลีนที่อุณหภูมิและความดันปกติ
ตัวเร่งปฏิกิริยาออกซิเดชัน
การใช้ตัวเร่งปฏิกิริยาเพื่อควบคุมเคมีของกระบวนการออกซิเดชันมีความสำคัญทางวิทยาศาสตร์และทางปฏิบัติอย่างมาก ในบางกรณี การเกิดออกซิเดชันต้องสมบูรณ์ ตัวอย่างเช่น เมื่อทำให้ CO และสารปนเปื้อนไฮโดรคาร์บอนเป็นกลางในไอเสียรถยนต์ อย่างไรก็ตาม บ่อยครั้ง เป็นที่พึงปรารถนาที่การเกิดออกซิเดชันไม่สมบูรณ์ ตัวอย่างเช่น ในหลายกระบวนการที่ใช้กันอย่างแพร่หลายในอุตสาหกรรมสำหรับการแปลงไฮโดรคาร์บอนให้เป็นตัวกลางที่มีคุณค่าซึ่งมีหมู่ฟังก์ชันเช่น -CHO, -COOH, -C-CO, - ซีเอ็น. ในกรณีนี้จะใช้ตัวเร่งปฏิกิริยาทั้งที่เป็นเนื้อเดียวกันและต่างกัน ตัวอย่างของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันคือสารเชิงซ้อนของโลหะทรานซิชัน ซึ่งใช้ในการออกซิไดซ์พาราไซลีนไปเป็นกรดเทเรฟทาลิก ซึ่งเป็นเอสเทอร์ที่เป็นพื้นฐานสำหรับการผลิตเส้นใยโพลีเอสเตอร์
การผลิตเอทิลีนด้วยก๊าซมีเทนดีไฮโดรไดเมอไรเซชัน
การสังเคราะห์เอทิลีนผ่านกระบวนการดีไฮโดรไดเมอไรเซชันช่วยให้ก๊าซธรรมชาติถูกแปลงเป็นไฮโดรคาร์บอนที่เคลื่อนย้ายได้ง่ายกว่า ปฏิกิริยา 2CH 4 + 2O 2 → C 2 H 4 + 2H 2 O ดำเนินการที่ 850 ° C โดยใช้ตัวเร่งปฏิกิริยาต่างๆ ผลลัพธ์ที่ดีที่สุดจะได้รับด้วยตัวเร่งปฏิกิริยา Li-MgO สันนิษฐานได้ว่าปฏิกิริยาเกิดขึ้นจากการก่อตัวของเมทิลเรดิคัลโดยแยกอะตอมไฮโดรเจนออกจากโมเลกุลมีเทน ความแตกแยกดำเนินการโดยออกซิเจนที่ลดลงอย่างไม่สมบูรณ์เช่น O2−
2. เมทิลแรดิคัลในเฟสของแก๊สจะรวมตัวกันใหม่เพื่อสร้างโมเลกุลอีเทนและถูกแปลงเป็นเอทิลีนในระหว่างการดีไฮโดรจีเนชันที่ตามมา อีกตัวอย่างหนึ่งของการเกิดออกซิเดชันที่ไม่สมบูรณ์คือการเปลี่ยนเมทานอลเป็นฟอร์มาลดีไฮด์ต่อหน้าตัวเร่งปฏิกิริยาเงินหรือเหล็ก-โมลิบดีนัม
ตัวเร่งปฏิกิริยาออกซิเดชันต่างกัน
ตัวเร่งปฏิกิริยาเหล่านี้มักจะเป็นของแข็งออกไซด์ที่ซับซ้อน ตัวเร่งปฏิกิริยาออกซิเดชันเกิดขึ้นในสองขั้นตอน อย่างแรก ออกซิเจนออกไซด์ถูกจับโดยโมเลกุลไฮโดรคาร์บอนที่ดูดซับบนผิวออกไซด์ ไฮโดรคาร์บอนถูกออกซิไดซ์และออกไซด์จะลดลง ออกไซด์ที่ลดลงจะทำปฏิกิริยากับออกซิเจนและกลับสู่สภาพเดิม การใช้ตัวเร่งปฏิกิริยาวาเนเดียม phthalic anhydride ได้มาจากการออกซิเดชันบางส่วนของแนฟทาลีนหรือบิวเทน
คำจำกัดความของตัวเร่งปฏิกิริยา ประเภทของตัวเร่งปฏิกิริยา. การดูดซึมเคมีและการก่อตัวของสารเชิงซ้อนที่กระตุ้นระดับกลาง พลังงานกระตุ้นของปฏิกิริยาเร่งปฏิกิริยา ตัวเร่งปฏิกิริยาและสมดุล การประยุกต์ใช้ตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยา- ปรากฏการณ์การกระตุ้นปฏิกิริยาเคมีด้วยสารพิเศษ - ตัวเร่งปฏิกิริยา ตัวเร่งปฏิกิริยาเข้าสู่ปฏิกิริยาเคมีขั้นกลางซ้ำแล้วซ้ำอีกกับสารที่เกี่ยวข้องกับปฏิกิริยาและคืนค่าองค์ประกอบหลังจากแต่ละรอบของปฏิกิริยาระดับกลาง
ตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน– สารตั้งต้นและตัวเร่งปฏิกิริยาเกิดเป็นเฟสเดียว
ตัวเร่งปฏิกิริยาต่างกัน- สารและตัวเร่งปฏิกิริยามีระยะต่างกัน
ตัวเร่งปฏิกิริยาจุลภาคตรงบริเวณตำแหน่งกลางระหว่างการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันและต่างกัน ตัวเร่งปฏิกิริยาคือโมเลกุลโพลีเมอร์ขนาดใหญ่ สำหรับโมเลกุลขนาดเล็กที่มีปฏิสัมพันธ์กับพวกมัน พวกมันจะคล้ายกับอนุภาคที่ต่างกัน แต่พวกมันก่อตัวเป็นเฟสเดียวกับตัวทำปฏิกิริยา กลุ่มนี้รวมถึงปฏิกิริยาของเอนไซม์ซึ่งตัวเร่งปฏิกิริยา (เอนไซม์) เป็นโมเลกุลโปรตีนขนาดใหญ่ที่มีองค์ประกอบและโครงสร้างที่ซับซ้อน จึงเรียกว่า ตัวเร่งปฏิกิริยาของเอนไซม์
การเปลี่ยนแปลงทางเคมีเกิดขึ้นจากการก่อตัวของสารเชิงซ้อนที่มีพลังงานมากเกินไป เพียงพอสำหรับการจัดเรียงสารใหม่ - ผลิตภัณฑ์ปฏิกิริยา การเปลี่ยนแปลงพลังงานของระบบระหว่างปฏิกิริยาเคมีตามเส้นทางปฏิกิริยา (1)
เอ - แอคทีฟคอมเพล็กซ์
K - การเชื่อมต่อระดับกลางกับตัวเร่งปฏิกิริยา
E 0, E k - พลังงานของสารและผลิตภัณฑ์เริ่มต้น
E 1, E 2 - พลังงานกระตุ้นของการเปลี่ยนแปลงในทิศทางไปข้างหน้าและย้อนกลับ
∆H คือการเปลี่ยนแปลงของพลังงานอันเป็นผลมาจากการเปลี่ยนแปลง (ความร้อน)
แต่ไม่ใช่ว่าทุกโมเลกุลจะมีพลังงานเพียงพอที่จะสร้างสารเชิงซ้อน - เฉพาะโมเลกุลที่มีพลังงานเกินพลังงานกระตุ้น E 1 หากพลังงานที่ต้องการ E 1 มาก ปฏิกิริยาจะไม่เกิดขึ้นจริง
ตัวเร่งปฏิกิริยาเปิดเส้นทางปฏิกิริยาใหม่โดยทำปฏิกิริยาทางเคมีเพื่อสร้างสารเชิงซ้อนที่ถูกกระตุ้นซึ่งมีพลังงานน้อยกว่าที่จำเป็นในการสร้างสารเชิงซ้อนที่ถูกกระตุ้นโดยไม่มีตัวเร่งปฏิกิริยา สารประกอบขั้นกลาง ซึ่งรวมถึงตัวเร่งปฏิกิริยา จะถูกแปลงเป็นผลิตภัณฑ์เพิ่มเติมผ่านสารเชิงซ้อนที่กระตุ้นอีกตัวหนึ่ง แต่ยังมีพลังงานต่ำกว่าด้วย หลังจากขั้นตอนที่สองของปฏิกิริยา ตัวเร่งปฏิกิริยาจะคืนค่าองค์ประกอบทางเคมีและส่วนประกอบจะไม่รวมอยู่ในองค์ประกอบของผลิตภัณฑ์ และแม้ว่าเส้นทางของปฏิกิริยาจะยาวขึ้นและกลายเป็นระยะ การลดลงของพลังงานของสารเชิงซ้อนที่กระตุ้นจะทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น (2)
ไม่ทราบแหล่งที่มา
ความสนใจเป็นพิเศษในการเร่งปฏิกิริยาปรากฏขึ้นในระหว่างการพัฒนาเคมีอุตสาหกรรม เนื่องจากความสามารถในการเร่งปฏิกิริยาเคมีในทิศทางที่ถูกต้องโดยไม่ต้องใช้พลังงานและโดยพื้นฐานแล้วโดยไม่ใช้สารตัวเร่งปฏิกิริยาทำให้ตัวเร่งปฏิกิริยามีความสำคัญในทางปฏิบัติอย่างมาก ด้วยความช่วยเหลือของตัวเร่งปฏิกิริยา ปัญหาที่ต้องเผชิญกับเทคโนโลยีของไนโตรเจนที่ถูกผูกไว้ได้รับการแก้ไข น้ำมันมากกว่า 80% ถูกประมวลผลโดยใช้กระบวนการเร่งปฏิกิริยา เป็นไปไม่ได้ที่จะดำเนินการส่วนใหญ่กระบวนการสังเคราะห์สารอินทรีย์
ตัวเร่งปฏิกิริยา- สารที่เข้าสู่ปฏิกิริยาระดับกลางซ้ำ ๆ กับผู้เข้าร่วมในปฏิกิริยาเปลี่ยนกลไกของมันและเพิ่มอัตราการเกิดปฏิกิริยา ในเวลาเดียวกัน พวกเขาคืนค่าองค์ประกอบทางเคมีของพวกเขาหลังจากแต่ละรอบของการสัมผัสปานกลาง
ผลของตัวเร่งปฏิกิริยาต่อกลไกของปฏิกิริยาเคมีสามารถอธิบายได้ด้วยตัวอย่างทั่วไป ปล่อยให้ปฏิกิริยาขั้นตอนเดียวดำเนินไปพร้อมกับพลังงานกระตุ้น E 0:
เส้นทางของปฏิกิริยาบนแผนภาพพลังงานของปฏิกิริยาตัวเร่งปฏิกิริยาและปฏิกิริยาที่ไม่ใช่ตัวเร่งปฏิกิริยาจะแสดงโดยเส้นโค้ง 1 เมื่อมีตัวเร่งปฏิกิริยา กลไกการเกิดปฏิกิริยาจะเปลี่ยนไป และจะดำเนินผ่านหลายขั้นตอนต่อเนื่องกัน (เส้นโค้งที่ 2) ตัวอย่างเช่น ระยะแรกอาจเป็นการก่อตัวของคอมเพล็กซ์ Akt ที่เปิดใช้งานระดับกลาง:
A + Kt → AKt
สารเชิงซ้อนที่ถูกกระตุ้นจะทำปฏิกิริยากับสารตั้งต้นที่สองเพื่อสร้างสารเชิงซ้อนของผลิตภัณฑ์ตัวเร่งปฏิกิริยา:
ACT + V → RKt
ขั้นตอนสุดท้ายคือการสลายตัวของคอมเพล็กซ์ RKt ด้วยการก่อตัวของผลิตภัณฑ์ K และการปล่อยตัวเร่งปฏิกิริยาสำหรับวัฏจักรตัวเร่งปฏิกิริยาใหม่:
Rkt → R + Kt
แต่ละขั้นตอนต่อเนื่องกันเหล่านี้มีลักษณะเฉพาะด้วยพลังงานกระตุ้น E 1 , E 2 , E 3 แต่ตามกฎแล้ว ความสูงของสิ่งกีดขวางที่อาจเกิดขึ้นเหล่านี้จะต่ำกว่าพลังงานกระตุ้น E 0 . ดังนั้นเมื่อมีตัวเร่งปฏิกิริยา ปฏิกิริยาจะดำเนินไปในเส้นทางที่มีพลังมากขึ้น ซึ่งช่วยให้กระบวนการดำเนินไปในอัตราที่สูงขึ้น
สถานะพลังงานเริ่มต้น (I) และขั้นสุดท้าย (II) ของระบบปฏิกิริยาต่อหน้าตัวเร่งปฏิกิริยาและหากไม่มีมันจะยังคงเหมือนเดิม เพราะฉะนั้น: ตัวเร่งปฏิกิริยาไม่สามารถเปลี่ยนสถานะของสมดุลเคมี ซึ่งไม่ขึ้นกับเส้นทางของปฏิกิริยา
บทบาทของตัวเร่งปฏิกิริยาเป็นเพียงการเปลี่ยนแปลงอัตราที่ไปถึงสภาวะสมดุล ตัวเร่งปฏิกิริยาสามารถเพิ่มอัตราของเฉพาะกระบวนการที่ได้รับอนุญาตทางเทอร์โมไดนามิกส์ แต่ไม่สามารถเริ่มต้นปฏิกิริยาที่เป็นไปไม่ได้ทางเทอร์โมไดนามิกส์
ปฏิกิริยาเคมีบางอย่างที่ไม่มีตัวเร่งปฏิกิริยานั้นแทบจะเป็นไปไม่ได้เลย เนื่องจากมีพลังงานกระตุ้นสูงเกินไป ดูเหมือนว่าเพื่อที่จะเอาชนะสิ่งกีดขวางพลังงานสูงมันเป็นไปได้ที่จะเพิ่มพลังงานจลน์ของโมเลกุลนั่นคือเพิ่มอุณหภูมิ แต่สำหรับปฏิกิริยาคายความร้อนแบบย้อนกลับได้หลายอย่าง การเพิ่มขึ้นของอุณหภูมิทำให้เกิดการเปลี่ยนแปลงในสมดุลไปในทิศทางตรงกันข้าม และทำให้ปฏิกิริยาไม่ได้รับการแก้ไขทางอุณหพลศาสตร์ ในกรณีเช่นนี้ การใช้ตัวเร่งปฏิกิริยาไม่เพียงแต่มีเหตุผลเท่านั้น แต่ยังจำเป็นด้วย ตัวเร่งปฏิกิริยาลดลง พลังงานกระตุ้นและทำให้สามารถดำเนินการได้ที่อุณหภูมิต่ำกว่าอย่างมีนัยสำคัญ
โมเลกุลของตัวทำปฏิกิริยาถูกดูดซับบนผิวตัวเร่งปฏิกิริยา การดูดซับเป็นปรากฏการณ์ที่เกี่ยวข้องกับการลดลงของปริมาณก๊าซเมื่อก๊าซ (ตัวดูดซับ) สัมผัสกับของแข็ง (ตัวดูดซับ) และประกอบด้วยการอัดตัวของก๊าซบนพื้นผิวของของแข็ง การดูดซับทางกายภาพและการดูดซับเคมีจะแตกต่างกันไปตามลักษณะของแรงที่ทำให้เกิดความเข้มข้นของโมเลกุลดูดซับนี้ที่พื้นผิวของของแข็ง หากแรงเหล่านี้มีลักษณะเดียวกับการกระทำของโมเลกุลในก๊าซ ของเหลว และของแข็ง แสดงว่ามีการดูดซับทางกายภาพ ที่ การดูดซึมเคมีแรงปฏิสัมพันธ์ของธรรมชาติทางเคมีปรากฏขึ้น - โมเลกุลของตัวดูดซับสูญเสียความเป็นตัวของตัวเองทำให้เกิดสารประกอบบนพื้นผิวด้วยตัวดูดซับ
ในกระบวนการเร่งปฏิกิริยา บทบาทหลักเป็นของ chemisorption หรือการดูดซับแบบกระตุ้นซึ่งส่งผลให้เกิดการก่อตัว คอมเพล็กซ์การดูดซับที่เปิดใช้งาน- ตัวกลางที่ไม่เสถียรระหว่างตัวทำปฏิกิริยากับตัวเร่งปฏิกิริยา ขั้นตอนการดูดซับแบบกระตุ้นจะกำหนดความจำเพาะของการกระทำของตัวเร่งปฏิกิริยาที่สัมพันธ์กับปฏิกิริยาต่างๆ หากพันธะเคมีของสารตั้งต้นกับตัวดูดซับแรงเกินไป การทำลายการก่อตัวของสารเชิงซ้อนซึ่งนำไปสู่การก่อตัวของผลิตภัณฑ์นั้นทำได้ยาก หากพันธะระหว่างตัวดูดซับและตัวดูดซับอ่อนเกินไป ใกล้เคียงกับธรรมชาติต่อการดูดซับทางกายภาพ พันธะในโมเลกุลของตัวดูดซับจะไม่คลายตัว ซึ่งทำให้พลังงานกระตุ้นของกระบวนการเร่งปฏิกิริยาลดลงเมื่อเทียบกับสารที่ไม่ใช่ ตัวเร่งปฏิกิริยาหนึ่ง
เทคโนโลยีเคมีทั่วไป, Kutepov A.M., Moscow, Higher School, 1990, pp. 206-207, 214, 205
ตัวเร่งปฏิกิริยา(กรีก κατάλυσις กลับไปที่ καταλύειν - การทำลายล้าง) - การเร่งความเร็วแบบเลือกของหนึ่งในทิศทางที่เป็นไปได้ทางอุณหพลศาสตร์ที่เป็นไปได้ของปฏิกิริยาเคมีภายใต้การกระทำของตัวเร่งปฏิกิริยา (s) ซึ่งเข้าสู่ปฏิกิริยาเคมีระดับกลางซ้ำ ๆ กับผู้เข้าร่วมในปฏิกิริยาและ คืนค่าองค์ประกอบทางเคมีหลังจากแต่ละรอบของปฏิกิริยาเคมีระดับกลาง คำว่า "catalysis" ถูกนำมาใช้ในปี 1835 โดยนักวิทยาศาสตร์ชาวสวีเดน Jöns Jakob Berzelius กรดไนตริก ฯลฯ) ปฏิกิริยาทางอุตสาหกรรมทั้งหมดส่วนใหญ่เป็นตัวเร่งปฏิกิริยา (catalyst) กรณีที่ตัวเร่งปฏิกิริยาเป็นหนึ่งในผลิตภัณฑ์ปฏิกิริยาหรือวัสดุเริ่มต้นเรียกว่าตัวเร่งปฏิกิริยาแบบอัตโนมัติ (autocatalysis) ตัวเร่งปฏิกิริยาจะเปลี่ยนกลไกของปฏิกิริยาให้เป็นตัวเร่งปฏิกิริยาที่มีแนวโน้มดีขึ้นอย่างกระฉับกระเฉง กล่าวคือ ลดพลังงานกระตุ้น ตัวเร่งปฏิกิริยาก่อตัวเป็นสารประกอบขั้นกลางที่มีโมเลกุลของสารตั้งต้นตัวใดตัวหนึ่ง ซึ่งพันธะเคมีจะอ่อนตัวลง สิ่งนี้อำนวยความสะดวกในการทำปฏิกิริยากับรีเอเจนต์ที่สอง สิ่งสำคัญคือต้องสังเกตว่าตัวเร่งปฏิกิริยาเร่งปฏิกิริยาย้อนกลับได้ทั้งในทิศทางไปข้างหน้าและย้อนกลับ จึงไม่เปลี่ยนสมดุลเคมี [
การประยุกต์ใช้ตัวเร่งปฏิกิริยาในอุตสาหกรรม
ไฮโดรจิเนชัน[แก้ไข | แก้ไขข้อความวิกิ]
ปฏิกิริยาเร่งปฏิกิริยาจำนวนมากเกี่ยวข้องกับการกระตุ้นอะตอมไฮโดรเจนและโมเลกุลอื่นๆ ซึ่งนำไปสู่ปฏิกิริยาทางเคมีของพวกมัน กระบวนการนี้เรียกว่าไฮโดรจิเนชันและรองรับหลายขั้นตอนของการกลั่นน้ำมันและการผลิตเชื้อเพลิงเหลวจากถ่านหิน (กระบวนการเบอร์จิอุส) การผลิตน้ำมันเบนซินสำหรับการบินและเชื้อเพลิงยานยนต์จากถ่านหินได้รับการพัฒนาในเยอรมนีในช่วงสงครามโลกครั้งที่สอง เนื่องจากประเทศนี้ไม่มีแหล่งน้ำมัน กระบวนการเบอร์จิอุสคือการเติมไฮโดรเจนลงในคาร์บอนโดยตรง ถ่านหินถูกทำให้ร้อนภายใต้แรงดันเมื่อมีไฮโดรเจนและได้ผลิตภัณฑ์ที่เป็นของเหลว ซึ่งจะถูกแปรรูปเป็นน้ำมันเบนซินสำหรับการบินและเชื้อเพลิงยานยนต์ ออกไซด์ของเหล็กถูกใช้เป็นตัวเร่งปฏิกิริยาเช่นเดียวกับตัวเร่งปฏิกิริยาจากดีบุกและโมลิบดีนัม ในระหว่างสงคราม ได้รับเชื้อเพลิงเหลวประมาณ 1,400 ตันต่อวันที่โรงงานในเยอรมนี 12 แห่งโดยใช้กระบวนการเบอร์จิอุส กระบวนการอื่น Fischer - Tropsch ประกอบด้วยสองขั้นตอน ประการแรกถ่านหินถูกทำให้เป็นแก๊สนั่นคือทำปฏิกิริยากับไอน้ำและออกซิเจนและได้รับส่วนผสมของไฮโดรเจนและคาร์บอนออกไซด์ ส่วนผสมนี้จะถูกแปลงเป็นเชื้อเพลิงเหลวโดยใช้ตัวเร่งปฏิกิริยาที่มีธาตุเหล็กหรือโคบอลต์ เมื่อสิ้นสุดสงคราม การผลิตเชื้อเพลิงสังเคราะห์จากถ่านหินในเยอรมนีก็หยุดลง เป็นผลมาจากการเพิ่มขึ้นของราคาน้ำมันภายหลังการคว่ำบาตรน้ำมันในปี 2516-2517 มีความพยายามอย่างมากในการพัฒนาวิธีการผลิตน้ำมันเบนซินจากถ่านหินที่ประหยัดได้ ดังนั้น การทำให้ถ่านหินเป็นของเหลวโดยตรงสามารถทำได้อย่างมีประสิทธิภาพมากขึ้นโดยใช้กระบวนการสองขั้นตอน โดยที่ถ่านหินจะถูกสัมผัสครั้งแรกกับตัวเร่งปฏิกิริยาอลูมินา-โคบอลต์-โมลิบดีนัมที่อุณหภูมิค่อนข้างต่ำและที่อุณหภูมิสูงขึ้น ค่าใช้จ่ายของน้ำมันเบนซินสังเคราะห์นั้นสูงกว่าน้ำมันที่ได้จากน้ำมัน
ตัวเร่งปฏิกิริยากรด[แก้ไข | แก้ไขข้อความวิกิ]
กิจกรรมการเร่งปฏิกิริยาของตัวเร่งปฏิกิริยาประเภทใหญ่เกิดจากคุณสมบัติที่เป็นกรด ตามคำกล่าวของ J. Bronsted และ T. Lowry กรดเป็นสารประกอบที่สามารถให้โปรตอนได้ กรดแก่สามารถบริจาคโปรตอนไปยังเบสได้อย่างง่ายดาย แนวคิดเรื่องความเป็นกรดได้รับการพัฒนาเพิ่มเติมในผลงานของ G. Lewis ผู้กำหนดกรดเป็นสารที่สามารถรับคู่อิเล็กตรอนจากสารผู้บริจาคด้วยการก่อตัวของพันธะโควาเลนต์เนื่องจากการขัดเกลาทางสังคมของอิเล็กตรอนคู่นี้ แนวคิดเหล่านี้ร่วมกับแนวคิดเกี่ยวกับปฏิกิริยาที่ก่อให้เกิดคาร์บีเนียมไอออน ช่วยให้เข้าใจกลไกของปฏิกิริยาเร่งปฏิกิริยาต่างๆ โดยเฉพาะอย่างยิ่งที่เกี่ยวข้องกับไฮโดรคาร์บอน
ตามอิทธิพลของอัตราการเกิดปฏิกิริยา ตัวเร่งปฏิกิริยาจะแบ่งออกเป็นค่าบวก (อัตราการเกิดปฏิกิริยาเพิ่มขึ้น) และค่าลบ (อัตราการเกิดปฏิกิริยาลดลง) ในกรณีหลัง กระบวนการยับยั้งเกิดขึ้น ซึ่งไม่ถือว่าเป็น "ตัวเร่งปฏิกิริยาเชิงลบ" เนื่องจากตัวยับยั้งถูกใช้ในระหว่างปฏิกิริยา
ตัวเร่งปฏิกิริยาเกิดขึ้น เป็นเนื้อเดียวกันและ ต่างกัน(ติดต่อ). ในการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน ตัวเร่งปฏิกิริยาจะอยู่ในเฟสเดียวกับตัวเร่งปฏิกิริยา ในขณะที่ตัวเร่งปฏิกิริยาต่างกันจะแตกต่างกันไปตามเฟส
ตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน[แก้ไข | แก้ไขข้อความวิกิ]
ตัวอย่างของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันคือการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ต่อหน้าไอโอดีนไอออน ปฏิกิริยาดำเนินไปในสองขั้นตอน:
H 2 O 2 + I → H 2 O + IO
H 2 O 2 + IO → H 2 O + O 2 + I
ในการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน การกระทำของตัวเร่งปฏิกิริยาเกิดจากการที่มันทำปฏิกิริยากับสารตั้งต้นเพื่อสร้างสารประกอบขั้นกลาง ซึ่งทำให้พลังงานกระตุ้นลดลง
ตัวเร่งปฏิกิริยาต่างกัน[แก้ไข | แก้ไขข้อความวิกิ]
ในการเร่งปฏิกิริยาที่ต่างกัน การเร่งความเร็วของกระบวนการมักจะเกิดขึ้นบนพื้นผิวของวัตถุที่เป็นของแข็ง - ตัวเร่งปฏิกิริยา ดังนั้นกิจกรรมของตัวเร่งปฏิกิริยาจึงขึ้นอยู่กับขนาดและคุณสมบัติของพื้นผิวของมัน ในทางปฏิบัติ ตัวเร่งปฏิกิริยามักจะได้รับการสนับสนุนด้วยการรองรับรูพรุนที่เป็นของแข็ง
กลไกของตัวเร่งปฏิกิริยาที่แตกต่างกันนั้นซับซ้อนกว่าตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน กลไกของตัวเร่งปฏิกิริยาต่างกันประกอบด้วยห้าขั้นตอน ซึ่งทั้งหมดสามารถย้อนกลับได้
1. การแพร่กระจายของสารตั้งต้นสู่พื้นผิวของของแข็ง
2. การดูดซับทางกายภาพบนตำแหน่งแอคทีฟของพื้นผิวของสารที่เป็นของแข็งของโมเลกุลที่ทำปฏิกิริยาแล้วตามด้วยเคมีดูดซับ
3. ปฏิกิริยาเคมีระหว่างโมเลกุลที่ทำปฏิกิริยา
4. การดูดซับผลิตภัณฑ์จากพื้นผิวตัวเร่งปฏิกิริยา
5. การแพร่กระจายของผลิตภัณฑ์จากพื้นผิวตัวเร่งปฏิกิริยาสู่กระแสทั่วไป
ตัวอย่างของตัวเร่งปฏิกิริยาต่างกันคือการเกิดออกซิเดชันของ SO 2 ถึง SO 3 บนตัวเร่งปฏิกิริยา V 2 O 5 ในการผลิตกรดซัลฟิวริก (วิธีสัมผัส)
ขั้นตอนของปฏิกิริยาบนพื้นผิวของตัวเร่งปฏิกิริยาสามารถแสดงให้เห็นในการทดลองที่แผ่นแพลตตินั่มถูกทำให้ร้อนในเปลวไฟของเตาแก๊สจากนั้นเปลวไฟจะดับลงและไอพ่นของก๊าซจากเตาจะถูกเป่าลงบนจาน ในขณะที่จานกลายเป็นสีแดงอีกครั้ง - มีเทนออกซิเดชันเกิดขึ้นบนพื้นผิวของโลหะ
การเร่งปฏิกิริยาเป็นวิธีหนึ่งที่ใช้กันทั่วไปในวิชาเคมีเพื่อเร่งปฏิกิริยาเคมี
ตัวเร่งปฏิกิริยาเรียกว่าการเปลี่ยนแปลงที่เลือกในอัตราของปฏิกิริยาเคมีต่อหน้าสาร (ตัวเร่งปฏิกิริยา) ซึ่งมีส่วนร่วมในกระบวนการระดับกลางจะถูกสร้างขึ้นใหม่ในระหว่างปฏิกิริยาและไม่ได้เป็นส่วนหนึ่งของผลิตภัณฑ์ขั้นสุดท้าย
ตัวเร่งปฏิกิริยาเชิงบวกหรือง่ายๆ ตัวเร่งปฏิกิริยา, -นี่เป็นอัตราการเกิดปฏิกิริยาที่เพิ่มขึ้นอย่างมาก ตัวอย่างเช่น การผลิตกรดซัลฟิวริกหรือการเกิดออกซิเดชันของแอมโมเนียต่อหน้าแพลตตินัม ตัวเร่งปฏิกิริยาเชิงลบหรือ การยับยั้ง, -นี่คือการชะลอตัวของปฏิกิริยาเช่นปฏิกิริยาของสารละลายโซเดียมซัลไฟต์กับออกซิเจนในบรรยากาศต่อหน้าเอทิลแอลกอฮอล์หรือการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ที่ความเข้มข้นต่ำของกรดซัลฟิวริก (สารยับยั้งตามลำดับเอทิลแอลกอฮอล์และกรดซัลฟิวริก) .
ปฏิกิริยาที่เกิดขึ้นภายใต้การกระทำของตัวเร่งปฏิกิริยาเรียกว่าตัวเร่งปฏิกิริยา
การกระทำของตัวเร่งปฏิกิริยาในกระบวนการเปลี่ยนระบบเคมีไม่เพียงเท่านั้น การเร่งความเร็ว,แต่ยัง นำทาง: หากระบบเคมีตั้งต้นสามารถพัฒนาไปในทิศทางที่เป็นไปได้ทางเทอร์โมไดนามิกได้หลายทิศทางภายใต้สภาวะที่กำหนด ตัวเร่งปฏิกิริยาจะเร่งหนึ่งในนั้นให้เร็วขึ้น
ตัวเร่งปฏิกิริยาเปลี่ยนกลไกการเกิดปฏิกิริยา ตัวเร่งปฏิกิริยาและหนึ่งในวัสดุเริ่มต้นรูปแบบ คอมเพล็กซ์ที่เปิดใช้งาน- สารประกอบขั้นกลางที่ทำปฏิกิริยากับสารตั้งต้นอื่นเพื่อสร้างผลิตภัณฑ์จากปฏิกิริยาและสร้างโมเลกุลตัวเร่งปฏิกิริยาขึ้นใหม่
ให้ปฏิกิริยา A + B = AB มีพลังงานกระตุ้นสูงมาก อี อาจึงดำเนินไปอย่างช้าๆ แผนภาพพลังงานของมันแสดงในรูปที่ 4.4, ก.
ข้าว. 4.4.การเปลี่ยนแปลงของเอนทัลปีระหว่างปฏิกิริยา: a - ไม่มีตัวเร่งปฏิกิริยา: ข- มีตัวเร่งปฏิกิริยา
หากปฏิกิริยานี้เกิดขึ้นในที่ที่มีตัวเร่งปฏิกิริยา K (รูปที่ 4.4, b) มันก็จะเข้าสู่ปฏิกิริยาทางเคมีกับสารตั้งต้นตัวใดตัวหนึ่ง (เช่น A) ซึ่งเป็นผลมาจากแบตเตอรี่ที่เปิดใช้งาน คอมเพล็กซ์ * สารประกอบเคมี AK ที่ไม่เสถียรเกิดขึ้นตามปฏิกิริยา A + K = AK พลังงานกระตุ้นของกระบวนการนี้ อี"น้อยกว่านั้นในกรณีที่ไม่มีตัวเร่งปฏิกิริยา (ดังนั้น ปฏิกิริยาจึงดำเนินไปอย่างรวดเร็ว นอกจากนี้ AA ระดับกลางผ่านคอมเพล็กซ์ที่เปิดใช้งานอื่น AVK * โต้ตอบกับวัสดุเริ่มต้นที่สอง B: AK + B \u003d AB + K ในกรณีนี้ ตัวเร่งปฏิกิริยาจะกลับสู่ สภาพเดิม พลังงานกระตุ้นของกระบวนการนี้ยังน้อย (E "ซึ่งทำให้มันดำเนินการด้วยความเร็วสูงเมื่อสรุปทั้งสองกระบวนการที่เกิดขึ้นอย่างต่อเนื่องจะได้สมการสุดท้ายสำหรับปฏิกิริยาเร็ว: A + B (+ K) \u003d AB (+ K) ตัวเร่งปฏิกิริยาถูกระบุ ในสมการนี้เพียงเพื่อเน้นถึงความเป็นจริงของการงอกใหม่
โดยทั่วไปสำหรับตัวเร่งปฏิกิริยาทั้งหมดคือพวกมันเปลี่ยนพลังงานกระตุ้นเสมอ โดยลดลงด้วยตัวเร่งปฏิกิริยาเชิงบวก กล่าวคือ ลดความสูงของอุปสรรคพลังงาน เมื่อมีตัวเร่งปฏิกิริยา คอมเพล็กซ์ที่ถูกกระตุ้นจะก่อตัวขึ้นโดยมีระดับพลังงานต่ำกว่าที่ไม่มีมัน ส่งผลให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้นอย่างมีนัยสำคัญ
ตามคุณลักษณะของเฟส ตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน (เป็นเนื้อเดียวกัน) และต่างกัน (ไม่สม่ำเสมอ) มีความโดดเด่น การเร่งปฏิกิริยาด้วยเอนไซม์จะพิจารณาแยกกัน
ที่ ตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันตัวเร่งปฏิกิริยาและสารตั้งต้นก่อตัวเป็นเฟสเดียว (ก๊าซหรือสารละลาย) ซึ่งไม่มีส่วนต่อประสาน (ขอบเขตเฟส) กระบวนการเร่งปฏิกิริยาในก๊าซและของเหลวมีจำนวนมาก ตัวอย่างของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันในเฟสของแก๊สคือตัวเร่งปฏิกิริยาออกซิเดชันของซัลเฟอร์ออกไซด์ (IV) ในวิธีแชมเบอร์เพื่อผลิตกรดซัลฟิวริก การเกิดออกซิเดชันของซัลเฟอร์ไดออกไซด์เป็นไตรออกไซด์ตามปฏิกิริยา:
ไหลช้าๆ การแนะนำตัวเร่งปฏิกิริยา NO เปลี่ยนกลไกการเกิดปฏิกิริยา: 
และลดพลังงานกระตุ้น ดังนั้นจึงเพิ่มอัตราการเกิดปฏิกิริยา
ในการเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน อัตราการเกิดปฏิกิริยาเคมีเป็นสัดส่วนกับความเข้มข้นของตัวเร่งปฏิกิริยา ข้อเสียของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันในสารละลายคือช่วงอุณหภูมิที่จำกัด และในบางกรณี ความยากลำบากในการแยกตัวเร่งปฏิกิริยาออกจากผลิตภัณฑ์ปฏิกิริยา
ที่ ตัวเร่งปฏิกิริยาต่างกันตัวเร่งปฏิกิริยา (โดยปกติคือของแข็ง) อยู่ในระบบเป็นเฟสอิสระ กล่าวคือ มีส่วนต่อประสานระหว่างตัวเร่งปฏิกิริยากับสารตั้งต้น (ก๊าซหรือของเหลว) ดังนั้นการเกิดออกซิเดชันของแอมโมเนีย (เฟสก๊าซ) จะดำเนินการต่อหน้าแพลตตินัม (เฟสของแข็ง) และการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ (เฟสของเหลว) จะถูกเร่งโดยถ่านหินหรือแมงกานีส (IV) ออกไซด์ซึ่งมีอยู่ในรูปของ เฟสของแข็ง:
ในการเร่งปฏิกิริยาที่ต่างกัน ปฏิกิริยาทั้งหมดดำเนินที่ขอบเขตเฟส กล่าวคือ บนพื้นผิวของตัวเร่งปฏิกิริยาซึ่งกิจกรรมขึ้นอยู่กับคุณสมบัติของพื้นผิว - ขนาดของพื้นที่องค์ประกอบทางเคมีความบกพร่องของโครงสร้างและสถานะ คุณสมบัติของจลนศาสตร์ของกระบวนการถูกกำหนดโดยการแพร่กระจายและการดูดซับ
พื้นผิวของตัวเร่งปฏิกิริยา (ตัวดูดซับ) เป็นเนื้อเดียวกันและมีสิ่งที่เรียกว่า ศูนย์ปฏิบัติการซึ่งปฏิกิริยาเร่งปฏิกิริยาส่วนใหญ่เกิดขึ้นเนื่องจากการดูดซับของสารตั้งต้น (ตัวดูดซับ) บนศูนย์กลางเหล่านี้และการเพิ่มขึ้นของความเข้มข้นบนพื้นผิวของตัวเร่งปฏิกิริยา ส่วนนี้เร่งปฏิกิริยาให้เร็วขึ้น อย่างไรก็ตาม สาเหตุหลักของการเพิ่มขึ้นของอัตราการเกิดปฏิกิริยาคือการเพิ่มขึ้นอย่างมีนัยสำคัญในกิจกรรมทางเคมีของโมเลกุลที่ดูดซับ ซึ่งพันธะระหว่างอะตอมจะลดลงภายใต้การกระทำของตัวเร่งปฏิกิริยา ซึ่งทำให้โมเลกุลเหล่านี้มีปฏิกิริยาตอบสนองมากขึ้น ความเร่งของปฏิกิริยาในกรณีนี้ยังเกิดขึ้นจากการลดลงของพลังงานกระตุ้น ซึ่งการก่อตัวของตัวกลางที่พื้นผิวก็มีส่วนสนับสนุนเช่นกัน
สารที่เป็นพิษต่อตัวเร่งปฏิกิริยาที่เป็นของแข็ง ได้แก่ การลดหรือทำลายกิจกรรมอย่างสมบูรณ์เรียกว่า สารพิษที่เป็นตัวเร่งปฏิกิริยาตัวอย่างเช่น สารประกอบของสารหนู ปรอท ตะกั่ว ไซยาไนด์ตัวเร่งปฏิกิริยาแพลตตินั่มที่เป็นพิษ ซึ่งจะต้องสร้างใหม่ภายใต้เงื่อนไขการผลิตในกรณีนี้
สารที่เสริมการทำงานของตัวเร่งปฏิกิริยาสำหรับปฏิกิริยาที่กำหนด แต่ไม่ใช่ตัวเร่งปฏิกิริยาเรียกว่า โปรโมเตอร์เป็นที่ทราบกันดีอยู่แล้ว เช่น การส่งเสริมตัวเร่งปฏิกิริยาแพลตตินั่มด้วยการเติมธาตุเหล็ก อะลูมิเนียม ฯลฯ
หัวกะทิ (หัวกะทิ) ของการกระทำการใช้ตัวเร่งปฏิกิริยาแสดงออกโดยเฉพาะอย่างยิ่งในความจริงที่ว่าด้วยความช่วยเหลือของตัวเร่งปฏิกิริยาที่แตกต่างกันจึงเป็นไปได้ที่จะได้รับผลิตภัณฑ์ที่แตกต่างกันจากสารเดียวกัน ดังนั้นในที่ที่มีตัวเร่งปฏิกิริยา Al 2 O e ที่ 300 ° C น้ำและเอทิลีนจะได้มาจากเอทิลแอลกอฮอล์:

แต่ถ้าใช้ผงทองแดงเป็นตัวเร่งปฏิกิริยาที่อุณหภูมิเท่ากันเอทิลแอลกอฮอล์จะสลายตัวเป็นไฮโดรเจนและอะซีตัลดีไฮด์:
ดังนั้น สำหรับแต่ละปฏิกิริยาจะมีตัวเร่งปฏิกิริยา
ด้วยการมีส่วนร่วมของตัวเร่งปฏิกิริยาทางชีวภาพ เอนไซม์กระบวนการทางเคมีที่ซับซ้อนเกิดขึ้นในสิ่งมีชีวิตของพืชและสัตว์ ตัวอย่างเช่น น้ำลายมีเอ็นไซม์ ptyalin ซึ่งกระตุ้นการเปลี่ยนแป้งเป็นน้ำตาล และเปปซินซึ่งมีอยู่ในน้ำย่อยช่วยส่งเสริมการสลายตัวของโปรตีน ร่างกายมนุษย์มีเอ็นไซม์ประมาณ 3,000 ชนิด ซึ่งแต่ละเอ็นไซม์เป็นตัวเร่งปฏิกิริยาที่มีประสิทธิผลสำหรับปฏิกิริยาที่สอดคล้องกัน
ตัวเร่งปฏิกิริยาหลายชนิดโดยเฉพาะเอ็นไซม์มี บุคคลล้วนๆตัวเร่งปฏิกิริยาซึ่งเป็นเหตุที่เรียกว่า เฉพาะรายบุคคล