Aplicarea curentului în lichide. Curentul electric în lichide: originea sa, caracteristicile cantitative și calitative. curent electric în soluție. electroliti
Toată lumea este familiarizată cu definiția curentului electric. Este reprezentată ca o mișcare direcționată a particulelor încărcate. O astfel de mișcare în medii diferite are diferențe fundamentale. Ca exemplu de bază al acestui fenomen, ne putem imagina fluxul și propagarea curentului electric în lichide. Astfel de fenomene sunt caracterizate de proprietăți diferite și sunt foarte diferite de mișcarea ordonată a particulelor încărcate, care are loc în condiții normale, nu sub influența diferitelor lichide.
Figura 1. Curentul electric în lichide. Autor24 - schimb online de lucrări ale studenților
Formarea curentului electric în lichide
În ciuda faptului că procesul de conducere a curentului electric se realizează cu ajutorul dispozitivelor metalice (conductoare), curentul din lichide depinde de mișcarea ionilor încărcați care au dobândit sau au pierdut astfel de atomi și molecule dintr-un anumit motiv. Un indicator al unei astfel de mișcări este o modificare a proprietăților unei anumite substanțe, unde trec ionii. Astfel, este necesar să ne bazăm pe definiția de bază a curentului electric pentru a forma un concept specific de formare a curentului în diferite lichide. Se determină că descompunerea ionilor încărcați negativ contribuie la deplasarea în regiunea sursei de curent cu valori pozitive. Ionii încărcați pozitiv în astfel de procese se vor deplasa în direcția opusă - la o sursă de curent negativă.
Conductoarele lichide sunt împărțite în trei tipuri principale:
- semiconductori;
- dielectrice;
- conductoare.
Definiția 1
Disocierea electrolitică este procesul de descompunere a moleculelor unei anumite soluții în ioni încărcați negativi și pozitivi.
Se poate stabili că un curent electric în lichide poate apărea după o modificare a compoziției și proprietăților chimice ale lichidelor utilizate. Acest lucru contrazice complet teoria propagării curentului electric în alte moduri atunci când se utilizează un conductor metalic convențional.
Experimentele lui Faraday și electroliza
Fluxul curentului electric în lichide este un produs al mișcării ionilor încărcați. Problemele asociate cu apariția și propagarea curentului electric în lichide au condus la studiul celebrului om de știință Michael Faraday. Cu ajutorul a numeroase studii practice, el a reușit să găsească dovezi că masa unei substanțe eliberate în timpul electrolizei depinde de cantitatea de timp și de electricitate. În acest caz, timpul în care au fost efectuate experimentele este important.
Omul de știință a putut afla, de asemenea, că în procesul de electroliză, atunci când o anumită cantitate de substanță este eliberată, este nevoie de aceeași cantitate de sarcini electrice. Această cantitate a fost stabilită cu precizie și fixată într-o valoare constantă, care a fost numită numărul Faraday.
În lichide, curentul electric are diferite condiții de propagare. Interacționează cu moleculele de apă. Ele împiedică în mod semnificativ toată mișcarea ionilor, ceea ce nu a fost observat în experimentele folosind un conductor metalic convențional. De aici rezultă că generarea de curent în timpul reacțiilor electrolitice nu va fi atât de mare. Cu toate acestea, pe măsură ce temperatura soluției crește, conductivitatea crește treptat. Aceasta înseamnă că tensiunea curentului electric crește. De asemenea, în procesul de electroliză, s-a observat că probabilitatea ca o anumită moleculă să se descompună în sarcini ionice negative sau pozitive crește din cauza numărului mare de molecule ale substanței sau solventului utilizat. Când soluția este saturată cu ioni peste o anumită normă, are loc procesul invers. Conductivitatea soluției începe să scadă din nou.
În prezent, procesul de electroliză și-a găsit aplicarea în multe domenii și domenii ale științei și în producție. Întreprinderile industriale îl folosesc în producția sau prelucrarea metalului. Reacțiile electrochimice sunt implicate în:
- electroliza sării;
- galvanizare;
- lustruirea suprafetelor;
- alte procese redox.
Curentul electric în vid și lichide
Propagarea curentului electric în lichide și alte medii este un proces destul de complex, care are propriile caracteristici, caracteristici și proprietăți. Faptul este că în astfel de medii nu există complet încărcături în corpuri, de aceea sunt denumite de obicei dielectrici. Scopul principal al cercetării a fost de a crea condiții în care atomii și moleculele să poată începe să se miște și a început procesul de generare a curentului electric. Pentru aceasta, se obișnuiește să se utilizeze mecanisme sau dispozitive speciale. Elementul principal al unor astfel de dispozitive modulare sunt conductorii sub formă de plăci metalice.
Pentru a determina principalii parametri ai curentului, este necesar să se utilizeze teorii și formule cunoscute. Cea mai comună este legea lui Ohm. Acționează ca o caracteristică universală a amperului, unde este implementat principiul dependenței curent-tensiune. Amintiți-vă că tensiunea se măsoară în unități de amperi.
Pentru experimente cu apă și sare, este necesar să pregătiți un vas cu apă sărată. Acest lucru va oferi o idee practică și vizuală a proceselor care au loc atunci când un curent electric este generat în lichide. De asemenea, instalația trebuie să conțină electrozi dreptunghiulari și surse de alimentare. Pentru pregătirea la scară largă pentru experimente, trebuie să aveți o instalație de amperi. Acesta va ajuta la conducerea energiei de la sursa de alimentare la electrozi.
Plăcile metalice vor acționa ca conductoare. Ele sunt scufundate în lichidul folosit și apoi tensiunea este conectată. Mișcarea particulelor începe imediat. Se rulează la întâmplare. Când apare un câmp magnetic între conductori, întregul proces de mișcare a particulelor este ordonat.
Ionii încep să schimbe încărcăturile și să se combine. Astfel catozii devin anozi, iar anozii devin catozi. În acest proces, există și câțiva alți factori importanți de luat în considerare:
- nivelul de disociere;
- temperatura;
- rezistență electrică;
- utilizarea curentului alternativ sau continuu.
La sfârșitul experimentului, pe farfurii se formează un strat de sare.
Lichidele care sunt conductoare includ topituri și soluții de electroliți, de exemplu. săruri, acizi și alcalii.
Când electroliții se dizolvă în apă, moleculele lor se descompun în ioni - disociere electrolitică. Gradul de disociere, i.e. fracția de molecule dintr-un dizolvat care s-au descompus în ioni depinde de temperatură, concentrația soluției și proprietățile electrice ale solventului. Odată cu creșterea temperaturii, gradul de disociere crește și, în consecință, crește concentrația ionilor încărcați pozitiv și negativ. Ionii de diferite semne, atunci când se întâlnesc, se pot uni din nou în molecule neutre. Acest proces se numește recombinare. În condiții constante, în soluție se stabilește un echilibru dinamic, la care numărul de molecule care se descompun în ioni pe secundă este egal cu numărul de perechi de ioni care se recombină în molecule neutre în același timp.
Astfel, purtătorii de sarcină liberi din lichidele conductoare sunt ionii pozitivi și negativi. Dacă electrozii conectați la o sursă de curent sunt plasați într-un lichid, atunci acești ioni vor începe să se miște. Unul dintre electrozi este conectat la polul negativ al sursei de curent - se numește catod - celălalt este conectat la pozitiv - anodul. Atunci când sunt conectați la o sursă de curent, ionii într-o soluție de electrolit, ionii negativi încep să se deplaseze către electrodul pozitiv (anod), iar ionii pozitivi, respectiv, spre negativ (catod). Adică se stabilește un curent electric. O astfel de conductivitate în lichide se numește ionică, deoarece ionii sunt purtători de sarcină.
Când curentul trece prin soluția de electrolit de pe electrozi, se eliberează o substanță asociată cu reacții redox. La anod, ionii încărcați negativ își donează electronii suplimentari (reacție oxidativă), iar la catod, ionii pozitivi acceptă electronii lipsă (reacție de reducere). Acest proces se numește electroliză.
În timpul electrolizei, o substanță este eliberată la electrozi. Dependența masei substanței eliberate m de puterea curentului, timpul de trecere a curentului și substanța în sine a fost stabilită de M. Faraday. Această lege poate fi obținută teoretic. Deci, masa substanței eliberate este egală cu produsul dintre masa unui ion m i cu numărul de ioni N i care au ajuns la electrod în timpul Dt. Masa unui ion, conform formulei pentru cantitatea unei substanțe, este egală cu m i \u003d M / N a, unde M este masa molară a substanței, N a este constanta lui Avogadro. Numărul de ioni care au ajuns la electrod este N i =Dq/qi, unde Dq este sarcina care a trecut prin electrolit în timpul Dt (Dq=I*Dt), qi este sarcina ionului, care este determinată prin valența atomului (qi = n*e, unde n este valența atomului, e este sarcina elementară). Înlocuind aceste formule, obținem că m=M/(neN a)*IDt. Dacă notăm cu k (factor de proporționalitate) =M/(neN a), atunci avem m=kIDt. Aceasta este o notație matematică a primei legi a lui Faraday, una dintre legile electrolizei. Masa substanței eliberată pe electrod în timpul Dt în timpul trecerii unui curent electric este proporțională cu puterea curentului și cu acest interval de timp. Valoarea lui k se numește echivalentul electrochimic al unei substanțe date, care este numeric egal cu masa substanței eliberate pe electrozi în timpul transferului unei sarcini de 1 C de către ioni. [k]= 1 kg/C. k = M/(neN a) = 1/F*M/n , unde F este constanta lui Faraday. F \u003d eN a \u003d 9,65 * 10 4 C / mol. Formula derivată k=(1/F)*(M/n) este a doua lege a lui Faraday.
Electroliza este utilizată pe scară largă în inginerie în diverse scopuri, de exemplu, suprafața unui metal este acoperită cu un strat subțire al altuia (nichelare, cromare, placare cu cupru etc.). Dacă se asigură o bună exfoliere a stratului electrolitic de pe suprafață, se poate obține o copie a topografiei suprafeței. Acest proces se numește galvanizare. De asemenea, cu ajutorul electrolizei, metalele sunt purificate de impurități, de exemplu, foi groase de cupru nerafinat obținute din minereu sunt plasate într-o baie ca anod. În timpul electrolizei, cuprul se dizolvă, impuritățile cad pe fund și cuprul pur se depune pe catod. Cu ajutorul electrolizei se obțin și plăci de circuite electronice. Un model subțire și complex de fire de conectare este lipit pe dielectric, apoi placa este plasată într-un electrolit, unde zonele nevopsite ale stratului de cupru sunt gravate. După aceea, vopseaua este spălată și detaliile microcircuitului apar pe placă.
Lichidele, ca și solidele, pot fi conductori, semiconductori și dielectrici. În această lecție, ne vom concentra asupra conductoarelor lichide. Și nu despre lichide cu conductivitate electronică (metale topite), ci despre conductoare lichide de al doilea fel (soluții și topituri de săruri, acizi, baze). Tipul de conductivitate a unor astfel de conductori este ionic.
Definiție. Conductorii de al doilea fel sunt acei conductori în care procesele chimice au loc atunci când curge curent.
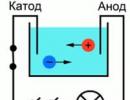
Pentru o mai bună înțelegere a procesului de conducere a curentului în lichide se poate prezenta următorul experiment: Doi electrozi conectați la o sursă de curent au fost plasați într-o baie de apă, un bec poate fi luat ca indicator de curent în circuit. Dacă închideți un astfel de circuit, lampa nu se va arde, ceea ce înseamnă că nu există curent, ceea ce înseamnă că există o întrerupere în circuit, iar apa în sine nu conduce curentul. Dar dacă pui o anumită cantitate de sare în baie și repeți circuitul, lumina se va aprinde. Aceasta înseamnă că purtătorii de încărcare liberă, în acest caz ionii, au început să se deplaseze în baie între catod și anod (Fig. 1).

Orez. 1. Schema experienței
Conductibilitatea electroliților
De unde vin taxele gratuite în al doilea caz? După cum sa menționat într-una dintre lecțiile anterioare, unele dielectrice sunt polare. Apa are exact aceleași molecule polare (Fig. 2).

Orez. 2. Polaritatea moleculei de apă
Când se adaugă sare în apă, moleculele de apă sunt orientate în așa fel încât polii lor negativi să fie aproape de sodiu, pozitivi - aproape de clor. Ca rezultat al interacțiunilor dintre sarcini, moleculele de apă descompun moleculele de sare în perechi de ioni opuși. Ionul de sodiu are sarcină pozitivă, ionul de clor are sarcină negativă (Fig. 3). Acești ioni se vor deplasa între electrozi sub acțiunea unui câmp electric.

Orez. 3. Schema de formare a ionilor liberi
Când ionii de sodiu se apropie de catod, acesta primește electronii lipsă, în timp ce ionii de clorură îi renunță pe ai lor când ajung la anod.
Electroliză
Deoarece fluxul de curent în lichide este asociat cu transferul de materie, cu un astfel de curent are loc procesul de electroliză.
Definiție. Electroliza este un proces asociat cu reacții redox în care o substanță este eliberată la electrozi.
Substanțele care, ca urmare a unei astfel de scindari, asigură conductivitate ionică se numesc electroliți. Acest nume a fost propus de fizicianul englez Michael Faraday (Fig. 4).
Electroliza face posibilă obținerea de substanțe într-o formă suficient de pură din soluții, de aceea este folosită pentru a obține materiale rare, precum sodiu, calciu... în forma sa pură. Aceasta este ceea ce se numește metalurgie electrolitică.
legile lui Faraday
În prima lucrare despre electroliză din 1833, Faraday și-a prezentat cele două legi ale electrolizei. În primul, a fost vorba despre masa substanței eliberate pe electrozi:
Prima lege a lui Faraday spune că această masă este proporțională cu sarcina trecută prin electrolit:
Aici rolul coeficientului de proporționalitate îl joacă cantitatea - echivalentul electrochimic. Aceasta este o valoare tabelară care este unică pentru fiecare electrolit și este caracteristica sa principală. Dimensiunea echivalentului electrochimic:
![]()
Semnificația fizică a echivalentului electrochimic este masa eliberată pe electrod atunci când cantitatea de electricitate din 1 C trece prin electrolit.
Dacă vă amintiți formulele din tema curentului continuu:
Atunci putem reprezenta prima lege a lui Faraday sub forma:
A doua lege a lui Faraday se referă în mod direct la măsurarea echivalentului electrochimic prin alte constante pentru un anumit electrolit:
Aici: este masa molară a electrolitului; - sarcina elementara; - valența electrolitului; este numărul lui Avogadro.
Valoarea se numește echivalentul chimic al electrolitului. Adică, pentru a cunoaște echivalentul electrochimic, este suficient să cunoaștem echivalentul chimic, componentele rămase ale formulei sunt constante mondiale.
Pe baza celei de-a doua legi a lui Faraday, prima lege poate fi reprezentată astfel:
![]()
Faraday a propus terminologia acestor ioni pe baza electrodului la care se deplasează. Ionii pozitivi se numesc cationi deoarece se deplasează spre catodul încărcat negativ, sarcinile negative se numesc anioni pe măsură ce se deplasează spre anod.
Acțiunea de mai sus a apei de a rupe o moleculă în doi ioni se numește disociere electrolitică.
Pe lângă soluții, topiturile pot fi și conductori de al doilea fel. În acest caz, prezența ionilor liberi se realizează prin faptul că mișcările și vibrațiile moleculare foarte active încep la o temperatură ridicată, în urma căreia moleculele se descompun în ioni.
Aplicarea practică a electrolizei
Prima aplicare practică a electrolizei a avut loc în 1838 de către omul de știință rus Jacobi. Cu ajutorul electrolizei, a primit o impresie de figuri pentru Catedrala Sf. Isaac. Această aplicare a electrolizei se numește galvanizare. Un alt domeniu de aplicare este galvanizarea - acoperirea unui metal cu altul (cromare, nichelare, aurire etc., Fig. 5)
- Fatyf.narod.ru ().
- ChemiK ().
- Ens.tpu.ru ().
Teme pentru acasă
- Ce sunt electroliții?
- Care sunt cele două tipuri fundamental diferite de lichide în care poate circula un curent electric?
- Care sunt posibilele mecanisme de formare a purtătorilor de taxe gratuite?
- *De ce masa eliberată pe electrod este proporțională cu sarcina?
« Fizica - clasa a 10-a "
Care sunt purtătorii de curent electric în vid?
Care este natura mișcării lor?
Lichidele, ca și solidele, pot fi dielectrice, conductori și semiconductori. Dielectricii includ apa distilată, conductorii - soluții și topituri de electroliți: acizi, alcalii și săruri. Semiconductori lichizi sunt seleniu topit, topituri de sulfuri etc.
disociere electrolitică.
Când electroliții sunt dizolvați sub influența câmpului electric al moleculelor polare de apă, moleculele de electroliți se descompun în ioni.
Dezintegrarea moleculelor în ioni sub influența câmpului electric al moleculelor de apă polară se numește disocierea electrolitică.
Gradul de disociere- proporția de molecule din substanța dizolvată care s-au degradat în ioni.
Gradul de disociere depinde de temperatură, concentrația soluției și proprietățile electrice ale solventului.
Odată cu creșterea temperaturii, gradul de disociere crește și, în consecință, crește concentrația ionilor încărcați pozitiv și negativ.
Ionii de diferite semne, atunci când se întâlnesc, se pot uni din nou în molecule neutre.
În condiții constante, în soluție se stabilește un echilibru dinamic, la care numărul de molecule care se descompun în ioni pe secundă este egal cu numărul de perechi de ioni care se recombină în molecule neutre în același timp.
Conducție ionică.
Purtătorii de sarcină în soluții apoase sau topituri de electroliți sunt ioni încărcați pozitiv și negativ.
Dacă un vas cu o soluție de electrolit este inclus într-un circuit electric, atunci ionii negativi vor începe să se miște spre electrodul pozitiv - anod și pozitiv - spre catodul negativ. Ca rezultat, un curent electric va curge prin circuit.
Conductivitatea soluțiilor apoase sau a topiturii electroliților, care este realizată de ioni, se numește conductivitate ionică.
Electroliză. Cu conductivitatea ionică, trecerea curentului este asociată cu transferul de materie. Pe electrozi sunt eliberate substanțe care alcătuiesc electroliții. La anod, ionii negativi donează electronii lor suplimentari (în chimie, aceasta se numește reacție oxidativă), iar la catod, ionii pozitivi primesc electronii lipsă (reacție de reducere).
Lichidele pot avea și conductivitate electronică. O astfel de conductivitate este deținută, de exemplu, de metalele lichide.
Procesul de eliberare a unei substanțe la electrod, asociat cu reacții redox, se numește electroliză.
Ce determină masa unei substanțe eliberată într-un timp dat? În mod evident, masa m a substanței eliberate este egală cu produsul dintre masa m 0i a unui ion cu numărul N i de ioni care au ajuns la electrod în timpul Δt:
m = m 0i N i . (16,3)
Masa ionilor m 0i este:
unde M este masa molară (sau atomică) a substanței și NA este constanta Avogadro, adică numărul de ioni dintr-un mol.
Numărul de ioni care ajung la electrod este
unde Δq = IΔt este sarcina trecută prin electrolit în timpul Δt; q 0i este sarcina ionului, care este determinată de valența n a atomului: q 0i \u003d ne (e este sarcina elementară). În timpul disocierii moleculelor, de exemplu KBr, constând din atomi monovalenți (n = 1), apar ioni K + și Br -. Disociarea moleculelor de sulfat de cupru duce la apariția ionilor de Cu 2+ și SO 2-4 încărcați dublu (n = 2). Înlocuind expresiile (16.4) și (16.5) în formula (16.3) și ținând cont că Δq = IΔt, a q 0i = ne, obținem
legea lui Faraday.
Să notăm cu k coeficientul de proporționalitate dintre masa m a substanței și sarcina Δq = IΔt care trece prin electrolit:
unde F \u003d eN A \u003d 9,65 10 4 C / mol - constanta Faraday.
Coeficientul k depinde de natura substanței (valorile lui M și n). Conform formulei (16.6) avem
m = kIΔt. (16,8)
Legea electrolizei lui Faraday:
Masa substanței eliberată pe electrod în timpul Δt. în timpul trecerii curentului electric, este proporțională cu puterea curentului și cu timpul.
Această afirmație, obținută teoretic, a fost stabilită pentru prima dată experimental de Faraday.
Se numește valoarea k din formula (16.8). echivalent electrochimic substanță dată și exprimată în kilograme per pandantiv(kg/C).
Din formula (16.8) se poate observa că coeficientul k este numeric egal cu masa substanței eliberate pe electrozi în timpul transferului unei sarcini de 1 C de către ioni.

Echivalentul electrochimic are o semnificație fizică simplă. Deoarece M / N A \u003d m 0i și en \u003d q 0i, atunci conform formulei (16.7) k \u003d rn 0i / q 0i, adică k este raportul dintre masa ionului și sarcina sa.
Măsurând valorile lui m și Δq, se pot determina echivalenții electrochimici ai diferitelor substanțe.
Puteți verifica validitatea legii lui Faraday prin experiență. Să asamblam instalația prezentată în Figura (16.25). Toate cele trei băi electrolitice sunt umplute cu aceeași soluție de electrolit, dar curenții care trec prin ele sunt diferiți. Să notăm puterea curenților prin I1, I2, I3. Atunci I 1 = I 2 + I 3 . Măsurând masele m 1 , m 2 , m 3 ale substanţelor eliberate pe electrozi în diferite băi se poate asigura că acestea sunt proporţionale cu curenţii corespunzători I 1 , I 2 , I 3 .
Determinarea sarcinii electronilor.
Formula (16.6) pentru masa substanței eliberate pe electrod poate fi utilizată pentru a determina sarcina electronului. Din această formulă rezultă că modulul de încărcare a electronilor este egal cu:
Cunoscând masa m a substanței eliberate în timpul trecerii sarcinii IΔt, masa molară M, valența a n atomi și constanta Avogadro N A, se poate afla valoarea modulului de sarcină a electronilor. Se dovedește a fi egal cu e = 1,6 10 -19 C.
În acest fel, valoarea sarcinii electrice elementare a fost obținută pentru prima dată în 1874.
Aplicarea electrolizei. Electroliza este utilizată pe scară largă în inginerie în diverse scopuri. Acoperiți electrolitic suprafața unui metal cu un strat subțire al altuia ( placare cu nichel, placare cu crom, placare cu aur etc.). Acest strat durabil protejează suprafața împotriva coroziunii. Dacă se asigură o bună exfoliere a stratului electrolitic de pe suprafața pe care este depus metalul (acest lucru se realizează, de exemplu, prin aplicarea de grafit pe suprafață), atunci se poate obține o copie de pe suprafața în relief.
Procesul de obținere a acoperirilor decojite - electrotip- a fost dezvoltat de omul de știință rus B. S. Jacobi (1801-1874), care în 1836 a aplicat această metodă pentru a realiza figuri goale pentru Catedrala Sf. Isaac din Sankt Petersburg.
Anterior, în industria tipografică, din matrice se obțineau copii de pe o suprafață în relief (stereotipuri) (o amprentă a unui set pe un material plastic), pentru care pe matrice se depunea un strat gros de fier sau altă substanță. Acest lucru a făcut posibilă reproducerea setului în numărul necesar de copii.
Electroliza elimină impuritățile din metale. Astfel, cuprul brut obținut din minereu este turnat sub formă de foi groase, care sunt apoi puse într-o baie ca anozi. În timpul electrolizei, cuprul anodului se dizolvă, impuritățile care conțin metale valoroase și rare cad la fund, iar cuprul pur se depune pe catod.
Aluminiul se obține din bauxita topită prin electroliză. Această metodă de obținere a aluminiului a fost cea care l-a făcut ieftin și, alături de fier, cea mai comună în tehnologie și viața de zi cu zi.
Cu ajutorul electrolizei se obțin plăci de circuite electronice, care servesc drept bază pentru toate produsele electronice. Pe dielectric este lipită o placă subțire de cupru, pe care se aplică un model complex de fire de legătură cu o vopsea specială. Apoi placa este plasată într-un electrolit, unde sunt gravate zonele stratului de cupru care nu sunt acoperite cu vopsea. După aceea, vopseaua este spălată, iar detaliile microcircuitului apar pe placă.
Curentul electric din lichide este cauzat de mișcarea ionilor pozitivi și negativi. Spre deosebire de curentul din conductorii unde electronii se mișcă. Astfel, dacă nu există ioni într-un lichid, atunci acesta este un dielectric, de exemplu, apă distilată. Deoarece purtătorii de sarcină sunt ioni, adică molecule și atomi ai unei substanțe, atunci când un curent electric trece printr-un astfel de lichid, va duce inevitabil la o modificare a proprietăților chimice ale substanței.
De unde provin ionii pozitivi și negativi într-un lichid? Să spunem imediat că purtătorii de sarcină nu sunt capabili să se formeze în toate lichidele. Cei în care apar se numesc electroliți. Acestea includ soluții de săruri ale acizilor și alcalinelor. Când dizolvați sarea în apă, de exemplu, luați sare de masă NaCl, se descompune sub acțiunea unui solvent, adică a apei într-un ion pozitiv N / A numit cation și ion negativ Cl numit anion. Procesul de formare a ionilor se numește disociere electrolitică.
Să facem un experiment, pentru el avem nevoie de un bec de sticlă, doi electrozi metalici, un ampermetru și o sursă de curent continuu. Umplem balonul cu o soluție de sare comună în apă. Apoi punem doi electrozi dreptunghiulari în această soluție. Conectăm electrozii la o sursă de curent continuu printr-un ampermetru.
Figura 1 - Balon cu soluție de sare
Când curentul este pornit între plăci, va apărea un câmp electric sub acțiunea căruia ionii de sare vor începe să se miște. Ionii pozitivi se vor precipita către catod, iar ionii negativi către anod. În același timp, vor face o mișcare haotică. Dar, în același timp, sub acțiunea terenului i se va adăuga și una ordonată.
Spre deosebire de conductorii în care numai electronii se mișcă, adică un tip de sarcină, două tipuri de sarcini se mișcă în electroliți. Aceștia sunt ioni pozitivi și negativi. Se deplasează unul spre celălalt.
Când ionul de sodiu pozitiv ajunge la catod, acesta va câștiga electronul lipsă și va deveni un atom de sodiu. Un proces similar va avea loc cu ionul de clor. Abia când ajunge la anod, ionul de clor va ceda un electron și se va transforma într-un atom de clor. Astfel, curentul este menținut în circuitul extern datorită mișcării electronilor. Și în electrolit, ionii par să transporte electroni de la un pol la altul.
Rezistența electrică a electroliților depinde de cantitatea de ioni formați. În electroliții puternici, nivelul de disociere este foarte ridicat atunci când este dizolvat. Cei slabi sunt jos. De asemenea, rezistența electrică a electrolitului este afectată de temperatură. Odată cu creșterea sa, vâscozitatea lichidului scade și ionii grei și stângaci încep să se miște mai repede. În consecință, rezistența scade.
Dacă soluția de sare este înlocuită cu o soluție de sulfat de cupru. Apoi, când trece un curent prin el, când cationul de cupru ajunge la catod și primește acolo electronii lipsă, acesta va fi restabilit la un atom de cupru. Și dacă după aceea scoți electrodul, poți găsi depuneri de cupru pe el. Acest proces se numește electroliză.