Cataliză. Catalizator. Tipuri de cataliză: omogenă, eterogenă, autocatalizator. Mecanismul reacțiilor catalitice. Cataliza și catalizatorii Principiul de funcționare al unui catalizator într-o reacție chimică
Viteza reacțiilor chimice poate crește dramatic în prezența diferitelor substanțe care nu sunt reactanți și nu fac parte din produșii de reacție. Acest fenomen remarcabil se numește cataliză(din grecescul „katalysis” – distrugere). O substanță care crește viteza unei reacții într-un amestec se numește catalizator. Cantitatea sa înainte și după reacție rămâne neschimbată. Catalizatorii nu reprezintă nicio clasă specială de substanțe. În diferite reacții, metalele, oxizii, acizii, sărurile și compușii complecși pot prezenta un efect catalitic. Reacțiile chimice din celulele vii au loc sub controlul proteinelor catalitice numite enzime. Cataliza trebuie considerată ca un adevărat factor chimic în creșterea vitezei reacțiilor chimice, deoarece catalizatorul este direct implicat în reacție. Cataliza este adesea mai puternică și mai puțin riscantă în accelerarea unei reacții decât creșterea temperaturii. Acest lucru se manifestă în mod clar în exemplul reacțiilor chimice din organismele vii. Reacțiile, cum ar fi hidroliza proteinelor, care în laboratoare trebuie efectuate cu încălzire prelungită până la punctul de fierbere, în timpul digestiei se desfășoară fără încălzire la temperatura corpului.
Pentru prima dată, fenomenul de cataliză a fost observat de chimistul francez L. J. Tenard (1777-1857) în 1818. El a descoperit că oxizii anumitor metale, când se adaugă peroxid de hidrogen într-o soluție, provoacă descompunerea acesteia. O astfel de experiență este ușor de reprodus prin adăugarea de cristale de permanganat de potasiu la o soluție de peroxid de hidrogen 3%. Sarea KMp0 4 se transformă în Mn0 2, iar oxigenul este eliberat rapid din soluție sub acțiunea oxidului:
Efectul direct al catalizatorului asupra vitezei de reacție este asociat cu o scădere a energiei de activare. La scaderea normala a temperaturii? iar cu 20 kJ/mol crește constanta de viteză de aproximativ 3000 de ori. downgrade E L poate fi mult mai puternic. Cu toate acestea, scăderea energiei de activare este o manifestare externă a acțiunii catalizatorului. Reacția este caracterizată de o anumită valoare E. v care se poate schimba numai dacă reacția în sine se modifică. Oferind aceleași produse, reacția cu participarea substanței adăugate se desfășoară pe o cale diferită, prin diferite etape și cu o energie de activare diferită. Dacă pe această nouă cale energia de activare este mai mică și reacția este în mod corespunzător mai rapidă, atunci spunem că această substanță este un catalizator.
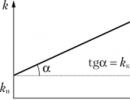
Catalizatorul interacționează cu unul dintre reactanți, formând un compus intermediar. La una dintre etapele ulterioare ale reacției, catalizatorul este regenerat - lasă reacția în forma sa originală. Reactivii, care participă la o reacție catalitică, continuă să interacționeze între ei și pe o cale lentă, fără participarea unui catalizator. Prin urmare, reacțiile catalitice aparțin unei varietăți de reacții complexe numite serie-paralel. Pe fig. 11.8 arată dependența constantei de viteză de concentrația catalizatorului. Graficul de dependență nu trece prin zero, deoarece în absența unui catalizator, reacția nu se oprește.

Orez. 11.8.
constantă observabilă k exprimată ca sumă k u+ & k c(k)
Exemplul 11.5. La o temperatură de -500 °C, reacția de oxidare a oxidului de sulf (IV)
care este una dintre etapele producției industriale de acid sulfuric, este foarte lent. O creștere suplimentară a temperaturii este inacceptabilă, deoarece echilibrul se deplasează la stânga (reacție exotermă) și randamentul produsului scade prea mult. Dar această reacție este accelerată de diverși catalizatori, dintre care unul poate fi oxidul de azot (II). În primul rând, catalizatorul reacţionează cu oxigenul: ![]()
și apoi transferă un atom de oxigen la oxid de sulf (IV):
Astfel, se formează produsul final al reacției și se regenerează catalizatorul. Pentru reacție, a fost deschisă posibilitatea de a curge pe o nouă cale, în care constantele vitezei au crescut semnificativ:

Diagrama de mai jos prezintă ambele căi ale procesului de oxidare a S02. În absența unui catalizator, reacția se desfășoară numai pe calea lentă și, în prezența unui catalizator, de-a lungul ambelor.
Există două tipuri de cataliză - omogenși eterogen.În primul caz, catalizatorul și reactivii formează un sistem omogen sub formă de amestec sau soluție de gaze. Un exemplu de oxidare a oxidului de sulf este cataliza omogenă. Viteza unei reacții catalitice omogene depinde atât de concentrația reactanților, cât și de concentrația catalizatorului.
În cataliza eterogenă, catalizatorul este un solid în formă pură sau pe suport purtător. De exemplu, platina ca catalizator poate fi fixată pe azbest, alumină etc. Moleculele de reactiv sunt adsorbite (absorbite) dintr-un gaz sau soluție în puncte specifice de pe suprafața catalizatorului - centri activi și sunt activate în același timp. După transformarea chimică, moleculele de produs rezultate sunt desorbite de pe suprafața catalizatorului. Actele de transformare a particulelor se repetă la centrele active. Printre alți factori, viteza unei reacții catalitice eterogene depinde de suprafața materialului catalitic.
Cataliza heterogenă este utilizată în special în industrie. Acest lucru se datorează ușurinței efectuării unui proces catalitic continuu cu trecerea unui amestec de reactivi printr-un aparat de contact cu un catalizator.
Catalizatorii acționează selectiv, accelerând un tip foarte specific de reacție sau chiar o singură reacție fără a-i afecta pe alții. Acest lucru face posibilă utilizarea catalizatorilor nu numai pentru a accelera reacțiile, ci și pentru a transforma intenționat materiile prime în produsele dorite. Metanul și apa la 450 ° C pe catalizatorul Fe 2 0 3 sunt transformate în dioxid de carbon și hidrogen:
Aceleași substanțe la 850 °C reacționează pe suprafața nichelului formând monoxid de carbon (II) și hidrogen:

Cataliza aparține acelor domenii ale chimiei în care nu este încă posibil să se facă predicții teoretice precise. Toți catalizatorii industriali pentru prelucrarea produselor petroliere, a gazelor naturale, a producției de amoniac și mulți alții au fost dezvoltați pe baza unor studii experimentale laborioase și îndelungate.
Capacitatea de a controla viteza proceselor chimice este de o importanță inestimabilă în activitatea economică umană. În producția industrială de produse chimice, este de obicei necesară creșterea ratelor proceselor chimice tehnologice, iar în depozitarea produselor este necesară reducerea ratei de descompunere sau expunere la oxigen, apă etc. Substanțe cunoscute care pot încetini reacțiile chimice. Sunt chemați inhibitori, sau catalizatori negativi. Inhibitorii sunt fundamental diferiți de catalizatorii reali prin faptul că reacţionează cu specii active (radicali liberi) care, dintr-un motiv sau altul, apar într-o substanță sau în mediul acesteia și provoacă reacții valoroase de descompunere și oxidare. Inhibitorii se consumă treptat, punând capăt acțiunii lor protectoare. Cel mai important tip de inhibitori sunt antioxidanții, care protejează diferite materiale de efectele oxigenului.
De asemenea, trebuie amintit ceea ce nu se poate realiza cu ajutorul catalizatorilor. Sunt capabili să accelereze doar reacții spontane. Dacă reacția nu are loc spontan, atunci catalizatorul nu o va putea accelera. De exemplu, niciun catalizator nu poate determina descompunerea apei în hidrogen și oxigen. Acest proces poate fi efectuat numai prin electroliză, în timp ce cheltuiește lucrări electrice.
Catalizatorii pot activa, de asemenea, procese nedorite. În ultimele decenii, a avut loc o distrugere treptată a stratului de ozon al atmosferei la o altitudine de 20-25 km. Se presupune că unele substanțe sunt implicate în degradarea ozonului, de exemplu, hidrocarburile halogenate emise în atmosferă de întreprinderile industriale, precum și utilizate în scopuri casnice.
YouTube enciclopedic
1 / 5
✪ Chimie fizică. Curs 3. Cinetică chimică și cataliză
✪ Chimie. Cinetica reacțiilor chimice. Viteza unei reacții chimice. Centrul de învățare online Foxford
✪ Lecție video „Catalizatori și cataliză” - CHIMIE - 9 celule.
✪ Cursul 2. „Cataliza ca fenomen chimic și cinetic”
✪ Introducere în cinetică
Subtitrări
Principiile de bază ale catalizei
Catalizatorul schimbă mecanismul de reacție într-unul mai favorabil din punct de vedere energetic, adică reduce energia de activare. Catalizatorul formează un compus intermediar cu o moleculă a unuia dintre reactanți, în care legăturile chimice sunt slăbite. Acest lucru facilitează reacția acestuia cu al doilea reactiv. Este important de reținut că catalizatorii accelerează reacțiile reversibile atât în direcția înainte, cât și în cea inversă. Prin urmare, ele nu modifică echilibrul chimic.
Tipuri de cataliză
În funcție de influența asupra vitezei de reacție, cataliza este împărțită în pozitivă (viteza de reacție crește) și negativă (rata de reacție scade). În acest din urmă caz, are loc un proces de inhibiție, care nu poate fi considerat „cataliză negativă”, întrucât inhibitorul este consumat în timpul reacției.
Cataliza are loc omogenși eterogen(a lua legatura). În cataliza omogenă, catalizatorul se află în aceeași fază cu reactanții, în timp ce catalizatorii eterogene diferă ca fază.
cataliză omogenă
Un exemplu de cataliză omogenă este descompunerea peroxidului de hidrogen în prezența ionilor de iod. Reacția se desfășoară în două etape:
H 2 O 2 + I → H 2 O + IO H 2 O 2 + IO → H 2 O + O 2 + I
In cataliza omogena actiunea catalizatorului se datoreaza faptului ca acesta interactioneaza cu reactantii pentru a forma compusi intermediari, ceea ce duce la scaderea energiei de activare.
cataliză eterogenă
În cataliza eterogenă, accelerarea procesului are loc de obicei pe suprafața unui corp solid - un catalizator, astfel încât activitatea unui catalizator depinde de mărimea și proprietățile suprafeței sale. În practică, catalizatorul este de obicei sprijinit pe un suport solid poros.
Mecanismul catalizei eterogene este mai complicat decât cel al catalizei omogene. Mecanismul catalizei eterogene include cinci etape, toate fiind reversibile.
- Difuzia reactanților la suprafața unui solid
- Adsorbția fizică pe locurile active ale suprafeței solide a moleculelor care reacţionează și apoi chimisorbția lor
- Reacția chimică între moleculele care reacţionează
- Desorbția produselor de pe suprafața catalizatorului
- Difuzarea produsului de pe suprafața catalizatorului în fluxul general
Un exemplu de cataliza heterogenă este oxidarea SO 2 la SO 3 pe un catalizator V 2 O 5 în producerea acidului sulfuric (metoda de contact).
Cursul reacției pe suprafața catalizatorului poate fi demonstrat într-un experiment în care o placă de platină este încălzită în flacăra unui arzător cu gaz, apoi flacăra este stinsă și un jet de gaz din arzător este suflat pe arzător. placa, în timp ce placa devine din nou roșie - oxidarea metanului are loc pe suprafața metalului.
Purtător de catalizator
purtător de catalizator, in caz contrar substrat (catalizator) (purtător sau suport în engleză) - un material inert sau slab activ care servește la stabilizarea particulelor fazei catalitice active de pe suprafața sa.
Rolul suportului în cataliză eterogenă este de a preveni aglomerarea sau sinterizarea componentului activ, ceea ce face posibilă menținerea unei zone de contact ridicate între substanța activă (vezi faza catalitică activă) și reactanți. Cantitatea de purtător este în general mult mai mare decât cantitatea de ingredient activ aplicată acestuia. Principalele cerințe pentru purtători sunt suprafața mare și porozitatea, stabilitatea termică, inerția chimică, rezistența mecanică ridicată. În unele cazuri, purtătorul afectează proprietățile fazei active (efectul „interacțiunii puternice metal-purtător”). Ca purtători se folosesc atât materiale naturale (argile, piatră ponce, diatomit, azbest etc.), cât și materiale sintetice (carboni activi, silicagel, aluminosilicați, oxizi de aluminiu, magneziu, zirconiu etc.).
Chimia catalizei
Chimia catalizei studiază substanțele care modifică viteza reacțiilor chimice. Substanțele care încetinesc reacțiile se numesc inhibitori. Enzime sunt catalizatori biologici. Catalizatorul nu este în relație stoechiometrică cu produsele și este regenerat după fiecare ciclu de conversie a reactanților în produse. În ciuda apariției unor noi modalități de activare a moleculelor (chimia plasmei, efectele radiațiilor și laserului și altele), cataliza stă la baza producției chimice (ponderea relativă a proceselor catalitice este de 80-90%).
Reacția care a alimentat omenirea (soluția la problema azotului legat) este ciclul Haber-Bosch. Amoniacul este produs cu un catalizator poros de fier. Apare la P = 30 MPași Т = 420-500 °C
3H 2 + N 2 \u003d 2NH 3
Hidrogenul pentru sinteza NH 3 se obține prin două procese catalitice succesive: conversia CH 4 (CH 4 + H 2 O → CO + 3H 2) pe catalizatori Ni - și conversia monoxidului de carbon rezultat (CO + H 2 ). O → CO2 + H2). Pentru a obține grade ridicate de conversie, ultima reacție se desfășoară în două etape: la temperatură înaltă (315-480 °C) - pe Fe - Cr - catalizatori de oxid și la temperatură joasă (200-350 °C) - pe Cu - Zn - catalizatori de oxizi. Din amoniac, acid azotic și alți compuși de azot se obțin - de la medicamente și îngrășăminte până la explozivi.
Distinge cataliza "" omogen, eterogen, interfacial, micelară, enzimatic.
Energie activatoare E reacțiile catalitice sunt mult mai mici decât pentru aceeași reacție în absența unui catalizator. De exemplu, pentru descompunerea necatalitică a NH3 în N2 + H2 E~ 320 kJ/mol, pentru aceeași descompunere în prezența platinei E~ 150 kJ/mol. Datorită reducerii E reacţiile catalitice sunt accelerate în comparaţie cu cele necatalitice.
Aplicarea catalizei în industrie
hidrogenare
Un număr mare de reacții catalitice sunt asociate cu activarea unui atom de hidrogen și a unei alte molecule, ducând la interacțiunea lor chimică. Acest proces se numește hidrogenare și stă la baza multor etape ale rafinării petrolului și producției de combustibili lichizi din cărbune (procesul Bergius). Producția de benzină pentru aviație și combustibil pentru motor din cărbune a fost dezvoltată în Germania în timpul celui de-al Doilea Război Mondial, deoarece în această țară nu există câmpuri petroliere. Procesul Bergius este adăugarea directă de hidrogen la carbon. Cărbunele este încălzit sub presiune în prezența hidrogenului și se obține un produs lichid, care este apoi procesat în benzină de aviație și combustibil pentru motor. Oxidul de fier este utilizat ca catalizator, precum și catalizatori pe bază de staniu și molibden. În timpul războiului, aproximativ 1.400 de tone de combustibil lichid pe zi au fost obținute la 12 fabrici germane folosind procesul Bergius. Un alt proces, Fischer - Tropsch, constă din două etape. În primul rând, cărbunele este gazeificat, adică reacţionează cu vapori de apă şi oxigen şi se obţine un amestec de hidrogen şi oxizi de carbon. Acest amestec este transformat în combustibil lichid folosind catalizatori care conțin fier sau cobalt. Odată cu sfârșitul războiului, producția de combustibil sintetic din cărbune în Germania a fost întreruptă. Ca urmare a creșterii prețului petrolului care a urmat embargoului petrolului din 1973-1974, au fost depuse eforturi puternice pentru a dezvolta o metodă viabilă din punct de vedere economic de producere a benzinei din cărbune. Astfel, lichefierea directă a cărbunelui poate fi efectuată mai eficient utilizând un proces în două etape în care cărbunele este mai întâi contactat cu un catalizator de alumină-cobalt-molibden la o temperatură relativ scăzută și apoi la o temperatură mai ridicată. Costul unei astfel de benzine sintetice este mai mare decât cel obținut din petrol.
cataliză acidă
Activitatea catalitică a unei clase mari de catalizatori se datorează proprietăților lor acide. Potrivit lui J. Bronsted și T. Lowry, un acid este un compus capabil să doneze un proton. Acizii puternici își donează cu ușurință protonii bazelor. Conceptul de aciditate a fost dezvoltat în continuare în lucrările lui G. Lewis, care a definit un acid ca o substanță capabilă să accepte o pereche de electroni dintr-o substanță donatoare cu formarea unei legături covalente datorită socializării acestei perechi de electroni. Aceste idei, împreună cu ideile despre reacțiile care formează ioni de carbeniu, au ajutat la înțelegerea mecanismului diferitelor reacții catalitice, în special a celor care implică hidrocarburi.
Puterea unui acid poate fi determinată folosind un set de baze care își schimbă culoarea atunci când se adaugă un proton. Se pare că unii catalizatori importanți din punct de vedere industrial se comportă ca niște acizi foarte puternici. Acestea includ un catalizator Friedel-Crafts cum ar fi HCI-AlCI203 (sau HAlCI4) şi aluminosilicaţi. Puterea unui acid este o caracteristică foarte importantă, deoarece determină viteza de protonare, o etapă cheie în procesul de cataliză a acidului.
Activitatea catalizatorilor precum aluminosilicații utilizați în cracarea petrolului este determinată de prezența acizilor Bronsted și Lewis pe suprafața lor. Structura lor este similară cu structura silicei (dioxid de siliciu), în care unii dintre atomii de Si 4+ sunt înlocuiți cu atomi de Al 3+. Excesul de sarcină negativă care apare în acest caz poate fi neutralizat de cationii corespunzători.
Activitatea catalizatorilor acizi este determinată de capacitatea lor de a reacționa cu hidrocarburile cu formarea unui ion carbeniu ca produs intermediar. Ionii de alchilcarbeniu conțin un atom de carbon încărcat pozitiv legat de trei grupări alchil și/sau atomi de hidrogen. Ele joacă un rol important ca intermediari formați în multe reacții care implică compuși organici. Mecanismul de acțiune al catalizatorilor acizi poate fi ilustrat prin exemplul reacției de izomerizare n-butan la izobutan în prezenţa HCI-AlCl3 sau Pt-Cl-Al2O3. Mai întâi, o cantitate mică de olefină C4H8 atașează ionul de hidrogen încărcat pozitiv al catalizatorului acid pentru a forma un ion terțiar carbeniu. Apoi ionul hidrură încărcat negativ H - se desprinde de n-butanul pentru a forma izobutan și ionul secundar de butilcarbeniu. Acesta din urmă, ca urmare a rearanjarii, se transformă într-un ion terțiar de carbeniu. Acest lanț poate continua cu eliminarea unui ion hidrură din molecula următoare n- butan etc.
În mod semnificativ, ionii terțiari de carbeniu sunt mai stabili decât cei primari sau secundari. Ca rezultat, sunt prezenți în principal pe suprafața catalizatorului și, prin urmare, principalul produs al izomerizării butanului este izobutanul.
Catalizatorii acizi sunt utilizați pe scară largă în rafinarea petrolului - cracare, alchilare, polimerizare și izomerizare a hidrocarburilor. A fost stabilit mecanismul de acțiune al ionilor de carbeniu, care joacă rolul de catalizatori în aceste procese. În același timp, ei participă la o serie de reacții, inclusiv formarea de molecule mici prin scindarea celor mari, combinarea de molecule (olefină cu olefină sau olefină cu izoparafină), rearanjarea structurală prin izomerizare, formarea de parafine și hidrocarburi aromatice. prin transfer de hidrogen.
Una dintre cele mai recente aplicații industriale ale catalizei acide este producerea de combustibili cu plumb prin adăugarea de alcooli la izobutilenă sau izoamilen. Adăugarea de compuși oxigenați la benzină reduce concentrația de monoxid de carbon din gazele de eșapament. Metil- tert-butil eterul (MTBE) cu un număr octanic de amestec de 109 face posibilă, de asemenea, obținerea combustibilului cu octan mare necesar pentru funcționarea unui motor de automobile cu un raport de compresie ridicat, fără a se recurge la introducerea plumbului tetraetil în benzină. Se organizează și producția de combustibili cu cifre octanice 102 și 111.
Hidrogenarea uleiului vegetal
Una dintre cele mai importante reacții de hidrogenare în practică este hidrogenarea incompletă a uleiurilor vegetale în margarină, ulei de gătit și alte produse alimentare. Uleiurile vegetale sunt obținute din boabe de soia, semințe de bumbac și alte culturi. Acestea includ esteri, și anume trigliceridele acizilor grași cu diferite grade de nesaturare. Acidul oleic CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH are o legătură dublă C \u003d C, acidul linoleic - doi și linolenic - trei. Adăugarea de hidrogen pentru a rupe această legătură previne oxidarea (râncezirea) uleiurilor. Acest lucru le ridică punctul de topire. Duritatea majorității produselor obținute depinde de gradul de hidrogenare. Hidrogenarea se realizează în prezența unei pulberi fine de nichel depuse pe un substrat sau catalizator de nichel Raney într-o atmosferă de hidrogen înalt purificată.
Dehidrogenare
Dehidrogenarea este, de asemenea, o reacție catalitică importantă din punct de vedere industrial, deși amploarea aplicării sale este incomparabil mai mică. Cu ajutorul lui, de exemplu, se obține stirenul, un monomer important. Pentru a face acest lucru, dehidrogenați etilbenzenul în prezența unui catalizator care conține oxid de fier; potasiul și un anumit stabilizator structural contribuie, de asemenea, la reacție. La scară industrială, propanul, butanul și alcani sunt dehidrogenați. Dehidrogenarea butanului în prezența unui catalizator de alumină-crom produce butene și butadienă.
Amoniac
Unul dintre cele mai simple procese de hidrogenare din punct de vedere chimic este sinteza amoniacului din hidrogen și azot. Azotul este o substanță foarte inertă. Pentru a rupe legătura N-N din molecula sa, este necesară o energie de ordinul a 200 kcal/mol. Cu toate acestea, azotul se leagă de suprafața catalizatorului de fier în stare atomică, iar acest lucru necesită doar 20 kcal / mol. Hidrogenul se leagă de fier și mai ușor.
cataliză bazică
Activitatea catalizatorilor este determinată de proprietățile lor de bază. Un exemplu vechi și binecunoscut de astfel de catalizatori este hidroxidul de sodiu utilizat pentru hidroliza sau saponificarea grăsimilor în fabricarea săpunului, iar un exemplu recent îl reprezintă catalizatorii utilizați la producerea de materiale plastice și spume poliuretanice. Uretanul se formează prin interacțiunea alcoolului cu izocianatul, iar această reacție este accelerată în prezența aminelor bazice. În timpul reacției, baza este atașată la atomul de carbon din molecula de izocianat, în urma căreia apare o sarcină negativă asupra atomului de azot și crește activitatea acestuia față de alcool. Un catalizator deosebit de eficient este trietilendiamina. Materialele plastice poliuretanice se obțin prin reacția diizocianaților cu polioli (polialcooli). Când izocianatul reacţionează cu apa, uretanul format anterior se descompune eliberând CO2. Când un amestec de polialcooli și apă reacţionează cu diizocianaţii, spuma poliuretanică rezultată se formează cu CO2 gazos.
Catalizatori cu acțiune dublă
Acești catalizatori accelerează două tipuri de reacții și dau rezultate mai bune decât trecerea reactanților în serie prin două reactoare care conțin fiecare un singur tip de catalizator. Acest lucru se datorează faptului că situsurile active ale catalizatorului cu dublă acțiune sunt foarte apropiate unele de altele, iar produsul intermediar format pe unul dintre ele se transformă imediat în produsul final pe celălalt. Combinarea unui catalizator de activare a hidrogenului cu un catalizator de promovare a izomerizării hidrocarburilor dă un rezultat bun. Activarea hidrogenului este realizată de unele metale, iar izomerizarea hidrocarburilor de către acizi. Un catalizator eficient cu dublă acțiune utilizat în rafinarea petrolului pentru a transforma nafta în benzină este platina fin dispersată depusă pe alumina acidă. Conversia componentelor nafta, cum ar fi metilciclopentanul metilciclopentanul (MCP) în benzen, crește numărul octanic al benzinei. În primul rând, MCP este dehidrogenat pe partea de platină a catalizatorului într-o olefină cu același schelet de carbon; apoi olefina trece în partea acidă a catalizatorului, unde izomerizează la ciclohexenă. Acesta din urmă trece în partea de platină și se dehidrogenează în benzen și hidrogen. Catalizatorii cu acțiune dublă accelerează semnificativ reformarea uleiului. Ele sunt utilizate pentru izomerizarea parafinelor normale în izoparafine. Acestea din urmă, care fierb la aceleași temperaturi ca și fracțiunile de benzină, sunt valoroase deoarece au un număr octanic mai mare în comparație cu hidrocarburile simple. În plus, conversia n-butanului în izobutan este însoțită de dehidrogenare, contribuind la producerea de MTBE.
Polimerizare stereospecifică
O etapă importantă în istoria catalizei a fost descoperirea polimerizării catalitice a olefinelor cu formarea de polimeri stereoregulați. Catalizatorii de polimerizare stereospecifici au fost descoperiți de K. Ziegler când a încercat să explice proprietățile neobișnuite ale polimerilor pe care i-a obținut. Un alt chimist, J. Natta, a sugerat că unicitatea polimerilor Ziegler este determinată de stereoregularitatea lor. Experimentele de difracție cu raze X au arătat că polimerii preparați din propilenă în prezența catalizatorilor Ziegler sunt foarte cristalini și au într-adevăr o structură stereoregulată. Natta a introdus termenii „izotactic” și „sindiotactic” pentru a descrie astfel de structuri ordonate. Când nu există ordine, se folosește termenul „atactic”.
O reacție stereospecifică are loc pe suprafața catalizatorilor solizi care conțin metale de tranziție din grupele IVA-VIII (cum ar fi Ti, V, Cr, Zr) într-o stare incomplet oxidată și orice compus care conține carbon sau hidrogen, care este asociat cu un metal din grupele I-III. Un exemplu clasic de astfel de catalizator este precipitatul format în timpul interacțiunii dintre TiCl4 și Al(C2H5)3 în heptan, unde titanul este redus la starea trivalentă. Acest sistem extrem de activ catalizează polimerizarea propilenei la temperatură și presiune normale.
oxidare catalitică
Utilizarea catalizatorilor pentru controlul chimiei proceselor de oxidare are o mare importanță științifică și practică. În unele cazuri, oxidarea trebuie să fie completă, de exemplu, la neutralizarea contaminanților cu CO și hidrocarburi din gazele de eșapament ale mașinii. Mai des, totuși, este de dorit ca oxidarea să fie incompletă, de exemplu în multe dintre procesele utilizate pe scară largă în industrie pentru conversia hidrocarburilor în intermediari valoroși care conțin grupări funcționale cum ar fi -CHO, -COOH, -C-CO, - CN. În acest caz, se folosesc atât catalizatori omogene, cât și eterogene. Un exemplu de catalizator omogen este un complex de metal de tranziție, care este utilizat pentru a oxida para-xilenul la acid tereftalic, ai cărui esteri sunt baza pentru producerea fibrelor de poliester.
Producția de etilenă prin dehidrodimerizarea metanului
Sinteza etilenei prin dehidrodimerizare permite ca gazele naturale să fie transformate în hidrocarburi mai ușor transportabile. Reacţia 2CH4 + 2O2 → C2H4 + 2H2O este efectuată la 850 °C utilizând diferiţi catalizatori; cele mai bune rezultate se obțin cu catalizatorul Li-MgO. Probabil, reacția are loc prin formarea unui radical metil prin separarea unui atom de hidrogen dintr-o moleculă de metan. Scindarea este realizată de oxigen incomplet redus, de exemplu, O2−
2. Radicalii metil din faza gazoasă se recombină pentru a forma o moleculă de etan și sunt transformați în etilenă în timpul dehidrogenării ulterioare. Un alt exemplu de oxidare incompletă este conversia metanolului în formaldehidă în prezența unui catalizator de argint sau fier-molibden.
catalizatori de oxidare eterogene
Acești catalizatori sunt de obicei oxizi solizi complecși. Oxidarea catalitică are loc în două etape. În primul rând, oxidul de oxigen este captat de o moleculă de hidrocarbură adsorbită pe suprafața oxidului. Hidrocarbura este oxidată și oxidul este redus. Oxidul redus reacționează cu oxigenul și revine la starea inițială. Folosind un catalizator de vanadiu, anhidrida ftalică se obține prin oxidarea parțială a naftalinei sau butanului.
Definiţia catalysis. Tipuri de cataliză. Chemisorbția și formarea unui complex intermediar activat. Energia de activare a unei reacții catalitice. Cataliza si echilibru. aplicarea catalizei.
Cataliză- fenomenul de excitare a reacţiilor chimice de către substanţe speciale - catalizatori. Catalizatorul intră în mod repetat într-o interacțiune chimică intermediară cu substanțele implicate în reacție și își restabilește compoziția după fiecare ciclu de interacțiuni intermediare.
cataliză omogenă– reactanții și catalizatorul formează o fază.
cataliză eterogenă- substantele si catalizatorul sunt in faze diferite.
Cataliza microeterogenă ocupa o pozitie intermediara intre cataliza omogena si cea eterogena. Catalizatorul este o moleculă mare de polimer. Pentru moleculele mici care interacționează asupra lor, ele sunt similare cu particulele eterogene, dar formează o singură fază cu reactivii. Acest grup include reacții enzimatice în care catalizatorul (enzima) este molecule mari de proteine cu compoziție și structură complexă. Prin urmare, se numește cataliză enzimatică.
Transformarea chimică are loc prin formarea unui complex activ cu exces de energie. Este suficient pentru rearanjarea noilor substanțe - produse de reacție. Modificarea energiei sistemului în timpul interacțiunii chimice de-a lungul căii de reacție (1).
A - complex activat
K - conexiune intermediară cu un catalizator
E 0, E k - energiile substanțelor și produselor inițiale
E 1, E 2 - energii de activare a transformării în direcțiile înainte și invers
∆H este modificarea energiei ca urmare a transformării (efectul termic).
Dar nu toate moleculele au suficientă energie pentru a forma un complex activ - doar acelea a căror energie depășește energia de activare E 1 . Dacă energia necesară E 1 este mare, atunci reacția practic nu are loc.
Catalizatorul deschide o nouă cale de reacție prin reacția chimică pentru a forma un complex activat cu mai puțină energie decât este necesară pentru a forma un complex activat fără catalizator. Compusul intermediar, care include un catalizator, este transformat în continuare în produse printr-un alt complex activat, dar și cu energie mai mică. După a doua etapă a reacției, catalizatorul își restabilește compoziția chimică și componentele sale nu sunt incluse în compoziția produselor. Și deși calea de reacție se prelungește și devine o etapă, o scădere a energiei complexului activat duce la o creștere a vitezei de reacție (2).
Sursa necunoscută
Un interes deosebit pentru cataliză s-a manifestat în timpul dezvoltării chimiei industriale, deoarece capacitatea de a accelera reacțiile chimice în direcția corectă fără a consuma energie și, în esență, fără a consuma substanța catalizatoare în sine, a dat catalizei o mare semnificație practică. Cu ajutorul catalizei, problemele cu care se confruntă tehnologia azotului legat sunt rezolvate, mai mult de 80% din ulei este prelucrat prin procese catalitice, este imposibil să se realizeze majoritatea proceselor de sinteză organică.
Catalizatori- substanțe care, intrând în mod repetat într-o interacțiune intermediară cu participanții la reacție, își schimbă mecanismul și cresc viteza de reacție; in acelasi timp isi refac compozitia chimica dupa fiecare ciclu de expuneri intermediare.
Efectul unui catalizator asupra mecanismului unei reacții chimice poate fi explicat printr-un exemplu convențional. Fie ca o reacție într-o singură etapă să continue cu o energie de activare E 0:
Derularea reacției pe diagrama energetică a reacțiilor catalitice și necatalitice este prezentată de curba 1. În prezența unui catalizator, mecanismul de reacție se modifică, acesta parcurgând mai multe etape succesive (curba 2). De exemplu, prima etapă poate fi formarea unui complex Akt activat intermediar:
A + Kt → AKt
Complexul activat reacţionează apoi cu un al doilea reactant pentru a forma un complex catalizator-produs:
ACT + V → RKt
Ultima etapă este descompunerea complexului RKt cu formarea produsului K și eliberarea catalizatorului pentru un nou ciclu catalitic:
Rkt → R + Kt
Fiecare dintre aceste etape succesive se caracterizează prin energiile sale de activare E 1 , E 2 , E 3 , dar, de regulă, înălţimea fiecăreia dintre aceste bariere de potenţial este mai mică decât energia de activare E 0 . Astfel, în prezența unui catalizator, reacția se desfășoară pe o cale mai favorabilă din punct de vedere energetic, ceea ce permite desfășurarea procesului la o viteză mai mare.
Stările energetice inițiale (I) și finale (II) ale sistemului de reacție în prezența unui catalizator și fără acesta rămân aceleași; prin urmare: catalizatorul nu poate schimba starea de echilibru chimic, care este independentă de calea de reacție.
Rolul catalizatorului este doar de a modifica viteza cu care se atinge starea de echilibru. Un catalizator poate crește viteza numai acelor procese care sunt permise termodinamic, dar nu poate iniția reacții termodinamic imposibile.
Unele reacții chimice fără catalizator sunt practic imposibile din cauza unei energii de activare prea mari. S-ar părea că, pentru a depăși o barieră energetică mare, este posibilă creșterea energiei cinetice a moleculelor, adică creșterea temperaturii. Dar pentru multe reacții exoterme reversibile, o creștere a temperaturii duce la o schimbare a echilibrului în direcția opusă și face ca reacția să nu fie rezolvată termodinamic. În astfel de cazuri, utilizarea catalizatorilor nu este doar justificată, ci și necesară. Catalizatorul reduce energie activatoareși permite astfel să fie efectuată la temperaturi semnificativ mai scăzute.
Moleculele de reactiv sunt adsorbite pe suprafața catalizatorului. Adsorbția este un fenomen asociat cu o scădere a cantității de gaz atunci când un gaz (adsorbat) intră în contact cu un solid (adsorbant) și constă într-o oarecare compactare a gazului pe suprafața solidului. Adsorbția fizică și chimisorbția se disting în funcție de natura forțelor care provoacă această concentrație de molecule de adsorbat la suprafața unui solid. Dacă aceste forțe sunt de aceeași natură cu acțiunea moleculară în gaze, lichide și solide, atunci se vorbește de adsorbție fizică. La chimisorbtie se manifestă forțe de interacțiune de natură chimică - moleculele de adsorbat își pierd individualitatea, formând compuși de suprafață cu adsorbantul.
În cursul proceselor catalitice, rolul principal revine chimisorbției, sau adsorbției activate, care are ca rezultat formarea complex de adsorbție activat- un intermediar instabil între reactant și catalizator. Etapa de adsorbție activată determină specificitatea acțiunii catalizatorilor în raport cu diverse reacții. Dacă legătura chimică a reactantului cu adsorbantul este prea puternică, distrugerea formării complexului, ducând la formarea de produse, este dificilă. Dacă legătura dintre adsorbant și adsorbat este prea slabă, apropiată în natură de adsorbția fizică, atunci nu există o slăbire a legăturilor în molecula de adsorbat, ceea ce duce la o scădere a energiei de activare a procesului catalitic în comparație cu cel non- unul catalitic.
Tehnologia chimică generală, Kutepov A.M., Moscova, Școala Superioară, 1990, p. 206-207, 214, 205
Cataliză(Greaca κατάλυσις se întoarce la καταλύειν - distrugere) - accelerarea selectivă a uneia dintre direcțiile posibile termodinamic permise ale unei reacții chimice sub acțiunea unui catalizator (catalizatori), care intră în mod repetat într-o interacțiune chimică intermediară cu participanții la reacție și îşi restabileşte compoziţia chimică după fiecare ciclu de interacţiuni chimice intermediare. Termenul de „cataliza” a fost introdus în 1835 de omul de știință suedez Jöns Jakob Berzelius. acid azotic etc.). Cele mai multe reacții industriale sunt catalitice.Cazul în care catalizatorul este unul dintre produșii de reacție sau materiile sale inițiale se numește autocataliză.Catalizatorul schimbă mecanismul de reacție într-unul mai favorabil energetic, adică reduce energia de activare. Catalizatorul formează un compus intermediar cu o moleculă a unuia dintre reactanți, în care legăturile chimice sunt slăbite. Acest lucru facilitează reacția acestuia cu al doilea reactiv. Este important de reținut că catalizatorii accelerează reacțiile reversibile atât în direcția înainte, cât și în cea inversă. Prin urmare, ele nu modifică echilibrul chimic [
Aplicarea catalizei în industrie
hidrogenare[editează | editați textul wiki]
Un număr mare de reacții catalitice sunt asociate cu activarea unui atom de hidrogen și a unei alte molecule, ducând la interacțiunea lor chimică. Acest proces se numește hidrogenare și stă la baza multor etape ale rafinării petrolului și producției de combustibili lichizi din cărbune (procesul Bergius). Producția de benzină pentru aviație și combustibil pentru motor din cărbune a fost dezvoltată în Germania în timpul celui de-al Doilea Război Mondial, deoarece în această țară nu există câmpuri petroliere. Procesul Bergius este adăugarea directă de hidrogen la carbon. Cărbunele este încălzit sub presiune în prezența hidrogenului și se obține un produs lichid, care este apoi procesat în benzină de aviație și combustibil pentru motor. Oxidul de fier este utilizat ca catalizator, precum și catalizatori pe bază de staniu și molibden. În timpul războiului, aproximativ 1.400 de tone de combustibil lichid pe zi au fost obținute la 12 fabrici germane folosind procesul Bergius. Un alt proces, Fischer - Tropsch, constă din două etape. În primul rând, cărbunele este gazeificat, adică reacţionează cu vapori de apă şi oxigen şi se obţine un amestec de hidrogen şi oxizi de carbon. Acest amestec este transformat în combustibil lichid folosind catalizatori care conțin fier sau cobalt. Odată cu sfârșitul războiului, producția de combustibil sintetic din cărbune în Germania a fost întreruptă. Ca urmare a creșterii prețului petrolului care a urmat embargoului petrolului din 1973-1974, au fost depuse eforturi puternice pentru a dezvolta o metodă viabilă din punct de vedere economic de producere a benzinei din cărbune. Astfel, lichefierea directă a cărbunelui poate fi efectuată mai eficient utilizând un proces în două etape în care cărbunele este mai întâi contactat cu un catalizator de alumină-cobalt-molibden la o temperatură relativ scăzută și apoi la o temperatură mai ridicată. Costul unei astfel de benzine sintetice este mai mare decât cel obținut din petrol.
cataliză acidă[editează | editați textul wiki]
Activitatea catalitică a unei clase mari de catalizatori se datorează proprietăților lor acide. Potrivit lui J. Bronsted și T. Lowry, un acid este un compus capabil să doneze un proton. Acizii puternici își donează cu ușurință protonii bazelor. Conceptul de aciditate a fost dezvoltat în continuare în lucrările lui G. Lewis, care a definit un acid ca o substanță capabilă să accepte o pereche de electroni dintr-o substanță donatoare cu formarea unei legături covalente datorită socializării acestei perechi de electroni. Aceste idei, împreună cu ideile despre reacțiile care formează ioni de carbeniu, au ajutat la înțelegerea mecanismului diferitelor reacții catalitice, în special a celor care implică hidrocarburi.
În funcție de influența asupra vitezei de reacție, cataliza este împărțită în pozitivă (viteza de reacție crește) și negativă (rata de reacție scade). În acest din urmă caz, are loc un proces de inhibiție, care nu poate fi considerat „cataliză negativă”, întrucât inhibitorul este consumat în timpul reacției.
Cataliza are loc omogenși eterogen(a lua legatura). În cataliza omogenă, catalizatorul se află în aceeași fază cu reactanții, în timp ce catalizatorii eterogene diferă ca fază.
cataliză omogenă[editează | editați textul wiki]
Un exemplu de cataliză omogenă este descompunerea peroxidului de hidrogen în prezența ionilor de iod. Reacția se desfășoară în două etape:
H2O2 + I → H2O + IO
H 2 O 2 + IO → H 2 O + O 2 + I
In cataliza omogena actiunea catalizatorului se datoreaza faptului ca acesta interactioneaza cu reactantii pentru a forma compusi intermediari, ceea ce duce la scaderea energiei de activare.
cataliză eterogenă[editează | editați textul wiki]
În cataliza eterogenă, accelerarea procesului are loc de obicei pe suprafața unui corp solid - catalizatorul, astfel încât activitatea catalizatorului depinde de mărimea și proprietățile suprafeței sale. În practică, catalizatorul este de obicei sprijinit pe un suport solid poros.
Mecanismul catalizei eterogene este mai complicat decât cel al catalizei omogene. Mecanismul catalizei eterogene include cinci etape, toate fiind reversibile.
1. Difuzia reactanților la suprafața unui solid
2. Adsorbția fizică pe locurile active ale suprafeței unei substanțe solide a moleculelor care reacţionează și apoi chimisorbția lor
3. Reacția chimică între moleculele care reacţionează
4. Desorbția produselor de pe suprafața catalizatorului
5. Difuzia produsului de pe suprafața catalizatorului în fluxul general
Un exemplu de cataliza heterogenă este oxidarea SO 2 la SO 3 pe un catalizator V 2 O 5 în producerea acidului sulfuric (metoda de contact).
Cursul reacției pe suprafața catalizatorului poate fi demonstrat într-un experiment în care o placă de platină este încălzită în flacăra unui arzător cu gaz, apoi flacăra este stinsă și un jet de gaz din arzător este suflat pe arzător. placa, în timp ce placa devine din nou roșie - oxidarea metanului are loc pe suprafața metalului.
Cataliza este una dintre cele mai comune metode din chimie pentru accelerarea reacțiilor chimice.
cataliză numită modificare selectivă a vitezei reacțiilor chimice în prezența unor substanțe (catalizatori), care, participând la procese intermediare, sunt regenerate în timpul reacției și nu fac parte din produsele finale.
cataliză pozitivă, sau pur și simplu cataliză, - aceasta este o creștere semnificativă a vitezei unei reacții, de exemplu, producția de acid sulfuric sau oxidarea amoniacului în prezența platinei. cataliză negativă, sau inhibitie, - aceasta este o încetinire a reacției, de exemplu, interacțiunea unei soluții de sulfit de sodiu cu oxigenul atmosferic în prezența alcoolului etilic sau descompunerea peroxidului de hidrogen la concentrații scăzute de acid sulfuric (inhibitori, respectiv, alcool etilic și acid sulfuric) .
Reacțiile care au loc sub acțiunea catalizatorilor se numesc catalitice.
Acțiunea unui catalizator în procesul de schimbare a unui sistem chimic poate fi nu numai accelerare, dar deasemenea îndrumător: dacă sistemul chimic inițial se poate dezvolta în mai multe direcții termodinamic posibile în condiții date, catalizatorul accelerează predominant una dintre ele.
Cataliza modifică mecanismul de reacție. Se formează catalizatorul și una dintre materiile prime complex activat- un compus intermediar care reacţionează cu o altă materie primă pentru a forma produşi de reacţie şi a regenera moleculele de catalizator.
Fie că unele reacții A + B = AB au o energie de activare foarte mare E ași deci procedați încet. Diagrama sa energetică este prezentată în fig. 4.4, A.
Orez. 4.4. Modificarea entalpiei în timpul reacției: a - fără catalizator: b- cu catalizator
Dacă această reacție este efectuată în prezența catalizatorului K (Fig. 4.4, b), atunci intră într-o interacțiune chimică cu una dintre substanțele inițiale (de exemplu, A), în urma căreia, prin bateria activată complex *, un compus chimic instabil AK se formează conform reacției A + K = AK. Energia de activare a acestui proces E" mai puțin decât în absența unui catalizator (E a „prin urmare, reacția se desfășoară rapid. În plus, intermediarul AA printr-un alt complex activat, AVK *, interacționează cu al doilea material de pornire B: AK + B \u003d AB + K; în acest caz, catalizatorul revine la nivelul său. starea originală.Energia de activare a acestui proces este de asemenea mică (E „ceea ce face ca acesta să meargă cu o viteză mare. Când însumăm ambele procese care au loc succesiv, se obține ecuația finală pentru o reacție rapidă: A + B (+ K) \u003d AB (+ K). Este indicat catalizatorul în această ecuaţie doar pentru a sublinia faptul regenerării sale.
Comun tuturor catalizatorilor este că aceștia schimbă întotdeauna energia de activare, scăzând-o cu cataliză pozitivă, de exemplu. coborând înălțimea barierei energetice. În prezența unui catalizator, se formează un complex activat cu un nivel de energie mai mic decât fără acesta, rezultând o creștere semnificativă a vitezei de reacție.
După caracteristica de fază, se disting cataliză omogenă (omogenă) și eterogenă (neuniformă); cataliza enzimatică este considerată separat.
La cataliză omogenă catalizatorul și reactanții formează o singură fază (gaz sau soluție) în care nu există interfețe (limite de fază). Procesele catalitice în fază gazoasă și lichidă sunt foarte numeroase. Un exemplu de cataliză omogenă în faza gazoasă este oxidarea catalitică a oxidului de sulf (IV) într-o metodă cu cameră pentru producerea acidului sulfuric. Oxidarea dioxidului de sulf la trioxid în funcție de reacție:
curge încet. Introducerea catalizatorului NO modifică mecanismul de reacție: 
și reduce energia de activare și, prin urmare, crește viteza reacției.
În cataliza omogenă, viteza unei reacții chimice este proporțională cu concentrația catalizatorului. Dezavantajele catalizei omogene în soluții sunt domeniul limitat de temperatură și, în unele cazuri, dificultatea de a separa catalizatorul de produșii de reacție.
La cataliză eterogenă catalizatorul (de obicei un solid) se află în sistem ca fază independentă, adică există o interfață între catalizator și reactanți (gaze sau lichide). Astfel, oxidarea amoniacului (faza gazoasa) se realizeaza in prezenta platinei (faza solida), iar descompunerea peroxidului de hidrogen (faza lichida) este accelerata de carbune sau oxid de mangan (IV), prezent sub forma unui faza solida:
În cataliză eterogenă, toate reacțiile au loc la limita de fază, adică. pe suprafața catalizatorului, a cărui activitate depinde de proprietățile suprafeței sale - dimensiunea zonei, compoziția chimică, deficiența structurii și a stării. Caracteristicile cineticii proceselor sunt determinate de difuzie și adsorbție.
Suprafața catalizatorului (adsorbantului) este fizic neomogenă și are așa-numita centre active, pe care reacțiile catalitice au loc în principal datorită adsorbției reactanților (adsorbaților) pe acești centri și creșterii concentrației acestora pe suprafața catalizatorului. Acest lucru accelerează parțial reacția. Cu toate acestea, principalul motiv pentru creșterea vitezei de reacție este o creștere semnificativă a activității chimice a moleculelor adsorbite, în care legăturile dintre atomi sunt slăbite sub acțiunea unui catalizator, ceea ce face ca aceste molecule să fie mai reactive. Accelerarea reacției în acest caz are loc și ca urmare a unei scăderi a energiei de activare, la care o anumită contribuție are și formarea intermediarilor de suprafață.
Substanțele care otrăvesc catalizatorul solid, de ex. reducerea sau distrugerea completă a activității sale se numesc otravuri catalitice. De exemplu, compușii de arsen, mercur, plumb, cianuri otrăvează catalizatorii de platină, care trebuie regenerați în condiții de producție în acest caz.
Substanțele care intensifică acțiunea catalizatorilor pentru o reacție dată, dar nu sunt ele însele catalizatori, sunt numite promotori. Este cunoscut, de exemplu, promovarea catalizatorilor de platină cu adaosuri de fier, aluminiu etc.
Selectivitatea (selectivitatea) acțiunii Utilizarea catalizatorilor se manifestă, în special, prin faptul că cu ajutorul unor catalizatori diferiți este posibil să se obțină diferiți produse din aceeași substanță. Deci, în prezența unui catalizator Al 2 O e la 300 ° C, se obțin apă și etilenă din alcool etilic:

Dar dacă pulberea de cupru este folosită ca catalizator la aceeași temperatură, atunci alcoolul etilic se descompune în hidrogen și acetaldehidă:
Astfel, pentru fiecare reacție există un catalizator.
Cu participarea catalizatorilor biologici, enzime procese chimice complexe au loc în organismele vegetale și animale. De exemplu, saliva conține enzima ptialină, care catalizează conversia amidonului în zahăr, iar pepsina, care este prezentă în sucul gastric, favorizează descompunerea proteinelor. Există aproximativ 3.000 de enzime diferite în corpul uman, fiecare dintre acestea fiind un catalizator eficient pentru reacția corespunzătoare.
Mulți catalizatori, în special enzimele, au pur individual acțiune catalitică, motiv pentru care se numesc specific individual.