Substanțe pure și amestecuri. Metode de separare a amestecurilor. Metode de separare a amestecurilor Ce metode de separare a amestecurilor cunoașteți
Rezumat după disciplină: Chimie
Pe tema: Metode de separare a amestecurilor
Riga - 2009
Introducere………………………………………………………………………………..pagina 3
Tipuri de amestecuri……………………………………………………………………………… p.4
Metode de separare a amestecurilor……………………………………………………..pagina 6
Concluzie…………………………………………………………………….pagina 11
Lista de referinte…………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………… ………..p.12
Introducere
În natură, substanțele în forma lor pură sunt foarte rare. Majoritatea obiectelor din jurul nostru sunt alcătuite dintr-un amestec de substanțe. Într-un laborator de chimie, chimiștii lucrează cu substanțe pure. Dacă substanța conține impurități, atunci orice chimist poate separa substanța necesară experimentului de impurități. Pentru a studia proprietățile substanțelor, este necesară purificarea acestei substanțe, adică. împărțit în părți componente. Separarea unui amestec este un proces fizic. Metodele fizice de separare a substanțelor sunt utilizate pe scară largă în laboratoarele chimice, în producția de produse alimentare, în producția de metale și alte substanțe.
Tipuri de amestecuri
Nu există substanțe pure în natură. Când luăm în considerare bolovani, granit, suntem convinși că sunt formați din boabe, filoane de diferite culori; laptele conține grăsimi, proteine, apă; petrolul și gazele naturale conțin substanțe organice numite hidrocarburi; aerul conține diverse gaze; apa naturală nu este o substanță pură din punct de vedere chimic. Un amestec este un amestec de două sau mai multe substanțe diferite.
Amestecuri pot fi împărțite în două grupuri mari (ri
Dacă componentele amestecului sunt vizibile cu ochiul liber, atunci se numesc astfel de amestecuri eterogen. De exemplu, un amestec de pilitură de lemn și fier, un amestec de apă și ulei vegetal, un amestec de nisip de râu și apă etc.
Dacă componentele amestecului nu pot fi distinse cu ochiul liber, atunci se numesc astfel de amestecuri omogen. Amestecuri precum laptele, uleiul, o soluție de zahăr în apă etc. sunt clasificate ca amestecuri omogene.
Există substanțe solide, lichide și gazoase. Substanțele pot fi amestecate în orice stare de agregare. Starea de agregare a unui amestec determină o substanță care este cantitativ superioară restului.
Amestecuri eterogene se formează din substanțe cu diferite stări agregate, atunci când substanțele nu se dizolvă reciproc și se amestecă slab (Tabelul 1)
|
Tipuri de amestecuri eterogene |
|
|
înainte de amestecare |
Exemple |
|
tare/solid |
Minerale; fier/sulf |
|
solid/lichid |
Mortar de var; ape uzate |
|
solid/gazos |
Fum; aer prăfuit |
|
lichid/solid |
Perla; minerale; gheata |
|
lichid / lichid |
Lapte; ulei vegetal/apă |
|
lichid/gazos |
Ceaţă; nori |
|
gazos/solid |
Styrofoam |
|
gazos/lichid |
spumă de săpun |
Amestecuri omogene se formează atunci când substanțele se dizolvă bine unele în altele și se amestecă bine (Tabelul 2).
|
Tipuri de amestecuri omogene |
|
|
Starea agregată a părților constitutive înainte de amestecare |
Exemple |
|
tare/solid |
Aliaj de aur și argint |
|
solid/lichid |
zahăr/apă |
|
solid/gazos |
Vaporii de iod în aer |
|
lichid/solid |
gelatină umflată |
|
lichid / lichid |
alcool/apă |
|
lichid/gazos |
Apă/aer |
|
gazos/solid |
Hidrogen în paladiu |
|
gazos/lichid |
|
Când se formează amestecuri, transformările chimice de obicei nu au loc, iar substanțele din amestec își păstrează proprietățile. Diferențele de proprietăți ale substanțelor sunt folosite pentru a separa amestecurile.
Metode de separare a amestecurilor
Amestecuri, atât neomogene, cât și omogene, pot fi împărțite în părți constitutive, adică. pentru substanțele pure. Substanțele pure sunt substanțe care nu pot fi separate în două sau mai multe alte substanțe folosind metode fizice și nu își modifică proprietățile fizice. Există diferite metode de separare a amestecurilor; anumite metode de separare a amestecurilor sunt utilizate în funcție de compoziția amestecului.
- Screening;
- Filtrare;
- așezarea;
- Decantare
- centrifugare;
- Evaporare;
- Evaporare;
- Recristalizare;
- Distilare (distilare);
- Congelare;
- Acțiunea magnetului;
- Cromatografia;
- Extracţie;
- Adsorbţie.
Să facem cunoștință cu câteva dintre ele. Aici trebuie remarcat faptul că este mai ușor de separat amestecurile eterogene decât cele omogene.Mai jos dăm exemple de separare a substanțelor din amestecurile omogene și eterogene.
Screening.
Să ne imaginăm că zahărul granulat a intrat în făină. Poate cel mai simplu mod de a se separa este screening. Cu ajutorul unei site, puteți separa cu ușurință particulele mici de făină de cristalele de zahăr relativ mari. În agricultură, cernuirea este folosită pentru a separa semințele plantelor de resturile străine. În construcții, pietrișul este separat de nisip în acest fel.
Filtrare
Componenta solidă a suspensiei este separată de lichid filtrare, folosind filtre de hârtie sau țesături, vată, un strat subțire de nisip fin. Să ne imaginăm că ni se dă un amestec de sare de masă, nisip și argilă. Este necesar să se separe sarea de masă din amestec. Pentru a face acest lucru, puneți amestecul într-un pahar cu apă și agitați. Sarea de masă se dizolvă și nisipul se depune. Argila nu se dizolvă și nu se depune pe fundul paharului, astfel încât apa rămâne tulbure. Pentru a îndepărta particulele de argilă insolubile din soluție, amestecul este filtrat. Pentru a face acest lucru, trebuie să asamblați un dispozitiv mic de filtrare dintr-o pâlnie de sticlă, hârtie de filtru și un trepied. Soluția de sare este filtrată. Pentru a face acest lucru, soluția filtrată este turnată cu atenție într-o pâlnie cu un filtru bine introdus. Particulele de nisip și argilă rămân pe filtru, iar o soluție de sare limpede trece prin filtru. Recristalizarea este utilizată pentru a izola sare dizolvată în apă.
recristalizare, evaporare
Recristalizare se numește o metodă de purificare, în care substanța este mai întâi dizolvată în apă, apoi soluția substanței în apă este evaporată. Ca urmare, apa se evaporă, iar substanța este eliberată sub formă de cristale.
Să dăm un exemplu: Este necesară izolarea sării de masă dintr-o soluție.
Mai sus, am considerat un exemplu când a fost necesară izolarea sării de masă dintr-un amestec eterogen. Acum să separăm sarea de masă dintr-un amestec omogen. Soluția obținută prin filtrare se numește filtrat. Filtratul trebuie turnat într-o cană de porțelan. Puneți paharul cu soluția pe inelul trepiedului și încălziți soluția peste flacăra lămpii cu spirt. Apa va începe să se evapore și volumul soluției va scădea. Un astfel de proces se numește evaporare. Pe măsură ce apa se evaporă, soluția devine mai concentrată. Când soluția ajunge într-o stare de saturație cu sare de masă, pe pereții cupei vor apărea cristale. În acest moment, opriți încălzirea și răciți soluția. Sarea de masă răcită va ieși în evidență sub formă de cristale. Dacă este necesar, cristalele de sare pot fi separate din soluție prin filtrare. Soluția nu trebuie evaporată până când apa sa evaporat complet, deoarece și alte impurități solubile pot precipita sub formă de cristale și pot contamina sarea de masă.
Așezare, decantare
Folosit pentru a izola substanțele insolubile din lichide. sustinerea. Dacă particulele solide sunt suficient de mari, ele se așează rapid pe fund, iar lichidul devine transparent. Poate fi drenat cu grijă din sediment, iar această operațiune simplă are și propriul nume - decantare.
Cu cât solidele din lichid sunt mai mici, cu atât amestecul se va depune mai mult. Este posibil să se separe unul de celălalt și două lichide care nu se amestecă între ele.
centrifugare
Dacă particulele unui amestec neomogen sunt foarte mici, acesta nu poate fi separat nici prin decantare, nici prin filtrare. Exemple de astfel de amestecuri sunt laptele și pasta de dinți dizolvată în apă. Astfel de amestecuri sunt împărțite centrifugare. Amestecuri care conțin un astfel de lichid sunt introduse în eprubete și rotite cu viteză mare în aparate speciale - centrifuge. Ca rezultat al centrifugării, particulele mai grele sunt „presate” pe fundul vasului, iar plămânii sunt deasupra. Laptele este cele mai mici particule de grăsime distribuite într-o soluție apoasă de alte substanțe - zaharuri, proteine. Pentru a separa un astfel de amestec, se folosește o centrifugă specială numită separator. La separarea laptelui, grăsimile sunt la suprafață, sunt ușor de separat. Ceea ce rămâne este apă cu substanțe dizolvate în ea - acesta este lapte degresat.
Adsorbţie
În tehnologie, problema apare adesea a gazelor de curățare, cum ar fi aerul, de la componente nedorite sau dăunătoare. Multe substanțe au o proprietate interesantă - se pot "agăța" de suprafața substanțelor poroase, cum ar fi fierul de un magnet. Adsorbţie numită capacitatea unor solide de a absorbi substanțe gazoase sau dizolvate de pe suprafața lor. Substanțele capabile de adsorbție se numesc adsorbanți. Adsorbanții sunt substanțe solide în care există multe canale interne, goluri, pori, adică. au o suprafață totală absorbantă foarte mare. Adsorbanții sunt cărbune activ, silicagel (în cutia cu pantofi noi puteți găsi o pungă mică de mazăre albă - acesta este silicagel), hârtie de filtru. Diferite substanțe „se atașează” la suprafața adsorbanților în mod diferit: unele sunt ținute ferm pe suprafață, altele sunt mai slabe. Cărbunele activ este capabil să absoarbă nu numai gazele, ci și substanțele dizolvate în lichide. În caz de otrăvire, se ia astfel încât substanțele toxice să fie adsorbite pe acesta.
Distilare (distilare)
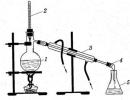
Două lichide care formează un amestec omogen, cum ar fi alcoolul etilic și apa, sunt separate prin distilare sau distilare. Această metodă se bazează pe faptul că lichidul este încălzit până la punctul de fierbere și vaporii acestuia sunt îndepărtați printr-un tub de evacuare a gazului într-un alt vas. Răcirea, vaporii se condensează, iar impuritățile rămân în balonul de distilare. Aparatul de distilare este prezentat în Fig. 2

Lichidul este plasat într-un balon Wurtz (1), gâtul balonului Wurtz este închis etanș cu un dop cu un termometru introdus în el (2), în timp ce rezervorul de mercur ar trebui să fie la nivelul orificiului tubului de evacuare. Capătul tubului de evacuare este introdus printr-un dop bine fixat în frigiderul Liebig (3), la celălalt capăt al căruia este fixat allonge (4). Capătul îngust al allonge este coborât în receptor (5). Capătul inferior al mantalei frigiderului este conectat cu un furtun de cauciuc la un robinet de apă, iar din capătul superior se realizează o scurgere în chiuvetă. Mantaua frigiderului trebuie să fie întotdeauna umplută cu apă. Balonul Wurtz și condensatorul sunt fixate în rafturi separate. Lichidul se toarnă în balon printr-o pâlnie cu tub lung, umplând balonul de distilare la 2/3 din volumul său. Pentru o fierbere uniformă, mai multe puncte de fierbere sunt plasate pe fundul balonului - capilare de sticlă sigilate la un capăt. După închiderea balonului, apă este furnizată în frigider și lichidul din balon este încălzit. Încălzirea poate fi efectuată pe un arzător cu gaz, aragaz electric, apă, nisip sau baie de ulei - în funcție de punctul de fierbere al lichidului. În niciun caz nu trebuie încălzite lichide inflamabile și combustibile (alcool, eter, acetonă etc.) la foc deschis pentru a evita accidentele: trebuie folosită doar o baie de apă sau altă baie. Lichidul nu trebuie evaporat complet: 10-15% din volumul luat inițial trebuie să rămână în balon. O nouă porțiune de lichid poate fi turnată numai când balonul s-a răcit ușor.
Congelare
Substanțele cu puncte de topire diferite sunt separate prin metodă congelare, răcirea soluției. Prin îngheț, puteți obține apă foarte curată acasă. Pentru a face acest lucru, turnați apă de la robinet într-un borcan sau cană și puneți-o în congelatorul frigiderului (sau scoateți-o la rece iarna). De îndată ce aproximativ jumătate din apă se transformă în gheață, partea neînghețată a acesteia, unde se acumulează impuritățile, trebuie să fie turnată și gheața lăsată să se topească.
În industrie și în condiții de laborator se folosesc metode de separare a amestecurilor, bazate pe alte proprietăți diferite ale părților constitutive ale amestecului. De exemplu, pilitura de fier poate fi izolată dintr-un amestec magnet. Capacitatea substanțelor de a se dizolva în diverși solvenți este utilizată în extracţie- o metodă de separare a amestecurilor solide sau lichide prin tratarea lor cu diverși solvenți. De exemplu, iodul dintr-o soluție apoasă poate fi izolat de orice solvent organic în care iodul se dizolvă mai bine.
Concluzie
În practica de laborator și în viața de zi cu zi, este foarte adesea necesară izolarea componentelor individuale dintr-un amestec de substanțe. Rețineți că amestecurile includ două sau mai multe substanțe, împărțite în două grupe mari: omogene și eterogene. Există diferite moduri de separare a amestecurilor, cum ar fi filtrarea, evaporarea, distilarea (distilarea) și altele. Metodele de separare a amestecurilor depind în principal de tipul și compoziția amestecului.
Lista literaturii folosite
1. S.Ozols, E.Lepiņš chimie pentru școala elementară., 1996. P. 289
2. Informații de pe Internet
- Reguli de lucru în laborator.
- Sticlărie și echipamente de laborator.
- Reguli de siguranță atunci când lucrați cu substanțe caustice, combustibile și toxice, substanțe chimice de uz casnic.
- Metode științifice pentru studiul substanțelor chimice și al transformărilor. Metode de separare a amestecurilor și purificare a substanțelor.
Reguli de lucru în laborator
Este strict interzis să lucrezi singur în laborator, deoarece într-o situație de accident nu va exista nimeni care să ajute victima și să elimine consecințele accidentului.
În timpul lucrului în laborator, este necesar să se respecte regulile de curățenie, liniște, ordine și siguranță, deoarece graba și neatenția duc adesea la accidente cu consecințe grave.
Fiecare lucrător trebuie să știe unde se află în laborator echipamentul de protecție împotriva incendiilor și o trusă de prim ajutor care conține tot ce este necesar pentru primul ajutor.
Nu puteți începe lucrul până când studenții nu stăpânesc toate tehnicile pentru implementarea acestuia.
Experimentele trebuie efectuate numai în sticlă chimică curată. După încheierea experimentului, vasele trebuie spălate imediat.
În procesul de lucru, este necesar să se respecte curățenia și acuratețea, asigurați-vă că substanțele nu ajung pe pielea feței și a mâinilor, deoarece multe substanțe provoacă iritații ale pielii și mucoaselor.
Nicio substanță din laborator nu poate fi gustată. Poți adulmeca substanțele doar îndreptând cu atenție vaporii sau gazele către tine cu o mișcare ușoară a mâinii și nu aplecându-te spre vas și neinhalând profund.
Orice recipient în care sunt depozitați reactivii trebuie să fie etichetat cu numele substanțelor.
Vasele cu substanțe sau soluții trebuie luate cu o mână de gât, iar cu cealaltă, de jos, sprijină fundul.
Când încălziți substanțe lichide și solide în eprubete și baloane, nu îndreptați orificiile acestora către dvs. și către vecini. De asemenea, este imposibil să priviți de sus în vasele încălzite în mod deschis pentru a evita posibile daune atunci când o masă fierbinte este ejectată.
După terminarea lucrărilor, opriți gazul, apa, curentul.
Este strict interzisă turnarea în chiuvete de soluții concentrate de acizi și alcaline, precum și diverși solvenți organici, substanțe cu miros puternic și inflamabile. Toate aceste deșeuri trebuie turnate în sticle speciale.
Fiecare laborator trebuie să aibă măști și ochelari de protecție.
În fiecare încăpere a laboratorului este necesar să existe echipament de protecție împotriva incendiilor: o cutie cu nisip cernut și o linguriță pentru acesta, o pătură de foc (azbest sau pâslă groasă), stingătoare încărcate.
Reguli de siguranță atunci când lucrați cu substanțe caustice, combustibile și toxice, substanțe chimice de uz casnic
Pentru a accelera dizolvarea solidelor în eprubetă, nu acoperiți deschiderea acesteia cu degetul în timp ce agitați.
Dizolvarea alcalinelor trebuie efectuată în vase de porțelan prin adăugarea unor porțiuni mici de substanță în apă, cu agitare continuă.
Când determinați mirosul unei substanțe, nu vă aplecați peste ea, nu inhalați vaporii sau gazul eliberat. Este necesar să direcționați aburul sau gazul către nas cu o mișcare ușoară a mâinii peste gâtul vasului și să inspirați cu atenție.
Acidul sau alcaliul vărsat trebuie acoperit cu nisip curat și uscat și amestecat până când tot lichidul este complet absorbit. Îndepărtați nisipul umed cu o linguriță într-un vas larg de sticlă pentru spălare și neutralizare ulterioară.
Soluțiile din sticle reactive trebuie turnate astfel încât atunci când sunt înclinate, eticheta să fie deasupra (eticheta să fie în palma mâinii). Dacă soluțiile de alcali sau acizi intră în contact cu pielea, spălați-le după agitarea picăturilor vizibile cu un jet puternic de apă rece și apoi tratați cu o soluție neutralizantă (soluție de acid acetic 2% sau soluție de bicarbonat de sodiu 2%) și clătiți cu apă.
Metode de separare a amestecurilor și purificare a substanțelor. Substanțe pure și amestecuri substante
Un amestec este un material format din două sau mai multe substanțe alternând aleatoriu între ele în spațiu.
O substanță pură este un material omogen fizic și chimic, cu un anumit set de proprietăți constante. Conținutul de impurități din preparatele de înaltă puritate este măsurat în milionimi și miliarde de procente.
Amestecuri |
|
| Omogen (omogen) | eterogen (eterogen) |
| Amestecuri omogene sunt astfel de amestecuri în care particulele nu pot fi detectate nici vizual, nici cu ajutorul instrumentelor optice, deoarece substanțele sunt într-o stare fragmentată la nivel micro. | Amestecuri neomogene sunt cele în care particulele pot fi detectate fie vizual, fie cu ajutorul instrumentelor optice. Mai mult, aceste substanțe se află în diferite stări de agregare (faze) |
| Exemple de amestecuri | |
| Soluții adevărate (sare de masă + apă, o soluție de alcool în apă) | Suspensii (solide + lichide), de exemplu apă + nisip |
| Soluții solide, aliaje, de exemplu alamă, bronz. | Emulsii (lichid + lichid), de exemplu apă + grăsime |
| Soluții gazoase (amestecuri de orice cantitate și orice număr de gaze) | Aerosoli (gaz + lichid), de exemplu ceață |
Decantarea este o metodă bazată pe diferitele densități ale substanțelor.
De exemplu, un amestec de ulei vegetal și apă poate fi separat în ulei și apă, pur și simplu lăsând amestecul să se depună.
Filtrarea este o metodă bazată pe capacitatea diferită a filtrului de a trece substanțele care alcătuiesc amestecul. De exemplu, cu ajutorul unui filtru, impuritățile solide pot fi separate dintr-un lichid.
Evaporarea este separarea solidelor nevolatile dintr-o soluție într-un solvent volatil - în special apă. De exemplu, pentru a izola sarea dizolvată în apă, trebuie doar să evaporați apa. Apa se va evapora si sarea va ramane.




bloc teoretic.
Conceptul de „amestec” a fost definit în secolul al XVII-lea. Omul de știință englez Robert Boyle: „Un amestec este un sistem integral format din componente eterogene.”
Caracteristicile comparative ale unui amestec și ale unei substanțe pure
Semne de comparație | substanta pura | Amestec |
Constant | nestatornic |
|
Substanțe | La fel | Variat |
Proprietăți fizice | Permanent | Nestatornic |
Modificarea energiei în timpul formării | merge mai departe | Nu se intampla |
Separare | Prin reacții chimice | Metode fizice |
Amestecuri diferă unele de altele ca aspect.
Clasificarea amestecurilor este prezentată în tabel:
Iată exemple de suspensii (nisip de râu + apă), emulsii (ulei vegetal + apă) și soluții (aer într-un balon, sare + apă, mică schimbare: aluminiu + cupru sau nichel + cupru).
Metode de separare a amestecurilor
În natură, substanțele există sub formă de amestecuri. Pentru cercetarea de laborator, producția industrială, pentru nevoile de farmacologie și medicină sunt necesare substanțe pure.
Pentru purificarea substanțelor se folosesc diferite metode de separare a amestecurilor.
Evaporare - separarea solidelor dizolvate într-un lichid prin transformarea acestuia în vapori.

Distilare- distilare, separarea substanţelor conţinute în amestecurile lichide în funcţie de punctele de fierbere, urmată de răcirea vaporilor.
În natură, apa în formă pură (fără săruri) nu apare. Apa oceanică, de mare, de râu, de fântână și de izvor sunt varietăți de soluții sărate în apă. Cu toate acestea, de multe ori oamenii au nevoie de apă curată, care nu conține săruri (folosită la motoarele de mașini; în producția chimică pentru a obține diverse soluții și substanțe; la fabricarea fotografiilor). O astfel de apă se numește distilată, iar metoda de obținere a acesteia se numește distilare.

Filtrarea este filtrarea lichidelor (gazelor) printr-un filtru pentru a le purifica de impuritățile solide.

Aceste metode se bazează pe diferențele dintre proprietățile fizice ale componentelor amestecului.
Luați în considerare modalități de separare eterogenși amestecuri omogene.
Exemplu de amestec | Metoda de separare |
Suspensie - un amestec de nisip de râu cu apă | aşezându-se Separare sustinerea bazate pe diferite densităţi de substanţe. Nisipul mai greu se depune pe fund. De asemenea, puteți separa emulsia: pentru a separa uleiul sau uleiul vegetal de apă. În laborator, acest lucru se poate face folosind o pâlnie de separare. Uleiul sau uleiul vegetal formează stratul superior, mai ușor. Ca urmare a depunerii, roua cade din ceață, funinginea se depune din fum, smântâna se depune în lapte. Separarea unui amestec de apă și ulei vegetal prin decantare |
Un amestec de nisip și sare de masă în apă | Filtrare Care este baza pentru separarea amestecurilor eterogene folosind filtrare• Pe diferite solubilitate a substanțelor în apă și pe diferite dimensiuni ale particulelor. Doar particulele de substanțe proporționale cu acestea trec prin porii filtrului, în timp ce particulele mai mari sunt reținute pe filtru. Astfel, puteți separa un amestec eterogen de sare de masă și nisip de râu. Ca filtre pot fi folosite diverse substanțe poroase: vată, cărbune, argilă arsă, sticlă presată și altele. Metoda de filtrare este baza pentru funcționarea aparatelor de uz casnic, cum ar fi aspiratoarele. Este folosit de chirurgi - bandaje de tifon; foratori si muncitori de lifturi - masti respiratorii. Cu ajutorul unei strecurătoare de ceai pentru filtrarea frunzelor de ceai, Ostap Bender, eroul lucrării lui Ilf și Petrov, a reușit să ia unul dintre scaunele de la Ellochka Ogre („Cele douăsprezece scaune”). Separarea unui amestec de amidon și apă prin filtrare |
Un amestec de pulbere de fier și sulf | Acțiune prin magnet sau apă Pulberea de fier era atrasă de un magnet, dar pulberea de sulf nu. Pulberea de sulf neumezibilă a plutit la suprafața apei, în timp ce pulberea grea de fier umectabilă s-a depus pe fund. Separarea unui amestec de sulf și fier folosind un magnet și apă |
O soluție de sare în apă este un amestec omogen | Evaporare sau cristalizare Apa se evaporă, iar cristalele de sare rămân în cana de porțelan. Când apa este evaporată din lacurile Elton și Baskunchak, se obține sare de masă. Această metodă de separare se bazează pe diferența dintre punctele de fierbere ale solventului și ale solutului. Dacă o substanță, cum ar fi zahărul, se descompune atunci când este încălzită, atunci apa nu este complet evaporată - soluția este evaporată, iar apoi cristalele de zahăr sunt precipitate dintr-o soluție saturată. Uneori este necesară îndepărtarea impurităților din solvenți cu un punct de fierbere mai scăzut, de exemplu, apa din sare. În acest caz, vaporii substanței trebuie colectați și apoi condensați la răcire. Această metodă de separare a unui amestec omogen se numește distilare sau distilare. În dispozitivele speciale - distilatoare, se obține apă distilată, care este utilizată pentru nevoile de farmacologie, laboratoare și sisteme de răcire a mașinilor. Acasă, puteți proiecta un astfel de distilator: Dacă, totuși, se separă un amestec de alcool și apă, atunci primul care este distilat (colectat într-o eprubetă receptoare) este alcoolul cu fierbere = 78 °C, iar apa va rămâne în eprubetă. Distilarea este folosită pentru a obține benzină, kerosen, motorină din petrol. Separarea amestecurilor omogene |
O metodă specială de separare a componentelor, bazată pe absorbția lor diferită de către o anumită substanță, este cromatografia.
Folosind cromatografia, botanistul rus a fost primul care a izolat clorofila din părțile verzi ale plantelor. În industrie și laboratoare, în loc de hârtie de filtru pentru cromatografie, se utilizează amidon, cărbune, calcar și oxid de aluminiu. Sunt întotdeauna necesare substanțe cu același grad de purificare?
Pentru scopuri diferite, sunt necesare substanțe cu grade diferite de purificare. Apa de gatit este suficient de decantata pentru a indeparta impuritatile si clorul folosit pentru a o dezinfecta. Apa de băut trebuie mai întâi fiartă. Iar în laboratoarele chimice pentru prepararea soluțiilor și experimentelor, în medicină este nevoie de apă distilată, cât mai purificată din substanțele dizolvate în ea. Substanțele foarte pure, cu conținutul de impurități în care nu depășește o milioneme dintr-o sută, sunt utilizate în electronică, semiconductori, tehnologie nucleară și alte industrii de precizie.
Metode de exprimare a compoziției amestecurilor.
· Fracția de masă a componentului din amestec- raportul dintre masa componentului și masa întregului amestec. De obicei, fracția de masă este exprimată în %, dar nu neapărat.
ω ["omega"] = mcomponent / mmixture
· Fracția molară a unui component dintr-un amestec- raportul dintre numărul de moli (cantitatea de substanță) ai componentului și numărul total de moli ai tuturor substanțelor din amestec. De exemplu, dacă amestecul include substanțele A, B și C, atunci:
χ [„chi”] componenta A \u003d n componenta A / (n (A) + n (B) + n (C))
· Raportul molar al componentelor. Uneori, în sarcinile pentru un amestec, este indicat raportul molar al componentelor sale. De exemplu:
ncomponent A: ncomponent B = 2: 3
· Fracția de volum a componentului din amestec (doar pentru gaze)- raportul dintre volumul substanței A și volumul total al întregului amestec de gaze.
φ ["phi"] = Vcomponent / Vmixture
Bloc de practică.
Luați în considerare trei exemple de probleme cu care reacționează amestecurile de metale clorhidric acid:
Exemplul 1Când un amestec de cupru și fier cu o greutate de 20 g a fost expus la un exces de acid clorhidric, s-au eliberat 5,6 litri de gaz (n.a.). Determinați fracțiile de masă ale metalelor din amestec.
În primul exemplu, cuprul nu reacționează cu acidul clorhidric, adică hidrogenul este eliberat atunci când acidul reacționează cu fierul. Astfel, cunoscând volumul hidrogenului, putem afla imediat cantitatea și masa fierului. Și, în consecință, fracțiunile de masă ale substanțelor din amestec.
Exemplul 1 soluție.
n \u003d V / Vm \u003d 5,6 / 22,4 \u003d 0,25 mol.
2. Conform ecuației reacției:
3. Cantitatea de fier este de asemenea de 0,25 mol. Puteți găsi masa acestuia:
mFe = 0,25 56 = 14 g.
Răspuns: 70% fier, 30% cupru.
Exemplul 2Sub acțiunea unui exces de acid clorhidric asupra unui amestec de aluminiu și fier cu o greutate de 11 g, s-au eliberat 8,96 litri de gaz (n.a.). Determinați fracțiile de masă ale metalelor din amestec.
În al doilea exemplu, reacția este ambii metal. Aici, hidrogenul este deja eliberat din acid în ambele reacții. Prin urmare, calculul direct nu poate fi utilizat aici. În astfel de cazuri, este convenabil să se rezolve folosind un sistem foarte simplu de ecuații, luând pentru x - numărul de moli ai unuia dintre metale și pentru y - cantitatea de substanță a celui de-al doilea.
Exemplul 2 soluție.
1. Aflați cantitatea de hidrogen:
n \u003d V / Vm \u003d 8,96 / 22,4 \u003d 0,4 mol.
2. Fie cantitatea de aluminiu x mol, iar fierul y mol. Apoi putem exprima în termeni de x și y cantitatea de hidrogen eliberată:
2HCl = FeCl2 + |
4. Cunoaștem cantitatea totală de hidrogen: 0,4 mol. Mijloace,
1,5x + y = 0,4 (aceasta este prima ecuație din sistem).
5. Pentru un amestec de metale, trebuie să exprimi mase prin cantităţi de substanţe.
m = Mn
Deci masa aluminiului
mAl = 27x,
masa de fier
mFe = 56y,
și masa întregului amestec
27x + 56y = 11 (aceasta este a doua ecuație din sistem).
6. Deci, avem un sistem de două ecuații:
7. Este mult mai convenabil să rezolvi astfel de sisteme folosind metoda scăderii, înmulțind prima ecuație cu 18:
27x + 18y = 7,2
și scăzând prima ecuație din a doua:
8. (56 - 18) și \u003d 11 - 7.2
y \u003d 3,8 / 38 \u003d 0,1 mol (Fe)
x = 0,2 mol (Al)
mFe = n M = 0,1 56 = 5,6 g
mAl = 0,2 27 = 5,4 g
ωFe = mFe / mmixture = 5,6 / 11 = 0,50,91%),
respectiv,
ωAl \u003d 100% - 50,91% \u003d 49,09%
Răspuns: 50,91% fier, 49,09% aluminiu.
Exemplul 316 g dintr-un amestec de zinc, aluminiu și cupru au fost tratate cu un exces de soluție de acid clorhidric. În acest caz, s-au eliberat 5,6 litri de gaz (n.a.) și 5 g de substanță nu s-au dizolvat. Determinați fracțiile de masă ale metalelor din amestec.
În al treilea exemplu, două metale reacționează, dar al treilea metal (cuprul) nu reacționează. Prin urmare, restul de 5 g este masa cuprului. Cantitățile celor două metale rămase - zinc și aluminiu (rețineți că masa lor totală este 16 - 5 = 11 g) pot fi găsite folosind un sistem de ecuații, ca în exemplul nr. 2.
Răspuns la Exemplul 3: 56,25% zinc, 12,5% aluminiu, 31,25% cupru.
Exemplul 4Un amestec de fier, aluminiu și cupru a fost tratat cu un exces de acid sulfuric concentrat la rece. În același timp, o parte din amestec s-a dizolvat și s-au eliberat 5,6 litri de gaz (n.a.). Amestecul rămas a fost tratat cu un exces de soluţie de hidroxid de sodiu. Au degajat 3,36 litri de gaz și au rămas 3 g de reziduu nedizolvat. Determinați masa și compoziția amestecului inițial de metale.
În acest exemplu, amintiți-vă că concentrat la rece acidul sulfuric nu reacționează cu fierul și aluminiul (pasivare), ci reacționează cu cuprul. În acest caz, se eliberează oxid de sulf (IV).
Cu alcali reactioneaza numai aluminiu- metal amfoter (pe lângă aluminiu, zincul și staniul se dizolvă și în alcalii, iar beriliul poate fi încă dizolvat în alcalii concentrate fierbinți).
Exemplul 4 soluție.
1. Doar cuprul reacţionează cu acidul sulfuric concentrat, numărul de moli de gaz:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
2H2SO4 (conc.) = CuSO4 + |
2. (nu uitați că astfel de reacții trebuie egalizate folosind o balanță electronică)
3. Deoarece raportul molar dintre cupru și dioxid de sulf este de 1:1, atunci cuprul este de asemenea 0,25 mol. Puteți găsi masa cuprului:
mCu \u003d n M \u003d 0,25 64 \u003d 16 g.
4. Aluminiul reacționează cu o soluție alcalină și se formează un hidroxocomplex de aluminiu și hidrogen:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Numărul de moli de hidrogen:
nH2 = 3,36 / 22,4 = 0,15 mol,
raportul molar dintre aluminiu și hidrogen este de 2:3 și, prin urmare,
nAl = 0,15 / 1,5 = 0,1 mol.
Greutate aluminiu:
mAl \u003d n M \u003d 0,1 27 \u003d 2,7 g
6. Restul este fier, cântărind 3 g. Puteți găsi masa amestecului:
mmix \u003d 16 + 2,7 + 3 \u003d 21,7 g.
7. Fracții de masă ale metalelor:
ωCu = mCu / mmixture = 16 / 21,7 = 0,7,73%)
ωAl = 2,7 / 21,7 = 0,1,44%)
ωFe = 13,83%
Răspuns: 73,73% cupru, 12,44% aluminiu, 13,83% fier.
Exemplul 521,1 g dintr-un amestec de zinc şi aluminiu au fost dizolvate în 565 ml de soluţie de acid azotic conţinând 20 gr. % HNO3 și având o densitate de 1,115 g/ml. Volumul gazului eliberat, care este o substanță simplă și singurul produs al reducerii acidului azotic, a fost de 2.912 l (n.a.). Determinați compoziția soluției rezultate în procente de masă. (RCTU)
Textul acestei probleme indică clar produsul reducerii azotului - „substanță simplă”. Deoarece acidul azotic nu produce hidrogen cu metalele, este azot. Ambele metale dizolvate în acid.
Problema se referă nu la compoziția amestecului inițial de metale, ci la compoziția soluției obținute în urma reacțiilor. Acest lucru face sarcina mai dificilă.
Exemplul 5 soluție.
1. Determinați cantitatea de substanță gazoasă:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
2. Determinați masa soluției de acid azotic, masa și cantitatea de substanță HNO3 dizolvată:
m rezoluție \u003d ρ V \u003d 1,115 565 \u003d 630,3 g
mHNO3 = ω msoluție = 0,2 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mol
Vă rugăm să rețineți că, deoarece metalele s-au dizolvat complet, înseamnă - doar suficient acid(aceste metale nu reactioneaza cu apa). În consecință, va fi necesar să se verifice Există prea mult acid?, și cât de mult rămâne după reacție în soluția rezultată.
3. Compuneți ecuații de reacție ( nu uita de balanta electronica) și, pentru comoditatea calculelor, luăm pentru 5x - cantitatea de zinc și pentru 10y - cantitatea de aluminiu. Apoi, în conformitate cu coeficienții din ecuații, azotul în prima reacție va fi x mol, iar în a doua - 3y mol:
12HNO3 = 5Zn(NO3)2+ |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3+ |
Al0 − 3e = Al3+ | ||
5. Atunci, având în vedere că masa amestecului de metale este de 21,1 g, masele lor molare sunt de 65 g/mol pentru zinc și 27 g/mol pentru aluminiu, obținem următorul sistem de ecuații:
6. Este convenabil să rezolvi acest sistem înmulțind prima ecuație cu 90 și scăzând prima ecuație din a doua.
7. x \u003d 0,04, ceea ce înseamnă nZn \u003d 0,04 5 \u003d 0,2 mol
y \u003d 0,03, ceea ce înseamnă că nAl \u003d 0,03 10 \u003d 0,3 mol
8. Verificați masa amestecului:
0,2 65 + 0,3 27 \u003d 21,1 g.
9. Acum să trecem la compoziția soluției. Va fi convenabil să rescrieți din nou reacțiile și să scrieți peste reacții cantitățile tuturor substanțelor reacţionate și formate (cu excepția apei):
10. Următoarea întrebare este: acid azotic a rămas în soluție și cât a mai rămas?
Conform ecuațiilor de reacție, cantitatea de acid care a reacționat:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
adică acidul a fost în exces și puteți calcula restul său în soluție:
nHNO3res. \u003d 2 - 1,56 \u003d 0,44 mol.
11. Deci, în Soluție finală contine:
azotat de zinc în cantitate de 0,2 mol:
mZn(NO3)2 = n M = 0,2 189 = 37,8 g
azotat de aluminiu în cantitate de 0,3 mol:
mAl(NO3)3 = n M = 0,3 213 = 63,9 g
un exces de acid azotic în cantitate de 0,44 mol:
mHNO3res. = n M = 0,44 63 = 27,72 g
12. Care este masa soluției finale?
Amintiți-vă că masa soluției finale este formată din acele componente pe care le-am amestecat (soluții și substanțe) minus acei produși de reacție care au părăsit soluția (precipitate și gaze):
13.
Apoi, pentru sarcina noastră:
14. nou soluție \u003d masa soluție acidă + masa aliajului metalic - masa azotului
mN2 = n M = 28 (0,03 + 0,09) = 3,36 g
nou soluție \u003d 630,3 + 21,1 - 3,36 \u003d 648,04 g
ωZn(NO3)2 \u003d mv-va / mr-ra \u003d 37,8 / 648,04 \u003d 0,0583
ωAl(NO3)3 \u003d mv-va / mr-ra \u003d 63,9 / 648,04 \u003d 0,0986
ωHNO3res. \u003d mv-va / mr-ra \u003d 27,72 / 648,04 \u003d 0,0428
Răspuns: 5,83% azotat de zinc, 9,86% azotat de aluminiu, 4,28% acid azotic.
Exemplul 6La prelucrarea a 17,4 g dintr-un amestec de cupru, fier și aluminiu cu un exces de acid azotic concentrat, s-au eliberat 4,48 litri de gaz (n.a.), iar când acest amestec a fost expus la aceeași masă de acid clorhidric în exces, 8,96 l de gaz. (n.a.). u.). Determinați compoziția amestecului inițial. (RCTU)
Când rezolvăm această problemă, trebuie să ne amintim, în primul rând, că acidul azotic concentrat cu un metal inactiv (cuprul) dă NO2, în timp ce fierul și aluminiul nu reacţionează cu el. Acidul clorhidric, pe de altă parte, nu reacționează cu cuprul.
Răspuns de exemplu 6: 36,8% cupru, 32,2% fier, 31% aluminiu.
Sarcini pentru soluție independentă.
1. Probleme simple cu două componente ale amestecului.
1-1. Un amestec de cupru și aluminiu cântărind 20 g a fost tratat cu o soluție 96% de acid azotic și s-au eliberat 8,96 litri de gaz (n.a.). Determinați fracția de masă a aluminiului din amestec.
1-2. Un amestec de cupru și zinc cântărind 10 g a fost tratat cu o soluție alcalină concentrată. În acest caz, au fost eliberați 2,24 litri de gaz (n. a.). Calculați fracția de masă a zincului din amestecul inițial.
1-3. Un amestec de magneziu și oxid de magneziu cântărind 6,4 g a fost tratat cu o cantitate suficientă de acid sulfuric diluat. Totodată, au fost eliberați 2,24 litri de gaz (n.a.). Găsiți fracția de masă a magneziului din amestec.
1-4. Un amestec de zinc și oxid de zinc cântărind 3,08 g a fost dizolvat în acid sulfuric diluat. S-a obţinut sulfat de zinc cu o greutate de 6,44 g. Calculaţi fracţia de masă a zincului din amestecul iniţial.
1-5. Sub acțiunea unui amestec de pulberi de fier și zinc cu o greutate de 9,3 g pe un exces de soluție de clorură de cupru (II), s-au format 9,6 g de cupru. Determinați compoziția amestecului inițial.
1-6. Ce masă de soluție de acid clorhidric 20% va fi necesară pentru a dizolva complet 20 g dintr-un amestec de zinc cu oxid de zinc, dacă în acest caz se eliberează hidrogen cu un volum de 4,48 litri (n.a.)?
1-7. Când sunt dizolvate în acid azotic diluat, 3,04 g dintr-un amestec de fier și cupru eliberează oxid azotic (II) cu un volum de 0,896 l (n.a.). Determinați compoziția amestecului inițial.
1-8. La dizolvarea a 1,11 g dintr-un amestec de pilitură de fier și aluminiu într-o soluție de acid clorhidric 16% (ρ = 1,09 g / ml), s-au eliberat 0,672 litri de hidrogen (n.a.). Aflați fracțiunile de masă ale metalelor din amestec și determinați volumul de acid clorhidric consumat.
2. Sarcinile sunt mai complexe.
2-1. Un amestec de calciu și aluminiu cântărind 18,8 g a fost calcinat fără acces la aer cu un exces de pulbere de grafit. Produsul de reacție a fost tratat cu acid clorhidric diluat și s-au eliberat 11,2 litri de gaz (n.a.). Determinați fracțiile de masă ale metalelor din amestec.
2-2. Pentru a dizolva 1,26 g dintr-un aliaj de magneziu cu aluminiu, s-au folosit 35 ml de soluție de acid sulfuric 19,6% (ρ = 1,1 g/ml). Excesul de acid a reacţionat cu 28,6 ml de soluţie de carbonat acid de potasiu 1,4 mol/L. Determinați fracțiunile de masă ale metalelor din aliaj și volumul de gaz (n.a.) eliberat în timpul dizolvării aliajului.
Fiecare substanță conține impurități. O substanță este considerată pură dacă aproape că nu conține impurități.
Amestecurile de substanțe sunt fie omogene, fie eterogene. Într-un amestec omogen, componentele nu pot fi detectate prin observație, dar într-un amestec neomogen este posibil.
Unele proprietăți fizice ale unui amestec omogen diferă de cele ale componentelor.
Într-un amestec eterogen, proprietățile componentelor sunt păstrate.
Amestecurile neomogene de substanțe se separă prin decantare, filtrare, uneori prin acțiunea unui magnet, iar amestecurile omogene se separă prin evaporare și distilare (distilare).
Substanțe pure și amestecuri
Trăim printre chimicale. Inspirăm aer, iar acesta este un amestec de gaze (azot, oxigen și altele), expirăm dioxid de carbon. Ne spălăm cu apă - aceasta este o altă substanță, cea mai comună de pe Pământ. Bem lapte - un amestec de apă cu cele mai mici picături de grăsime din lapte, și nu numai: există și proteine din lapte de cazeină, săruri minerale, vitamine și chiar zahăr, dar nu cea cu care se bea ceai, ci un lapte special - lactoză. Mâncăm mere, care constau dintr-o gamă întreagă de substanțe chimice - zahăr, acid malic, vitamine... măr, dar și orice alt aliment. Nu numai că trăim printre substanțe chimice, dar și noi înșine suntem făcuți din ele. Fiecare persoană - pielea, mușchii, sângele, dinții, oasele, părul lui sunt construite din substanțe chimice, ca o casă de cărămizi. Azotul, oxigenul, zahărul, vitaminele sunt substanțe de origine naturală, naturală. Sticla, cauciucul, otelul sunt si ele substante, mai exact, materiale (amestecuri de substante). Atât sticla, cât și cauciucul sunt de origine artificială; nu au existat în natură. Substanțele complet pure nu se găsesc în natură sau sunt foarte rare.
Fiecare substanță conține întotdeauna o anumită cantitate de impurități. O substanță care nu conține aproape nicio impuritate se numește pură. Ei lucrează cu astfel de substanțe într-un laborator științific, o sală de chimie a școlii. Rețineți că substanțele absolut pure nu există.
O substanță pură individuală are un anumit set de proprietăți caracteristice (proprietăți fizice constante). Doar apa distilată pură se topește = 0 °С, se fierbe = 100 °С și nu are gust. Apa de mare îngheață la o temperatură mai scăzută și fierbe la o temperatură mai mare, gustul ei este amar-sărat. Apa Mării Negre îngheață la o temperatură mai scăzută și fierbe la o temperatură mai mare decât apa Mării Baltice. De ce? Faptul este că apa de mare conține și alte substanțe, de exemplu, săruri dizolvate, adică. este un amestec de diverse substanțe, a căror compoziție variază într-o gamă largă, dar proprietățile amestecului nu sunt constante. Conceptul de „amestec” a fost definit în secolul al XVII-lea. Omul de știință englez Robert Boyle: „Un amestec este un sistem integral format din componente eterogene”.
Aproape toate substanțele naturale, produsele alimentare (cu excepția sării, zahărului și a altora), multe produse medicinale și cosmetice, substanțe chimice de uz casnic și materiale de construcție sunt amestecuri.
Caracteristicile comparative ale unui amestec și ale unei substanțe pure
Fiecare substanță conținută într-un amestec se numește componentă.
Clasificarea amestecurilor
Există amestecuri omogene și eterogene.
Amestecuri omogene (omogene)
Adăugați o porție mică de zahăr într-un pahar cu apă și amestecați până se dizolvă tot zahărul. Lichidul va avea gust dulce. Astfel, zahărul nu a dispărut, ci a rămas în amestec. Ho, nu îi vom vedea cristalele, chiar și atunci când examinăm o picătură de lichid într-un microscop puternic. Amestecul preparat de zahăr și apă este omogen; cele mai mici particule din aceste substanțe sunt amestecate uniform în el.
Amestecuri în care componentele nu pot fi detectate prin observare se numesc omogene.
Majoritatea aliajelor metalice sunt, de asemenea, amestecuri omogene. De exemplu, un aliaj de aur și cupru (folosit pentru a face bijuterii) nu are particule de cupru roșu și particule de aur galben.
Din materiale care sunt amestecuri omogene de substanțe, sunt realizate multe articole pentru diverse scopuri.
Toate amestecurile de gaze, inclusiv aerul, aparțin amestecurilor omogene. Există multe amestecuri omogene de lichide.
Amestecuri omogene se mai numesc si solutii, chiar daca sunt solide sau gazoase.
Să dăm exemple de soluții (aer într-un balon, sare de masă + apă, schimbare mică: aluminiu + cupru sau nichel + cupru).
Amestecuri eterogene (eterogene)
Știți că creta nu se dizolvă în apă. Dacă pulberea sa este turnată într-un pahar cu apă, atunci particulele de cretă pot fi întotdeauna găsite în amestecul rezultat, care sunt vizibile cu ochiul liber sau printr-un microscop.
Amestecuri în care componentele pot fi detectate prin observare sunt numite eterogene.
Amestecuri eterogene includ majoritatea mineralelor, solul, materialele de construcție, țesuturile vii, apa tulbure, laptele și alte alimente, unele medicamente și produse cosmetice.
Într-un amestec eterogen, proprietățile fizice ale componentelor sunt păstrate. Deci, pilitura de fier amestecată cu cupru sau aluminiu nu își pierd capacitatea de a fi atrase de un magnet.
Unele tipuri de amestecuri eterogene au denumiri speciale: spumă (de exemplu, spumă, spumă de săpun), suspensie (un amestec de apă cu o cantitate mică de făină), emulsie (lapte, ulei vegetal bine agitat cu apă), aerosol (fum , ceață).
Metode de separare a amestecurilor
În natură, substanțele există sub formă de amestecuri. Pentru cercetarea de laborator, producția industrială, pentru nevoile de farmacologie și medicină sunt necesare substanțe pure.
Există multe metode de separare a amestecurilor. Ele sunt alese luând în considerare tipul de amestec, starea de agregare și diferențele în proprietățile fizice ale componentelor.
Metode de separare a amestecurilor

Aceste metode se bazează pe diferențele dintre proprietățile fizice ale componentelor amestecului.
Luați în considerare metode de separare a amestecurilor eterogene și omogene.
Exemplu de amestec |
Metoda de separare |
Suspensie - un amestec de nisip de râu cu apă |
aşezându-se Separarea prin decantare se bazează pe diferite densități ale substanțelor. Nisipul mai greu se depune pe fund. De asemenea, puteți separa emulsia: pentru a separa uleiul sau uleiul vegetal de apă. În laborator, acest lucru se poate face folosind o pâlnie de separare. Uleiul sau uleiul vegetal formează stratul superior, mai ușor. Ca urmare a depunerii, roua cade din ceață, funinginea se depune din fum, smântâna se depune în lapte. |
Un amestec de nisip și sare de masă în apă |
Filtrare Separarea amestecurilor eterogene prin filtrare se bazează pe solubilitatea diferită a substanțelor în apă și pe diferite dimensiuni ale particulelor. Doar particulele de substanțe proporționale cu acestea trec prin porii filtrului, în timp ce particulele mai mari sunt reținute pe filtru. Astfel, puteți separa un amestec eterogen de sare de masă și nisip de râu. Ca filtre pot fi folosite diverse substanțe poroase: vată, cărbune, argilă arsă, sticlă presată și altele. Metoda de filtrare este baza pentru funcționarea aparatelor de uz casnic, cum ar fi aspiratoarele. Este folosit de chirurgi - bandaje de tifon; foratori si muncitori de lifturi - masti respiratorii. Cu ajutorul unei strecurătoare de ceai pentru filtrarea frunzelor de ceai, Ostap Bender - eroul lucrării lui Ilf și Petrov - a reușit să ia unul dintre scaunele de la Ellochka Ogre ("Cele douăsprezece scaune"). |
Un amestec de pulbere de fier și sulf |
Acțiune prin magnet sau apă Pulberea de fier era atrasă de un magnet, dar pulberea de sulf nu. Pulberea de sulf neumezibilă a plutit la suprafața apei, în timp ce pulberea grea de fier umectabilă s-a depus pe fund. |
O soluție de sare în apă este un amestec omogen |
Evaporare sau cristalizare Apa se evaporă, iar cristalele de sare rămân în cana de porțelan. Când apa este evaporată din lacurile Elton și Baskunchak, se obține sare de masă. Această metodă de separare se bazează pe diferența dintre punctele de fierbere ale solventului și ale solutului. Dacă o substanță, cum ar fi zahărul, se descompune atunci când este încălzită, atunci apa nu este complet evaporată - soluția este evaporată, iar apoi cristalele de zahăr sunt precipitate dintr-o soluție saturată. Uneori este necesară îndepărtarea impurităților din solvenți cu un punct de fierbere mai scăzut, de exemplu, apa din sare. În acest caz, vaporii substanței trebuie colectați și apoi condensați la răcire. Această metodă de separare a unui amestec omogen se numește distilare sau distilare. În dispozitivele speciale - distilatoare, se obține apă distilată, care este utilizată pentru nevoile de farmacologie, laboratoare și sisteme de răcire a mașinilor. Acasă, puteți proiecta un astfel de distilator. Dacă, totuși, se separă un amestec de alcool și apă, atunci primul care este distilat (colectat într-o eprubetă receptoare) este alcoolul cu fierbere = 78 °C, iar apa va rămâne în eprubetă. Distilarea este folosită pentru a obține benzină, kerosen, motorină din petrol. |
Cromatografia este o metodă specială de separare a componentelor pe baza absorbției lor diferite de către o anumită substanță.
Dacă atârnați o bandă de hârtie de filtru peste un vas cu cerneală roșie, scufundând în ele doar capătul benzii. Soluția este absorbită de hârtie și se ridică de-a lungul acesteia. Dar marginea creșterii vopselei rămâne în urma limitei creșterii apei. Așa are loc separarea a două substanțe: apa și materia colorantă din cerneală.
Cu ajutorul cromatografiei, botanistul rus M. S. Tsvet a fost primul care a izolat clorofila din părțile verzi ale plantelor. În industrie și laboratoare, în loc de hârtie de filtru pentru cromatografie, se utilizează amidon, cărbune, calcar și oxid de aluminiu. Sunt întotdeauna necesare substanțe cu același grad de purificare?
Pentru scopuri diferite, sunt necesare substanțe cu grade diferite de purificare. Apa de gatit este suficient de decantata pentru a indeparta impuritatile si clorul folosit pentru a o dezinfecta. Apa de băut trebuie mai întâi fiartă. Iar în laboratoarele chimice pentru prepararea soluțiilor și experimentelor, în medicină este nevoie de apă distilată, cât mai purificată din substanțele dizolvate în ea. Substanțele foarte pure, cu conținutul de impurități în care nu depășește o milioneme dintr-o sută, sunt utilizate în electronică, semiconductori, tehnologie nucleară și alte industrii de precizie.
1. Completați golurile din text folosind cuvintele „componente”, „diferențe”, „două”, „fizic”.
Un amestec poate fi preparat prin amestecarea a cel puțin două substanțe. Amestecurile pot fi separate în componente individuale folosind metode fizice bazate pe diferențele dintre proprietățile fizice ale componentelor.
2. Completați propozițiile.
a) Metoda de decontare se bazează pe Faptul că particulele solide sunt suficient de mari, se depun rapid în fund, iar lichidul poate fi scurs cu grijă din sediment.
b) Metoda de centrifugare se bazează pe acțiunea forței centrifuge - particulele mai grele se depun, iar cele ușoare sunt deasupra.
c) Metoda de filtrare se bazează pe trecerea unei soluții de solid printr-un filtru, unde particulele solide sunt reținute pe filtru.
3. Introduceți un cuvânt lipsă:
a) făină și zahăr granulat - o sită; sulf și pilitură de fier - un magnet.
b) apa si ulei de floarea soarelui - pâlnie de separare; apă și nisip de râu - filtru.
c) aer și praf - respirator; aer și gaz otrăvitor - absorbant.
4. Faceți o listă cu echipamentele de filtrare necesare.
a) filtru de hârtie
b) un pahar cu o soluție
c) pâlnie de sticlă
d) sticla curata
e) tijă de sticlă
f) trepied cu picior
5. Experienta de laborator. Fabricarea filtrelor obișnuite și pliate din hârtie de filtru sau șervețel de hârtie.

Ce parere aveti, prin ce filtru va trece mai repede solutia - obisnuita sau plisata? De ce?
Prin pliat - zona de contact a filtrării este mai mare decât cea a unui filtru convențional.
6. Sugerați metode de separare a amestecurilor indicate în Tabelul 16.
Modalități de separare a unor amestecuri
7. Experiență acasă. Adsorbția coloranților Pepsi-Cola de către cărbunele activat.
Reactivi si echipamente: băutură carbogazoasă, cărbune activ; cratiță, pâlnie, hârtie de filtru, aragaz electric (gaz).
Progres. Turnați o jumătate de cană (100 ml) de băutură gazoasă într-o cratiță. Adăugați 5 tablete de cărbune activat în același loc. Încinge tigaia timp de 10 minute pe aragaz. Filtrați cărbunele. Explicați rezultatele experimentului.
Soluția a devenit incoloră datorită absorbției materiei colorante cu cărbune activ.
8. Experiență acasă. Adsorbția vaporilor mirositoare de către batoanele de porumb.
Reactivi si echipamente: batoane de porumb, parfum sau apa de colonie; 2 borcane de sticla identice cu capac.
Progres. Pune o picătură de parfum în două borcane de sticlă. Pune 4-5 batoane de porumb într-unul dintre borcane. Închideți ambele borcane cu capace. Agitați puțin borcanul care conține bețișoarele de porumb. Pentru ce?
Pentru a crește rata de adsorbție.
Deschide ambele bănci. Explicați rezultatele experimentului.
Nu există miros în borcanul în care erau bețișoarele de porumb, deoarece acestea absorbeau mirosul de parfum.