Technécium fém. Technécium. Ilméniától Mazuriáig
Technécium (lat. Technécium), Tc, a Mengyelejev-féle periódusos rendszer VII. csoportjába tartozó radioaktív kémiai elem, 43 rendszám, 98, 9062 atomtömeg; fém, képlékeny és képlékeny.
A technéciumnak nincsenek stabil izotópjai. A radioaktív izotópok közül (kb. 20) kettőnek van gyakorlati jelentősége: 99 Tc és 99m Tc felezési idejű, ill. T 1/2= 2,12 × 10 5 év és T 1/2 = 6,04 h. A természetben az elem kis mennyiségben található - 10-10 G 1-ben T uránkátrány.
Fizikai és kémiai tulajdonságok.
A por alakú technécium fém szürke színű (Re, Mo, Pt-re emlékeztet); kompakt fém (olvasztott fém rúd, fólia, huzal) ezüstszürke. A kristályos állapotban lévő technécium egy szorosan egymásra épülő hatszögletű rácsot tartalmaz ( A = 2,735
, с = 4,391); vékony rétegekben (kevesebb, mint 150) - egy köbös arc-központú rács ( a = 3,68? 0,0005); T. sűrűség (hatszögletű ráccsal) 11,487 g/cm3, t pl 2200? 50 °C; t kip 4700 °C; elektromos ellenállás 69 * 10 -6 ohm × cm(100 °C); a szupravezető állapotba való átmenet hőmérséklete Tc 8,24 K. A technécium paramágneses; mágneses szuszceptibilitása 25 0 C-on 2,7 * 10 -4 . A Tc 4 atom külső elektronhéjának konfigurációja d 5 5s 2 ; atomsugár 1,358; ionsugár Tc 7+ 0,56.A kémiai tulajdonságok szerint A Tc közel áll a Mn-hez és különösen az Re-hez, vegyületekben -1 és +7 közötti oxidációs állapotot mutat. A +7 oxidációs állapotú Tc vegyületek a legstabilabbak és jól tanulmányozottak. Amikor a technécium vagy vegyületei kölcsönhatásba lépnek oxigénnel, Tc 2 O 7 és TcO 2 oxidok képződnek, klórral és fluor halogenidekkel TcX 6, TcX 5, TcX 4 oxihalogenidek képződése lehetséges, például TcO 3 X (ahol X jelentése halogén), kén-szulfidokkal Tc 2 S 7 és TcS 2. A technécium technéciumsavat, HTcO 4-et és pertechnát sóit, MeTcO 4-et (ahol Me egy fém), karbonil-, komplex- és fémorganikus vegyületeket is képez. A feszültségsorozatban a technécium a hidrogéntől jobbra van; nem lép reakcióba semmilyen koncentrációjú sósavval, de könnyen oldódik salétrom- és kénsavban, vízben, hidrogén-peroxidban és brómos vízben.
Nyugta.
A technécium fő forrása a nukleáris iparból származó hulladék. A 99 Tc hozama 235 U hasadásából körülbelül 6%. A pertechnátok, oxidok és szulfidok formájában lévő technéciumot hasadási termékek keverékéből szerves oldószerekkel, ioncserélő módszerekkel és a rosszul oldódó származékok kicsapásával vonják ki. A fémet NH 4 TcO 4, TcO 2, Tc 2 S 7 hidrogénnel 600-1000 0 C-on történő redukciójával vagy elektrolízissel nyerik.
Alkalmazás.
A technécium ígéretes fém a technológiában; katalizátorként, magas hőmérsékleten és szupravezető anyagként is alkalmazható. Technécium vegyületek. - hatékony korróziógátlók. A 99m Tc-t az orvostudományban g-sugárzás forrásaként használják . A technécium sugárveszélyes, a vele való munkavégzéshez speciális zárt felszerelés szükséges.
A felfedezés története.
Még 1846-ban az Oroszországban dolgozó R. Herman vegyész és ásványkutató az uráli Ilmen-hegységben egy addig ismeretlen ásványt talált, amelyet ittroilmenitnek nevezett el. A tudós nem nyugodott bele, és megpróbált izolálni belőle egy új kémiai elemet, amelyről úgy gondolta, hogy az ásványban található. Mielőtt azonban ideje lett volna kinyitni ilmeniumát, a híres német kémikus, G. Rose „bezárta”, bizonyítva ezzel Herman munkájának tévedését.
Negyedszázaddal később az ilmenium ismét megjelent a kémia élvonalában – az „eka-mangán” szerepére pályázóként emlékeztek rá, amely a periódusos rendszer 43. számának üres helyét kellett volna elfoglalnia. Az ilmenium hírnevét nagymértékben „bemocskolták” G. Rose munkái, és annak ellenére, hogy számos tulajdonsága, beleértve az atomtömeget is, meglehetősen alkalmas volt a 43-as elemre, D. I. Mengyelejev nem jegyezte be a táblázatába. A további kutatások végül meggyőzték a tudományos világot arról , hogy az ilmenium csak a sok hamis elem egyikének szomorú dicsőségével kerülhet be a kémia történetébe.
Mivel egy szent hely soha nem üres, sorra jelentek meg az elfoglalási jogra vonatkozó igények. Davy, Lucium, Nipponium – mind szappanbuborékként törnek fel, alig van idejük megszületni.
Ám 1925-ben a német tudóspáros, Ida és Walter Noddack közzétett egy üzenetet, amely szerint két új elemet fedeztek fel - a masuriumot (43. szám) és a réniumot (75. szám). A sors kedvezően alakult Reniusnak: azonnal legitimálták, és azonnal elfoglalta a számára előkészített rezidenciát. De a szerencse hátat fordított a masuriumnak: sem felfedezői, sem más tudósok nem tudták tudományosan megerősíteni ennek az elemnek a felfedezését. Igaz, Ida Noddak azt mondta, hogy „hamarosan a masuriumot, akárcsak a réniumot, meg lehet majd vásárolni az üzletekben”, de a vegyészek, mint tudják, nem hisznek a szavaknak, és a Noddak házastársai nem tudtak más, meggyőzőbb bizonyítékkal szolgálni - a A „hamis negyvenharmadok” listája egy újabb vesztessel bővült.
Ebben az időszakban egyes tudósok hajlamosak voltak azt hinni, hogy a Mengyelejev által megjósolt elemek közül nem minden, különösen a 43-as elem létezik a természetben. Lehet, hogy egyszerűen nem léteznek, és nem kell időt vesztegetni és lándzsát törni? Még a neves német kémikus, Wilhelm Prandtl is erre a következtetésre jutott, aki megvétózta a masurium felfedezését.
A kérdés tisztázását az addigra már erős tekintélyre szert tett kémia húga, a magfizika tette lehetővé. Ennek a tudománynak az egyik törvényét (a 20-as években S. A. Shchukarev szovjet kémikus jegyezte fel, és végül 1934-ben fogalmazta meg G. Mattauch német fizikus) Mattauch-Shchukarev szabálynak, vagy tiltó szabálynak nevezik.
Jelentése az, hogy a természetben nem létezhet két olyan stabil izobár, amelyek nukleáris töltései eggyel különböznek egymástól. Más szóval, ha bármely kémiai elemnek van stabil izotópja, akkor a táblázatban szereplő legközelebbi szomszédjainak „kategorikusan tilos” azonos tömegszámú stabil izotópja lenni. Ebben az értelemben a 43-as elem egyértelműen szerencsétlen volt: bal és jobb szomszédai - a molibdén és a ruténium - gondoskodtak arról, hogy a közeli „területeken” minden stabil üresedés az ő izotópjaihoz tartozzon. Ez pedig azt jelentette, hogy a 43-as elemnek nehéz sorsa volt: akárhány izotópja volt, mindegyik instabilitásra volt ítélve, és így folyamatosan - éjjel-nappal - ha akartak, ha nem - bomlania kellett.
Joggal feltételezhető, hogy a 43-as elem egykor észrevehető mennyiségben létezett a Földön, de fokozatosan eltűnt, mint a reggeli köd. Tehát ebben az esetben miért maradt fenn az urán és a tórium a mai napig? Hiszen ők is radioaktívak, és ezért életük első napjaitól kezdve, ahogy mondani szokás, lassan, de biztosan bomlanak? De pontosan itt rejlik a válasz kérdésünkre: az urán és a tórium csak azért maradt meg, mert lassan bomlik le, sokkal lassabban, mint más természetes radioaktivitású elemek (és a Föld fennállása alatt mégis urántartalékok vannak a természetes tárolókban egyszer körülbelül százzal csökkentek). Amerikai radiokémikusok számításai kimutatták, hogy egyik vagy másik elem instabil izotópjának csak akkor van esélye túlélni a földkéregben a „világteremtéstől” egészen napjainkig, ha felezési ideje meghaladja a 150 millió évet. A jövőre nézve azt fogjuk mondani, hogy a 43-as számú elem különféle izotópjainak kinyerésekor kiderült, hogy közülük a leghosszabb életűek felezési ideje alig több, mint két és fél millió év, és ezért utolsó atomjai megszűntek létezni, nyilván még jóval a Földön való megjelenésük előtt.Az első dinoszaurusz Földje: elvégre bolygónk mintegy 4,5 milliárd éve „működik” az Univerzumban.
Ezért, ha a tudósok saját kezükkel akarták „megérinteni” a 43-as elemet, ugyanazokkal a kézzel kellett megalkotniuk, hiszen a természet már régen felvette a hiányzók listájára. De vajon képes-e a tudomány egy ilyen feladatra?
Igen, a vállán. Ezt először Ernest Rutherford angol fizikus bizonyította kísérletileg 1919-ben. A nitrogénatomok magját heves bombázásnak vetette alá, amelyben az állandóan bomló rádium atomok szolgáltak fegyverként, a keletkező alfa részecskék pedig lövedékként. A hosszan tartó héjképzés eredményeként a nitrogénatomok magjai protonokkal feltöltődtek és oxigénné alakult.
Rutherford kísérletei rendkívüli tüzérséggel vértezték fel a tudósokat: segítségével nem elpusztítani, hanem létrehozni lehetett - egyes anyagokat másokká alakítani, új elemeket szerezni.
Miért nem próbálja meg így megszerezni a 43-as elemet? A fiatal olasz fizikus, Emilio Segre ennek a problémának a megoldását kereste. A 30-as évek elején a Római Egyetemen dolgozott az akkor híres Enrico Fermi vezetésével. Más „fiúkkal” (ahogy Fermi tréfásan tehetséges tanítványait nevezte) Segre részt vett az urán neutronbesugárzásával kapcsolatos kísérletekben, és számos más magfizikai problémát megoldott. A fiatal tudós azonban csábító ajánlatot kapott - a Palermói Egyetem fizika tanszékének élére. Amikor megérkezett Szicília ősi fővárosába, csalódott volt: az általa vezetett laboratórium több mint szerény volt, megjelenése pedig egyáltalán nem kedvezett a tudományos hasznosításnak.
De Segre vágya, hogy mélyebbre hatoljon az atom titkaiba, nagyszerű volt. 1936 nyarán átkel az óceánon, hogy meglátogassa Berkeley amerikai városát. Itt, a Kaliforniai Egyetem sugárlaboratóriumában már több éve működött a ciklotron, az Ernest Lawrence által feltalált atomi részecskegyorsító. Ma ez a kis eszköz a fizikusok számára olyannak tűnik, mint egy gyerekjáték, de akkoriban a világ első ciklotronja csodálatot és irigységet keltett más laboratóriumok tudósaiban (1939-ben E. Lawrence Nobel-díjat kapott a megalkotásáért).
Technécium(lat. technécium), Te, a Mengyelejev-féle periódusos rendszer VII. csoportjába tartozó radioaktív kémiai elem, 43-as rendszám, 98-as atomtömeg, 9062; fém, képlékeny és képlékeny.
A 43-as rendszámú elem létezését D. I. Mengyelejev jósolta meg. A T.-t 1937-ben mesterségesen szerezték be olasz tudósok, E. Segreés K. Perrier molibdénmagok deuteronokkal történő bombázása során; nevét a görögtől kapta. technet o s - mesterséges.
A T.-nek nincsenek stabil izotópjai. A radioaktív izotópok közül (kb. 20) kettőnek van gyakorlati jelentősége: 99 Tc és 99m tc felezési idejű, ill. T 1/2 = 2,12 ? 10 5 évek és t 1/2 = 6,04 h. A természetben az elem kis mennyiségben található - 10-10 G 1-ben T uránkátrány.
Fizikai és kémiai tulajdonságok . A fém T. por alakban szürke színű (re, mo, pt-re emlékeztet); kompakt fém (olvasztott fém rúd, fólia, huzal) ezüstszürke. A T. kristályos állapotban hatszögletű, szoros tömörítésű rácsot tartalmaz ( A= 2,735 å, c = 4,391 å); vékony rétegekben (kevesebb, mint 150 å) - egy köbös arc-központú rács ( a = 3,68 ± 0,0005 å); T. sűrűség (hatszögletű ráccsal) 11,487 g/cm3,t pl 2200 ± 50 °C; t kip 4700 °C; elektromos ellenállás 69 10 -6 oh? cm(100 °C); a szupravezető állapotba való átmenet hőmérséklete Tc 8,24 K. T. paramágneses; mágneses szuszceptibilitása 25°C-on 2,7 10 -4 . A Tc 4 atom külső elektronhéjának konfigurációja d 5 5 s 2 ; atomsugár 1,358 å; ionsugár Tc 7+ 0,56 å.
Kémiai tulajdonságait tekintve tc közel van az mn-hez és különösen az re-hez, vegyületekben -1 és +7 közötti oxidációs állapotot mutat. A +7 oxidációs állapotú Tc vegyületek a legstabilabbak és jól tanulmányozottak. Amikor a T. vagy vegyületei oxigénnel kölcsönhatásba lépnek, tc 2 o 7 és tco 2 oxidok keletkeznek, klórral és fluor - halogenidekkel TcX 6, TcX 5, TcX 4 oxihalogenidek képződése lehetséges, például TcO 3 X ( ahol X jelentése halogén), kén-szulfidokkal tc 2 s 7 és tcs 2. A T. emellett technetsavat htco 4-et és pertechnát sóit mtco 4-et (ahol M fém), karbonil-, komplex- és fémorganikus vegyületeket képez. A feszültségek sorában T. a hidrogéntől jobbra van; nem lép reakcióba semmilyen koncentrációjú sósavval, de könnyen oldódik salétrom- és kénsavban, vízben, hidrogén-peroxidban és brómos vízben.
Nyugta. A T. fő forrása a nukleáris ipar hulladéka. A 99 tc hozam 235 u elosztása esetén körülbelül 6%. A T.-t pertechnátok, oxidok és szulfidok formájú hasadási termékek keverékéből vonják ki szerves oldószeres extrakcióval, ioncserélő módszerekkel és a rosszul oldódó származékok kicsapásával. A fémet hidrogénnel nh 4 tco 4, tco 2, tc 2 s 7 600-1000 °C-on végzett redukcióval vagy elektrolízissel nyerik.
Alkalmazás. A T. technológiai szempontból ígéretes fém; katalizátorként, magas hőmérsékleten és szupravezető anyagként is alkalmazható. A T. vegyületek hatékony korróziógátlók. A 99m tc-t az orvostudományban g-sugárzás forrásaként használják . A T. sugárveszélyes, a vele való munkavégzéshez speciális zárt felszerelés szükséges .
Megvilágított.: Kotegov K.V., Pavlov O.N., Shvedov V.P., Technetius, M., 1965; A Tc 99 kinyerése fém és vegyületei formájában nukleáris ipari hulladékból, a következő könyvben: Production of Isotopes, M., 1973.
A Segrè-t először 1937-ben szerezték meg molibdén célpont deuteronokkal történő bombázásával. Az első mesterségesen előállított termékként technéciumnak nevezték (Technécium, a technh- Művészet). A magok stabilitására vonatkozó szabálynak megfelelően instabilnak bizonyult. Később a technécium több mesterséges izotópját is előállították. Mindegyik instabil is. A technécium leghosszabb életű izotópja, amelyet 1947-ben találtak az urán bomlástermékei között (99 Tg), felezési ideje ~2. 10 5 év. A Föld körülbelül 10 000-szer idősebb. Ebből az következik, hogy még ha a technécium kezdetben a földkéregben is volt, ez idő alatt el kellett volna tűnnie. Parkernek és Kurodának (Parker, Kuroda, 1956) azonban sikerült bebizonyítania, hogy a természetes urán rendkívül kis mennyiségben tartalmazza a molibdén 99 Mo radioaktív izotópját, amelynek felezési ideje 67 óra, és ennek eredményeként. b-a bomlás 99 T-sá alakul. Ez azt jelzi, hogy a 99 Tc folyamatosan termelődik a 238 U spontán nukleáris bomlásával. Ezért a technécium nyilvánvalóan létezik a természetben, annak ellenére, hogy közvetlenül még nem fedezték fel.
Nyugta:
A 99 Tc izotópot észrevehető mennyiségben nyerik, mivel az atomreaktorokban az urán bomlástermékei közé tartozik, valamint gyenge radioaktivitása miatt. Tc 2 S 7 formájában sósavval megsavanyított vizes oldatból hidrogén-szulfiddal kicsapják. A fekete szulfid csapadékot hidrogén-peroxid ammónia-oldatában feloldjuk, és a kapott vegyületet, az NH 4 TcO 4 ammónium-pertechnetátot hidrogénáramban 600°-os hőmérsékleten kalcináljuk.
A technécium fém savas oldatból elektrolitikus úton könnyen elkülöníthető.
Fizikai tulajdonságok:
A technécium ezüstszürke fém. Moon szerint (Mooney, 1947) egy rácsban kristályosodik, hatszögletű szoros tömörítéssel (a = 2,735, c = 4,388 A°).
Kémiai tulajdonságok:
A technécium kémiai tulajdonságai nagyon hasonlóak a réniumhoz, és hasonlóak a periódusos rendszerben lévő szomszédjához, a molibdénhez is. Ez a körülmény akkor használatos, ha elhanyagolható mennyiségű technéciummal dolgozunk. Sósavban vagy lúgos hidrogén-peroxid oldatban nem oldódik, de könnyen oldódik salétromsavban és vízben. Oxigénáramban hevítve világossárga illékony heptoxid Tc 2 O 7 keletkezik.
A legfontosabb kapcsolatok:
A Tc 2 O 7 vízben oldva technéciumsavat ("pertechnetikus") HTcO 4-et képez, amely az oldat bepárlásával sötétvörös, hosszúkás kristályok formájában izolálható. Az NTso 4 egy erős egybázisú sav. Sötétvörös tömény vizes oldatai hígításkor gyorsan elszíneződnek. Az NH 4 TcO 4 ammónium-pertechnetát színtelen és tiszta állapotában nem higroszkópos.
A Tc 2 S 7 szulfid fekete csapadékát savanyított vizes oldatból hidrogén-szulfiddal kicsapják. A technécium-szulfidok híg sósavban oldhatatlanok.
Alkalmazás:
Tekintettel arra, hogy az atomreaktor hulladékából a leghosszabb élettartamú 99 Tc izotóp folyamatos előállítására van lehetőség, nem zárható ki a jövőbeni műszaki felhasználás lehetősége. A technécium a lassú neutronok egyik leghatékonyabb elnyelője. Ebben a tekintetben nyilvánvalóan figyelembe kell venni az atomreaktorok árnyékolására való felhasználását.
A Tc izotópot használják g emitter az orvosi diagnosztikában.
A jelenleg előállított technécium mennyisége néhány gramm nagyságrendű.
Lásd még:
S.I. Venetsky Ritkáról és szórványról. Történetek a fémekről.
Technécium(lat. Technécium), Tc, a Mengyelejev-féle periódusos rendszer VII. csoportjába tartozó radioaktív kémiai elem, 43-as rendszám, 98-as atomtömeg, 9062; fém, képlékeny és képlékeny.
A 43-as rendszámú elem létezését D. I. Mengyelejev jósolta meg. A technéciumot 1937-ben E. Segre és C. Perrier olasz tudósok mesterségesen nyerték ki molibdénmagok deuteronokkal történő bombázásával; nevét a görögtől kapta. technetos - mesterséges.
A technéciumnak nincsenek stabil izotópjai. A radioaktív izotópok közül (kb. 20) kettőnek van gyakorlati jelentősége: 99 Tc és 99m Tc felezési idejű, T ½ = 2,12 10 5 év és T ½ = 6,04 óra A természetben az elem jelentéktelen mennyiségben található mennyiségek - 10-10 g 1 tonna uránkátrányban.
A technécium fizikai tulajdonságai. A por alakú technécium fém szürke színű (Re, Mo, Pt-re emlékeztet); kompakt fém (olvasztott fém rúd, fólia, huzal) ezüstszürke. A kristályos állapotban lévő technécium szorosan egymásra épülő hatszögletű rácsot tartalmaz (a = 2,735 A, c = 4,391 A); vékony rétegekben (kevesebb, mint 150 Å) - egy arcközpontú köbös rács (a = 3,68 Å); Technécium sűrűség (hatszögletű ráccsal) 11,487 g/cm 3 ; t pl 2200 °C; g bála 4700 °C; elektromos ellenállás 69·10 -6 ohm·cm (100 °C); a szupravezető állapotba való átmenet hőmérséklete Tc 8,24 K. A technécium paramágneses; mágneses szuszceptibilitása 25°C-on 2,7·10 -4. Az atom külső elektronhéjának konfigurációja: Tc 4d 5 5s 2; atomsugár 1,358Å; ionsugár Tc 7+ 0,56Å.
A technécium kémiai tulajdonságai. Kémiai tulajdonságait tekintve a Tc közel áll a Mn-hez és különösen az Re-hez, vegyületekben -1 és +7 közötti oxidációs fokot mutat. A +7 oxidációs állapotú Tc vegyületek a legstabilabbak és jól tanulmányozottak. Amikor a technécium vagy vegyületei kölcsönhatásba lépnek oxigénnel, Tc 2 O 7 és TcO 2 oxidok képződnek, klórral és fluor halogenidekkel TcX 6, TcX 5, TcX 4 oxihalogenidek képződése lehetséges, például TcO 3 X (ahol X jelentése halogén), kén-szulfidokkal Tc 2 S 7 és TcS 2. A technécium technetsavat, HTcO 4-et és pertechnát sóit, MTcO 4-et (ahol M egy fém), karbonil-, komplex- és fémorganikus vegyületeket is képez. A feszültségsorozatban a technécium a hidrogéntől jobbra van; nem lép reakcióba semmilyen koncentrációjú sósavval, de könnyen oldódik salétrom- és kénsavban, vízben, hidrogén-peroxidban és brómos vízben.
Technécium beszerzése. A technécium fő forrása a nukleáris iparból származó hulladék. A 99 Tc hozama 233 U hasadásából körülbelül 6%. A pertechnátok, oxidok és szulfidok formájában lévő technéciumot hasadási termékek keverékéből szerves oldószerekkel, ioncserélő módszerekkel és a rosszul oldódó származékok kicsapásával vonják ki. A fémet NH 4 TcO 4, TcO 2, Tc 2 S 7 hidrogénnel 600-1000 °C-on történő redukálásával vagy elektrolízissel nyerik.
A technécium alkalmazásai. A technécium ígéretes fém a technológiában; katalizátorként, magas hőmérsékleten és szupravezető anyagként is alkalmazható. A technéciumvegyületek hatékony korróziógátlók. A 99m Tc-t az orvostudományban γ-sugárzás forrásaként használják. A technécium sugárveszélyes, a vele való munkavégzéshez speciális zárt felszerelés szükséges.
MEGHATÁROZÁS
Technécium periódusos rendszer másodlagos (B) alcsoportjának VII. csoportjának ötödik periódusában található.
Elemekre utal d-családok. Fém. Megnevezés - Tc. Sorozatszám - 43. Relatív atomtömeg - 99 amu.
A technécium atom elektronszerkezete
A technécium atom egy pozitív töltésű magból (+43) áll, melynek belsejében 43 proton és 56 neutron található, és 43 elektron mozog öt pályán.
1. ábra. A technécium atom sematikus szerkezete.
Az elektronok eloszlása a pályák között a következő:
43Tc) 2) 8) 18) 13) 2;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5s 2 .
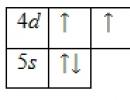
A technécium atom külső energiaszintje 7 elektront tartalmaz, amelyek vegyértékelektronok. Az alapállapot energiadiagramja a következő formában jelenik meg:

A technécium atom vegyértékelektronjait négy kvantumszám halmazával jellemezhetjük: n(főkvantum), l(pálya), m l(mágneses) és s(pörgetés):
|
Alszint |
||||
Példák problémamegoldásra
1. PÉLDA
| Gyakorlat | A negyedik periódus melyik eleme - a króm vagy a szelén - rendelkezik hangsúlyosabb fémes tulajdonságokkal? Írd le az elektronikus képleteiket. |
| Válasz | Írjuk fel a króm és a szelén alapállapotának elektronikus konfigurációit: 24 Kr 1 s 2 2s 2 2p 6 3s 2 3p 6 3 d 5 4 s 1 ; 34 Lásd 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4 s 2 4 p 4 . A fémes tulajdonságok a szelénben kifejezettebbek, mint a krómban. Ennek az állításnak a valódiságát a Periodikus Törvénnyel igazolhatjuk, amely szerint csoportban fentről lefelé haladva egy elem fémes tulajdonságai nőnek, a nemfémeseké pedig csökken, ami abból adódik, hogy amikor az atomban lefelé haladva megnő az elektronrétegek száma az atomban, aminek következtében a vegyértékelektronokat gyengébb a mag tartja. |