Metalni tehnecij. tehnecij. Od Ilmenije do Masurije
Tehnecij (lat. Technetium), Tc, radioaktivni kemijski element VII skupine periodnog sustava Mendeljejeva, atomski broj 43, atomska masa 98, 9062; metal, savitljiv i duktilan.
Tehnicij nema stabilne izotope. Od radioaktivnih izotopa (oko 20), dva su od praktične važnosti: 99 Tc i 99m Tc s poluživotima, respektivno T 1/2= 2,12 ×10 5 godina i T 1/2 = 6,04 h. U prirodi se element nalazi u malim količinama - 10 -10 G u 1 T uranov katran.
Fizička i kemijska svojstva.
Metalni tehnecij u obliku praha je sive boje (podsjeća na Re, Mo, Pt); kompaktni metal (stopljeni metalni ingoti, folija, žica) srebrno siva. Tehnicij u kristalnom stanju ima tijesno pakiranu heksagonalnu rešetku ( A = 2,735
, s = 4,391); u tankim slojevima (manje od 150) - kubična rešetka s licem u središtu ( a = 3,68? 0,0005); T. gustoća (sa heksagonalnom rešetkom) 11.487 g/cm 3, t mn 2200? 50°C; t kip 4700°C; električni otpor 69 * 10 -6 ohm × cm(100°C); temperatura prijelaza u stanje supravodljivosti Tc 8,24 K. Tehnecij je paramagnetik; njegova magnetska osjetljivost na 25 0 C je 2,7 * 10 -4 . Konfiguracija vanjske elektronske ljuske atoma Tc 4 d 5 5s 2 ; atomski radijus 1,358; ionski polumjer Tc 7+ 0,56.Prema kemijskim svojstvima Tc je blizak Mn, a posebno Re; u spojevima ima oksidacijska stanja od -1 do +7. Tc spojevi u oksidacijskom stanju +7 su najstabilniji i dobro proučeni. Kada tehnecij ili njegovi spojevi stupaju u interakciju s kisikom, nastaju oksidi Tc 2 O 7 i TcO 2, s klorom i fluorom - halidi TcX 6, TcX 5, TcX 4, moguća je tvorba oksihalogenida, na primjer TcO 3 X (gdje X je halogen), sa sumporom - sulfidi Tc 2 S 7 i TcS 2. Tehnecij također tvori tehnecijevu kiselinu HTcO 4 i njene perteknatne soli MeTcO 4 (gdje je Me metal), karbonilne, kompleksne i organometalne spojeve. U nizu napona, tehnecij je desno od vodika; ne reagira sa solnom kiselinom bilo koje koncentracije, ali se lako otapa u dušičnoj i sumpornoj kiselini, aqua regia, vodikovom peroksidu i bromnoj vodi.
Priznanica.
Glavni izvor tehnecija je otpad iz nuklearne industrije. Prinos 99 Tc iz fisije 235 U je oko 6%. Tehnicij se u obliku pertehnata, oksida i sulfida ekstrahira iz smjese fisijskih produkata ekstrakcijom organskim otapalima, metodama ionske izmjene i taloženjem slabo topljivih derivata. Metal se dobiva redukcijom NH 4 TcO 4, TcO 2, Tc 2 S 7 s vodikom na 600-1000 0 C ili elektrolizom.
Primjena.
Tehnecij je metal koji obećava u tehnologiji; može pronaći primjenu kao katalizator, visokotemperaturni i supravodljivi materijal. Spojevi tehnecija. - učinkoviti inhibitori korozije. 99m Tc koristi se u medicini kao izvor g-zračenja . Tehnicij je opasno zračenje, rad s njim zahtijeva posebnu zapečaćenu opremu.
Povijest otkrića.
Davne 1846. godine kemičar i mineralog R. Herman, koji je radio u Rusiji, pronašao je do tada nepoznati mineral u planinama Iljmen na Uralu, koji je nazvao itroilmenit. Znanstvenik nije počivao na lovorikama i pokušao je iz njega izolirati novi kemijski element za koji je vjerovao da je sadržan u mineralu. Ali prije nego što je stigao otvoriti svoj ilmenium, poznati njemački kemičar G. Rose ga je "zatvorio", dokazujući pogrešnost Hermanova rada.
Četvrt stoljeća kasnije, ilmenij se ponovno pojavio na čelu kemije - ostao je zapamćen kao pretendent na ulogu "eka-mangana", koji je trebao zauzeti prazno mjesto u periodnom sustavu na broju 43. No, ugled ilmenija uvelike je "okaljan" radovima G. Rosea, i, unatoč činjenici da su mnoga njegova svojstva, uključujući atomsku težinu, bila sasvim prikladna za element br. 43, D. I. Mendeljejev ga nije registrirao u svojoj tablici. Daljnja istraživanja konačno su uvjerila znanstveni svijet da , da ilmenij može ući u povijest kemije samo s tužnom slavom jednog od mnogih lažnih elemenata.
Budući da sveto mjesto nikad nije prazno, zahtjevi za pravom na njegovo zauzimanje pojavljivali su se jedan za drugim. Davy, Lucium, Nipponium - svi su se rasprsnuli poput mjehurića od sapunice, jedva da su stigli na svijet.
No 1925. njemački znanstveni par Ida i Walter Noddack objavio je poruku da su otkrili dva nova elementa - masurij (br. 43) i renij (br. 75). Sudbina je bila naklonjena Reniju: odmah je legitimiran i odmah je zauzeo rezidenciju pripremljenu za njega. No sreća je masuriju okrenula leđa: ni njegovi pronalazači ni drugi znanstvenici nisu mogli znanstveno potvrditi otkriće ovog elementa. Istina, Ida Noddak je rekla da će se "mazurij, poput renija, uskoro moći kupiti u trgovinama", ali kemičari, kao što znate, ne vjeruju riječima, a supružnici Noddak nisu mogli pružiti druge, uvjerljivije dokaze - popis “lažnih četrdesettrećih” dodao je još jednog gubitnika.
U tom su razdoblju neki znanstvenici počeli vjerovati da u prirodi ne postoje svi elementi koje je predvidio Mendeljejev, a posebno element broj 43. Možda ih jednostavno nema i ne treba gubiti vrijeme i lomiti koplja? Čak je i istaknuti njemački kemičar Wilhelm Prandtl, koji je stavio veto na otkriće masurija, došao do tog zaključka.
Mlađa sestra kemije, nuklearna fizika, koja je do tada već stekla snažan autoritet, omogućila je razjašnjenje ovog pitanja. Jedan od zakona ove znanosti (koji je 20-ih godina zabilježio sovjetski kemičar S.A. Shchukarev i konačno 1934. godine formulirao njemački fizičar G. Mattauch) naziva se Mattauch-Shchukarev pravilo ili pravilo zabrane.
Njegovo značenje je da u prirodi ne mogu postojati dvije stabilne izobare, čiji se nuklearni naboji razlikuju za jedan. Drugim riječima, ako bilo koji kemijski element ima stabilan izotop, tada je njegovim najbližim susjedima u tablici "kategorički zabranjeno" da imaju stabilan izotop s istim masenim brojem. U tom smislu, element br. 43 očito nije imao sreće: njegovi susjedi s lijeve i desne strane - molibden i rutenij - pobrinuli su se da sva stabilna prazna mjesta na obližnjim "teritorijima" pripadaju njihovim izotopima. A to je značilo da je element broj 43 imao tešku sudbinu: bez obzira koliko izotopa imao, svi su bili osuđeni na nestabilnost, pa su se, htjeli ne htjeli, morali kontinuirano - dan i noć - raspadati.
Razumno je pretpostaviti da je element broj 43 nekada postojao na Zemlji u primjetnim količinama, ali je postupno nestao, poput jutarnje magle. Pa zašto su, u ovom slučaju, uran i torij preživjeli do danas? Uostalom, i oni su radioaktivni i stoga se od prvih dana života raspadaju, kako kažu, polako, ali sigurno? No, upravo tu leži odgovor na naše pitanje: uran i torij sačuvani su samo zato što se sporo raspadaju, puno sporije od ostalih elemenata s prirodnom radioaktivnošću (a ipak, za vrijeme postojanja Zemlje, uran se nalazi u njenim prirodnim skladištima jednom su se smanjile za oko stotinu). Izračuni američkih radiokemičara pokazali su da nestabilni izotop jednog ili drugog elementa ima šanse preživjeti u zemljinoj kori od "stvaranja svijeta" do danas samo ako mu vrijeme poluraspada prelazi 150 milijuna godina. Gledajući unaprijed, reći ćemo da kada su dobiveni različiti izotopi elementa br. 43, ispostavilo se da je vrijeme poluraspada najdugovječnijih od njih samo nešto više od dva i pol milijuna godina, i, prema tome, njegovi posljednji atomi su prestali postojati, izgleda čak i mnogo prije nego što su se pojavili na Zemlji Zemlja prvog dinosaura: uostalom, naš planet "funkcionira" u Svemiru oko 4,5 milijarde godina.
Stoga, ako su znanstvenici željeli vlastitim rukama “dotaknuti” element broj 43, morali su ga stvoriti istim rukama, budući da ga je priroda odavno uvrstila na popis nestalih. No je li znanost dorasla takvom zadatku?
Da, na ramenu. To je prvi eksperimentalno dokazao davne 1919. godine engleski fizičar Ernest Rutherford. On je jezgru dušikovih atoma podvrgnuo žestokom bombardiranju, pri čemu su atomi radija u stalnom raspadanju služili kao oružje, a nastale alfa čestice kao projektili. Kao rezultat dugotrajnog granatiranja, jezgre atoma dušika su se napunile protonima i pretvorile su se u kisik.
Rutherfordovi eksperimenti naoružali su znanstvenike izvanrednom artiljerijom: uz njegovu pomoć bilo je moguće ne uništavati, već stvarati - transformirati neke tvari u druge, dobiti nove elemente.
Pa zašto ne pokušati dobiti element br. 43 na ovaj način? Mladi talijanski fizičar Emilio Segre prihvatio se rješenja ovog problema. Početkom tridesetih godina radio je na Sveučilištu u Rimu pod vodstvom tada slavnog Enrica Fermija. Zajedno s drugim “dječacima” (kako je Fermi u šali nazvao svoje talentirane studente), Segre je sudjelovao u eksperimentima neutronskog zračenja urana i riješio mnoge druge probleme nuklearne fizike. Ali mladi znanstvenik dobio je primamljivu ponudu - da vodi odjel za fiziku na Sveučilištu u Palermu. Kad je stigao u drevnu prijestolnicu Sicilije, doživio je razočaranje: laboratorij koji je trebao voditi bio je više nego skroman i svojim izgledom nije bio nimalo pogodan za znanstvene podvige.
Ali Segreova želja da prodre dublje u tajne atoma bila je velika. U ljeto 1936. prelazi ocean kako bi posjetio američki grad Berkeley. Ovdje, u laboratoriju za zračenje Kalifornijskog sveučilišta, već je nekoliko godina radio ciklotron, akcelerator atomskih čestica koji je izumio Ernest Lawrence. Danas bi se ovaj mali uređaj fizičarima činio nešto poput dječje igračke, ali u to je vrijeme prvi ciklotron na svijetu izazvao divljenje i zavist znanstvenika iz drugih laboratorija (1939. godine E. Lawrence je za njegov nastanak dobio Nobelovu nagradu).
tehnecij(lat. technetium), Te, radioaktivni kemijski element VII skupine periodnog sustava Mendeljejeva, atomski broj 43, atomska masa 98, 9062; metal, savitljiv i duktilan.
Postojanje elementa s atomskim brojem 43 predvidio je D. I. Mendeljejev. T. je umjetno dobiven 1937. od strane talijanskih znanstvenika E. Segre i K. Perrier tijekom bombardiranja jezgri molibdena deuteronima; dobio ime od grčkog. technet o s - umjetan.
T. nema stabilnih izotopa. Od radioaktivnih izotopa (oko 20), dva su od praktične važnosti: 99 Tc i 99m tc s poluživotima, respektivno. T 1/2 = 2,12 ? 10 5 godine i t 1/2 = 6,04 h. U prirodi se element nalazi u malim količinama - 10 -10 G u 1 T uranov katran.
Fizička i kemijska svojstva . Metalni T. u prahu je sive boje (podsjeća na re, mo, pt); kompaktni metal (stopljeni metalni ingoti, folija, žica) srebrno siva. T. u kristalnom stanju ima heksagonalnu rešetku tijesnog pakiranja ( A= 2,735 å, c = 4,391 å); u tankim slojevima (manje od 150 å) - kubična rešetka usmjerena na lice ( a = 3,68 ± 0,0005 å); T. gustoća (sa heksagonalnom rešetkom) 11.487 g/cm 3,t mn 2200 ± 50 °C; t kip 4700 °C; električni otpor 69 10 -6 Oh? cm(100 °C); temperatura prijelaza u stanje supravodljivosti Tc 8,24 K. T. paramagnetik; njegova magnetska susceptibilnost na 25°C iznosi 2,7 10 -4 . Konfiguracija vanjske elektronske ljuske atoma Tc 4 d 5 5 s 2 ; atomski radijus 1,358 å; ionski polumjer Tc 7+ 0,56 å.
Po kemijskim svojstvima tc je blizak mn, a posebno re, u spojevima ima oksidacijska stanja od -1 do +7. Tc spojevi u oksidacijskom stanju +7 su najstabilniji i dobro proučeni. Kada T. ili njegovi spojevi stupaju u interakciju s kisikom, nastaju oksidi tc 2 o 7 i tco 2, s klorom i fluorom - halidi TcX 6, TcX 5, TcX 4, moguće je stvaranje oksihalogenida, na primjer TcO 3 X ( gdje je X halogen), sa sumporom - sulfidi tc 2 s 7 i tcs 2. T. također tvori tehnetsku kiselinu htco 4 i njene pertehnatne soli mtco 4 (gdje je M metal), karbonilne, kompleksne i organometalne spojeve. U nizu napona T. je desno od vodika; ne reagira sa solnom kiselinom bilo koje koncentracije, ali se lako otapa u dušičnoj i sumpornoj kiselini, aqua regia, vodikovom peroksidu i bromnoj vodi.
Priznanica. Glavni izvor T. je otpad iz nuklearne industrije. Iskorištenje 99 tc pri dijeljenju 235 u je oko 6%. T. se ekstrahira iz smjese produkata fisije u obliku pertehnata, oksida i sulfida ekstrakcijom organskim otapalima, metodama ionske izmjene i taloženjem slabo topljivih derivata. Metal se dobiva redukcijom s vodikom nh 4 tco 4, tco 2, tc 2 s 7 na 600-1000 °C ili elektrolizom.
Primjena. T. je metal koji obećava u tehnici; može pronaći primjenu kao katalizator, visokotemperaturni i supravodljivi materijal. T. spojevi su učinkoviti inhibitori korozije. 99m tc koristi se u medicini kao izvor g-zračenja . T. je opasno zračenje, rad s njim zahtijeva posebnu zapečaćenu opremu .
Lit.: Kotegov K.V., Pavlov O.N., Shvedov V.P., Technetius, M., 1965.; Dobivanje Tc 99 u obliku metala i njegovih spojeva iz otpada nuklearne industrije, u knjizi: Proizvodnja izotopa, M., 1973.
Segrè je prvi put dobiven 1937. bombardiranjem molibdenske mete deuteronima. Kao prvi umjetno dobiven nazvan je tehnecij (Technetium, od technh- umjetnost). U skladu s pravilom o stabilnosti jezgri, pokazalo se da je nestabilna. Kasnije je dobiveno još nekoliko umjetnih izotopa tehnecija. Svi su oni također nestabilni. Najdugovječniji izotop tehnecija, pronađen 1947. među produktima raspada urana (99 Tg), ima vrijeme poluraspada od ~2. 10 5 godina. Zemlja je oko 10.000 puta starija. Iz ovoga slijedi da čak i ako je tehnecij prvobitno bio sadržan u zemljinoj kori, trebao je nestati tijekom tog vremena. Međutim, Parker i Kuroda (Parker, Kuroda, 1956) uspjeli su dokazati da prirodni uran sadrži u iznimno malim količinama radioaktivni izotop molibdena 99 Mo, koji ima vrijeme poluraspada od 67 sati i kao rezultat b-raspad se pretvara u 99 Ts. To je pokazalo da se 99 Tc kontinuirano proizvodi spontanim nuklearnim raspadom 238 U. Stoga tehnecij očito postoji u prirodi, unatoč činjenici da još nije izravno otkriven.
Priznanica:
Izotop 99 Tc dobiva se u zamjetnim količinama, budući da je jedan od produkata raspada urana u nuklearnim reaktorima, a i zbog svoje slabe radioaktivnosti. U obliku Tc 2 S 7 taloži se sumporovodikom iz vodene otopine zakiseljene solnom kiselinom. Talog crnog sulfida se otopi u otopini amonijaka vodikovog peroksida i dobiveni spoj, amonijev pertehnetat NH 4 TcO 4, se kalcinira u struji vodika na temperaturi od 600°.
Metalni tehnecij može se lako elektrolitički izolirati iz kisele otopine.
Fizička svojstva:
Tehnecij je metal srebrnosive boje. Kristalizira, prema Moonu (Mooney, 1947), u rešetki s heksagonalnim tijesnim pakiranjem (a = 2,735, c = 4,388 A°).
Kemijska svojstva:
Kemijska svojstva tehnecija vrlo su slična reniju, a slična su i njegovom susjedu u periodnom sustavu, molibdenu. Ova se okolnost koristi pri radu sa zanemarivim količinama tehnecija. Netopljiv je ni u klorovodičnoj kiselini ni u alkalnoj otopini vodikovog peroksida, ali se lako otapa u dušičnoj kiselini i aqua regia. Kada se zagrijava u struji kisika, gori stvarajući svijetložuti hlapljivi heptoksid Tc 2 O 7 .
Najvažnije veze:
Tc 2 O 7, kada se otopi u vodi, tvori tehnecijsku (“pertehnetsku”) kiselinu HTcO 4, koja se, kada se otopina ispari, može izdvojiti u obliku tamnocrvenih, duguljastih kristala. NTso 4 je jaka monobazna kiselina. Njegove tamnocrvene koncentrirane vodene otopine brzo gube boju kada se razrijede. Amonijev pertehnetat NH 4 TcO 4 je bezbojan i nehigroskopan u čistom stanju.
Crni talog Tc 2 S 7 sulfida istaloži se sumporovodikom iz zakiseljene vodene otopine. Tehnecijevi sulfidi su netopljivi u razrijeđenoj klorovodičnoj kiselini.
Primjena:
S obzirom na to da je moguće uspostaviti kontinuiranu proizvodnju najdugovječnijeg izotopa 99 Tc iz otpada nuklearnih reaktora, ne može se isključiti mogućnost njegove tehničke uporabe u budućnosti. Tehnecij je jedan od najučinkovitijih apsorbera sporih neutrona. U tom smislu, očito treba uzeti u obzir njegovu upotrebu za zaštitu nuklearnih reaktora.
Tc izotop se koristi kao g emiter u medicinskoj dijagnostici.
Količine tehnecija koje se trenutno proizvode kreću se od nekoliko grama.
Vidi također:
SI. Venetsky O rijetkim i raspršenim. Priče o metalima.
tehnecij(lat. Technetium), Tc, radioaktivni kemijski element VII skupine Mendeljejeva periodnog sustava, atomski broj 43, atomska masa 98, 9062; metal, savitljiv i duktilan.
Postojanje elementa s atomskim brojem 43 predvidio je D. I. Mendeljejev. Tehnecij su 1937. godine umjetnim putem dobili talijanski znanstvenici E. Segre i C. Perrier bombardiranjem jezgri molibdena deuteronima; dobio ime od grčkog. technetos – umjetan.
Tehnicij nema stabilne izotope. Od radioaktivnih izotopa (oko 20), dva su od praktične važnosti: 99 Tc i 99m Tc s poluživotom, redom, T ½ = 2,12 10 5 godina i T ½ = 6,04 sati. U prirodi se element nalazi u neznatnim količinama. količine - 10 - 10 g u 1 toni uranovog katrana.
Fizikalna svojstva tehnecija. Metalni tehnecij u obliku praha je sive boje (podsjeća na Re, Mo, Pt); kompaktni metal (stopljeni metalni ingoti, folija, žica) srebrno siva. Tehnicij u kristalnom stanju ima tijesno pakiranu heksagonalnu rešetku (a = 2,735Å, c = 4,391Å); u tankim slojevima (manje od 150 Å) - kubična rešetka usmjerena na lice (a = 3,68 Å); Gustoća tehnecija (sa heksagonalnom rešetkom) 11,487 g/cm 3 ; tpl 2200°C; g bala 4700 °C; električni otpor 69·10 -6 ohm·cm (100 °C); temperatura prijelaza u stanje supravodljivosti Tc 8,24 K. Tehnecij je paramagnetik; njegova magnetska susceptibilnost na 25°C iznosi 2,7·10 -4. Konfiguracija vanjske elektronske ljuske atoma je Tc 4d 5 5s 2; atomski radijus 1,358Å; ionski polumjer Tc 7+ 0,56Å.
Kemijska svojstva tehnecija. Po kemijskim svojstvima Tc je blizak Mn, a posebno Re, u spojevima ima oksidacijska stanja od -1 do +7. Tc spojevi u oksidacijskom stanju +7 su najstabilniji i dobro proučeni. Kada tehnecij ili njegovi spojevi stupaju u interakciju s kisikom, nastaju oksidi Tc 2 O 7 i TcO 2, s klorom i fluorom - halidi TcX 6, TcX 5, TcX 4, moguća je tvorba oksihalogenida, na primjer TcO 3 X (gdje X je halogen), sa sumporom - sulfidi Tc 2 S 7 i TcS 2. Tehnecij također tvori tehnetsku kiselinu HTcO 4 i njene pertehnatne soli MTcO 4 (gdje je M metal), karbonilne, kompleksne i organometalne spojeve. U nizu napona, tehnecij je desno od vodika; ne reagira sa solnom kiselinom bilo koje koncentracije, ali se lako otapa u dušičnoj i sumpornoj kiselini, aqua regia, vodikovom peroksidu i bromnoj vodi.
Dobivanje tehnecija. Glavni izvor tehnecija je otpad iz nuklearne industrije. Prinos 99 Tc iz fisije 233 U je oko 6%. Tehnicij se u obliku pertehnata, oksida i sulfida ekstrahira iz smjese fisijskih produkata ekstrakcijom organskim otapalima, metodama ionske izmjene i taloženjem slabo topljivih derivata. Metal se dobiva redukcijom NH 4 TcO 4, TcO 2, Tc 2 S 7 s vodikom na 600-1000 ° C ili elektrolizom.
Primjena tehnecija. Tehnecij je metal koji obećava u tehnologiji; može pronaći primjenu kao katalizator, visokotemperaturni i supravodljivi materijal. Spojevi tehnecija su učinkoviti inhibitori korozije. 99m Tc koristi se u medicini kao izvor γ-zračenja. Tehnicij je opasno zračenje, rad s njim zahtijeva posebnu zapečaćenu opremu.
DEFINICIJA
tehnecij nalazi se u petoj periodi VII skupine sekundarne (B) podskupine periodnog sustava.
Odnosi se na elemente d-obitelji. Metal. Oznaka - Tc. Serijski broj - 43. Relativna atomska masa - 99 amu.
Elektronička struktura atoma tehnecija
Atom tehnecija sastoji se od pozitivno nabijene jezgre (+43), unutar koje se nalaze 43 protona i 56 neutrona, a 43 elektrona se kreću u pet orbita.
Sl. 1. Shema strukture atoma tehnecija.
Raspodjela elektrona među orbitalama je sljedeća:
43Tc) 2) 8) 18) 13) 2 ;
1s 2 2s 2 2str 6 3s 2 3str 6 3d 10 4s 2 4str 6 4d 5 5s 2 .
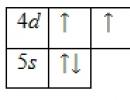
Vanjska energetska razina atoma tehnecija sadrži 7 elektrona, koji su valentni elektroni. Energetski dijagram osnovnog stanja ima sljedeći oblik:

Valentni elektroni atoma tehnecija mogu se okarakterizirati skupom od četiri kvantna broja: n(glavni kvant), l(orbitalni), m l(magnetski) i s(vrtnja):
|
Podnivo |
||||
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Koji element četvrte periode - krom ili selen - ima izraženija metalna svojstva? Zapiši njihove elektronske formule. |
| Odgovor | Zapišimo elektroničke konfiguracije osnovnog stanja kroma i selena: 24 Cr 1 s 2 2s 2 2str 6 3s 2 3str 6 3 d 5 4 s 1 ; 34 Se 1 s 2 2s 2 2str 6 3s 2 3str 6 3d 10 4 s 2 4 str 4 . Metalna svojstva su izraženija kod selena nego kod kroma. Istinitost ove tvrdnje može se dokazati korištenjem Periodnog zakona, prema kojem se, kada se kreće u skupini od vrha prema dolje, metalna svojstva elementa povećavaju, a nemetalna se smanjuju, što je zbog činjenice da kada krećući se niz grupu u atomu, povećava se broj elektronskih slojeva u atomu, zbog čega valentne elektrone slabije drži jezgra. |