Primjena struje u tekućinama. Električna struja u tekućinama: njezino podrijetlo, kvantitativne i kvalitativne karakteristike. električna struja u otopini. elektroliti
Svima je poznata definicija električne struje. Predstavlja se kao usmjereno gibanje nabijenih čestica. Takvo kretanje u različitim sredinama ima temeljne razlike. Kao osnovni primjer ovog fenomena može se zamisliti tok i širenje električne struje u tekućinama. Takve pojave karakteriziraju različita svojstva i ozbiljno se razlikuju od uređenog kretanja nabijenih čestica, koje se događa u normalnim uvjetima, a ne pod utjecajem različitih tekućina.
Slika 1. Električna struja u tekućinama. Author24 - online razmjena studentskih radova
Stvaranje električne struje u tekućinama
Unatoč činjenici da se proces provođenja električne struje provodi pomoću metalnih uređaja (vodiča), struja u tekućinama ovisi o kretanju nabijenih iona koji su iz nekog specifičnog razloga stekli ili izgubili takve atome i molekule. Pokazatelj takvog kretanja je promjena svojstava određene tvari, gdje prolaze ioni. Dakle, potrebno je osloniti se na osnovnu definiciju električne struje kako bi se formirao specifičan koncept nastanka struje u različitim tekućinama. Utvrđeno je da razgradnja negativno nabijenih iona doprinosi kretanju u područje izvora struje s pozitivnim vrijednostima. Pozitivno nabijeni ioni u takvim će se procesima kretati u suprotnom smjeru – do negativnog izvora struje.
Tekući vodiči podijeljeni su u tri glavne vrste:
- poluvodiči;
- dielektrici;
- provodnici.
Definicija 1
Elektrolitička disocijacija je proces razgradnje molekula određene otopine na negativno i pozitivno nabijene ione.
Može se ustanoviti da električna struja u tekućinama može nastati nakon promjene sastava i kemijskih svojstava korištenih tekućina. To je potpuno proturječno teoriji širenja električne struje na druge načine kada se koristi konvencionalni metalni vodič.
Faradayevi pokusi i elektroliza
Protok električne struje u tekućinama proizvod je gibanja nabijenih iona. Problemi povezani s pojavom i širenjem električne struje u tekućinama doveli su do proučavanja poznatog znanstvenika Michaela Faradayja. Uz pomoć brojnih praktičnih studija uspio je pronaći dokaze da masa tvari koja se oslobađa tijekom elektrolize ovisi o količini vremena i električne energije. U ovom slučaju važno je vrijeme tijekom kojeg su eksperimenti provedeni.
Znanstvenik je također uspio otkriti da je u procesu elektrolize, kada se oslobodi određena količina tvari, potrebna ista količina električnih naboja. Ta je veličina točno utvrđena i fiksirana u konstantnoj vrijednosti, koja je nazvana Faradayev broj.
U tekućinama električna struja ima različite uvjete širenja. U interakciji je s molekulama vode. Oni značajno ometaju svako kretanje iona, što nije uočeno u eksperimentima s konvencionalnim metalnim vodičem. Iz ovoga proizlazi da stvaranje struje tijekom elektrolitičkih reakcija neće biti tako veliko. Međutim, kako temperatura otopine raste, vodljivost se postupno povećava. To znači da se napon električne struje povećava. Također u procesu elektrolize, uočeno je da se povećava vjerojatnost da se određena molekula razgradi na negativne ili pozitivne ionske naboje zbog velikog broja molekula korištene tvari ili otapala. Kada je otopina zasićena ionima iznad određene norme, događa se obrnuti proces. Vodljivost otopine ponovno počinje opadati.
Trenutno je proces elektrolize pronašao svoju primjenu u mnogim područjima i područjima znanosti te u proizvodnji. Industrijska poduzeća ga koriste u proizvodnji ili obradi metala. Elektrokemijske reakcije su uključene u:
- elektroliza soli;
- galvanizacija;
- poliranje površine;
- drugi redoks procesi.
Električna struja u vakuumu i tekućinama
Širenje električne struje u tekućinama i drugim medijima prilično je složen proces koji ima svoje karakteristike, značajke i svojstva. Činjenica je da u takvim medijima potpuno nema naboja u tijelima, pa se obično nazivaju dielektricima. Glavni cilj istraživanja bio je stvoriti takve uvjete pod kojima bi atomi i molekule mogli započeti svoje kretanje i započeti proces generiranja električne struje. Za to je uobičajeno koristiti posebne mehanizme ili uređaje. Glavni element takvih modularnih uređaja su vodiči u obliku metalnih ploča.
Za određivanje glavnih parametara struje potrebno je koristiti poznate teorije i formule. Najčešći je Ohmov zakon. Djeluje kao univerzalna amperska karakteristika, gdje je implementiran princip strujno-naponske ovisnosti. Podsjetimo da se napon mjeri u jedinicama ampera.
Za pokuse s vodom i solju potrebno je pripremiti posudu sa slanom vodom. To će dati praktičan i vizualni prikaz procesa koji se događaju kada se električna struja stvara u tekućinama. Također, instalacija bi trebala sadržavati pravokutne elektrode i izvore napajanja. Za potpunu pripremu za eksperimente morate imati ampersku instalaciju. Pomoći će provesti energiju od izvora napajanja do elektroda.
Metalne ploče će djelovati kao vodiči. Urone se u korištenu tekućinu, a zatim se spoji napon. Kretanje čestica počinje odmah. Radi nasumično. Kada se između vodiča pojavi magnetsko polje, cijeli proces kretanja čestica je uređen.
Ioni počinju mijenjati naboje i spajati se. Tako katode postaju anode, a anode katode. U ovom procesu postoji i nekoliko drugih važnih čimbenika koje treba uzeti u obzir:
- razina disocijacije;
- temperatura;
- električni otpor;
- korištenje izmjenične ili istosmjerne struje.
Na kraju pokusa na pločama se formira sloj soli.
U tekućine koje su vodiči spadaju taline i otopine elektrolita, t.j. soli, kiseline i lužine.
Kada se elektroliti otapaju u vodi, njihove se molekule raspadaju na ione – elektrolitička disocijacija. Stupanj disocijacije, t.j. udio molekula u otopljenoj tvari koje su se raspale na ione ovisi o temperaturi, koncentraciji otopine i električnim svojstvima otapala. S povećanjem temperature povećava se stupanj disocijacije i, posljedično, povećava se koncentracija pozitivno i negativno nabijenih iona. Ioni različitih predznaka, pri susretu, mogu se ponovno ujediniti u neutralne molekule. Taj se proces naziva rekombinacija. U konstantnim uvjetima u otopini se uspostavlja dinamička ravnoteža pri kojoj je broj molekula koje se u sekundi raspadaju na ione jednak broju parova iona koji se u isto vrijeme rekombiniraju u neutralne molekule.
Dakle, slobodni nosioci naboja u vodljivim tekućinama su pozitivni i negativni ioni. Ako se elektrode spojene na izvor struje stave u tekućinu, tada će se ti ioni početi kretati. Jedna od elektroda spojena je na negativni pol izvora struje - zove se katoda - druga je spojena na pozitivni - anodu. Kada su spojeni na izvor struje, ioni u otopini elektrolita, negativni ioni počinju se kretati prema pozitivnoj elektrodi (anodi), a pozitivni ioni prema negativnoj (katodi). To jest, uspostavlja se električna struja. Takva vodljivost u tekućinama naziva se ionska, budući da su ioni nosioci naboja.
Kada struja prolazi kroz otopinu elektrolita na elektrodama, oslobađa se tvar povezana s redoks reakcijama. Na anodi negativno nabijeni ioni doniraju svoje dodatne elektrone (oksidativna reakcija), a na katodi pozitivni ioni prihvaćaju nedostajuće elektrone (reakcija redukcije). Taj se proces naziva elektroliza.
Tijekom elektrolize na elektrodama se oslobađa tvar. Ovisnost mase oslobođene tvari m o jačini struje, vremenu prolaska struje i same tvari ustanovio je M. Faraday. Ovaj zakon se može dobiti teoretski. Dakle, masa oslobođene tvari jednaka je umnošku mase jednog iona m i s brojem iona N i koji su stigli do elektrode za vrijeme Dt. Masa iona, prema formuli za količinu tvari, jednaka je m i \u003d M / N a, gdje je M molarna masa tvari, N a Avogadrova konstanta. Broj iona koji su stigli do elektrode je N i =Dq/qi, gdje je Dq naboj koji je prošao kroz elektrolit za vrijeme Dt (Dq=I*Dt), qi je naboj iona koji je određen valencijom atoma (qi = n*e, gdje je n valencija atoma, e je elementarni naboj). Zamjenom ovih formula dobivamo da je m=M/(neN a)*IDt. Označimo li s k (faktor proporcionalnosti) =M/(neN a), tada imamo m=kIDt. Ovo je matematički zapis prvog Faradayeva zakona, jednog od zakona elektrolize. Masa tvari koja se oslobađa na elektrodi tijekom vremena Dt tijekom prolaska električne struje proporcionalna je jačini struje i tom vremenskom intervalu. Vrijednost k naziva se elektrokemijski ekvivalent dane tvari, koji je brojčano jednak masi tvari oslobođene na elektrodama tijekom prijenosa naboja od 1 C ionima. [k]= 1 kg/C. k = M/(neN a) = 1/F*M/n , gdje je F Faradayeva konstanta. F \u003d eN a \u003d 9,65 * 10 4 C / mol. Izvedena formula k=(1/F)*(M/n) je drugi Faradayev zakon.
Elektroliza se široko koristi u inženjerstvu u različite svrhe, na primjer, površina jednog metala je prekrivena tankim slojem drugog (niklanje, kromiranje, bakreno prevlačenje itd.). Ako se osigura dobro ljuštenje elektrolitičke prevlake s površine, može se dobiti kopija topografije površine. Taj se proces naziva galvanizacija. Također, pomoću elektrolize, metali se pročišćavaju od nečistoća, na primjer, debeli listovi nerafiniranog bakra dobivenog iz rude stavljaju se u kadu kao anoda. Tijekom elektrolize, bakar se otapa, nečistoće padaju na dno, a čisti bakar se taloži na katodi. Uz pomoć elektrolize dobivaju se i elektroničke ploče. Tanki složeni uzorak spojnih žica zalijepi se na dielektrik, zatim se ploča stavlja u elektrolit, gdje se nepokrivena područja bakrenog sloja urezuju. Nakon toga, boja se ispere i na ploči se pojavljuju detalji mikrosklopa.
Tekućine, kao i čvrste tvari, mogu biti vodiči, poluvodiči i dielektrici. U ovoj lekciji ćemo se usredotočiti na tekuće vodiče. I to ne o tekućinama s elektronskom vodljivošću (rastopljeni metali), već o tekućim vodičima druge vrste (otopine i taline soli, kiselina, baza). Vrsta vodljivosti takvih vodiča je ionska.
Definicija. Vodiči druge vrste su oni vodiči u kojima se pri strujanju odvijaju kemijski procesi.
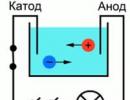
Za bolje razumijevanje procesa provođenja struje u tekućinama, može se prikazati sljedeći pokus: Dvije elektrode spojene na izvor struje stavljene su u kadu s vodom, a kao indikator struje u strujnom krugu može se uzeti žarulja. Ako zatvorite takav krug, lampa neće gorjeti, što znači da nema struje, što znači da je došlo do prekida u krugu, a sama voda ne provodi struju. Ali ako stavite određenu količinu soli u kupaonicu i ponovite krug, svjetlo će se upaliti. To znači da su se slobodni nosači naboja, u ovom slučaju ioni, počeli kretati u kadi između katode i anode (slika 1.).

Riža. 1. Shema iskustva
Vodljivost elektrolita
Odakle dolaze besplatni troškovi u drugom slučaju? Kao što je spomenuto u jednoj od prethodnih lekcija, neki dielektrici su polarni. Voda ima upravo iste polarne molekule (slika 2).

Riža. 2. Polaritet molekule vode
Kada se u vodu doda sol, molekule vode su orijentirane na takav način da su njihovi negativni polovi blizu natrija, pozitivni - blizu klora. Kao rezultat interakcije između naboja, molekule vode razbijaju molekule soli u parove suprotnih iona. Natrijev ion ima pozitivan naboj, ion klora ima negativan naboj (slika 3.). Upravo ti ioni će se kretati između elektroda pod djelovanjem električnog polja.

Riža. 3. Shema stvaranja slobodnih iona
Kad se natrijevi ioni približe katodi, ona prima elektrone koji joj nedostaju, dok kloridni ioni odustaju od svojih kada dođu do anode.
Elektroliza
Budući da je protok struje u tekućinama povezan s prijenosom tvari, s takvom strujom odvija se proces elektrolize.
Definicija. Elektroliza je proces povezan s redoks reakcijama u kojima se tvar oslobađa na elektrodama.
Tvari koje kao rezultat takvog cijepanja osiguravaju ionsku vodljivost nazivaju se elektroliti. Ovaj naziv je predložio engleski fizičar Michael Faraday (slika 4).
Elektroliza omogućuje dobivanje tvari u dovoljno čistom obliku iz otopina, stoga se koristi za dobivanje rijetkih materijala, kao što su natrij, kalcij... u čistom obliku. To je ono što je poznato kao elektrolitička metalurgija.
Faradayevi zakoni
U prvom djelu o elektrolizi 1833. Faraday je predstavio svoja dva zakona elektrolize. U prvom se radilo o masi tvari koja se oslobađa na elektrodama:
Prvi Faradayev zakon kaže da je ta masa proporcionalna naboju koji prolazi kroz elektrolit:
Ovdje ulogu koeficijenta proporcionalnosti igra količina - elektrokemijski ekvivalent. Ovo je tablična vrijednost koja je jedinstvena za svaki elektrolit i njegova je glavna karakteristika. Dimenzija elektrokemijskog ekvivalenta:
![]()
Fizičko značenje elektrokemijskog ekvivalenta je masa koja se oslobađa na elektrodi kada količina električne energije u 1 C prođe kroz elektrolit.
Ako se prisjetite formula iz teme istosmjerne struje:
Tada možemo predstaviti Faradayev prvi zakon u obliku:
Faradayev drugi zakon izravno se odnosi na mjerenje elektrokemijskog ekvivalenta kroz druge konstante za određeni elektrolit:
Ovdje je: molarna masa elektrolita; - elementarni naboj; - valencija elektrolita; je Avogadrov broj.
Vrijednost se naziva kemijski ekvivalent elektrolita. Odnosno, da bi se poznavao elektrokemijski ekvivalent, dovoljno je poznavati kemijski ekvivalent, preostale komponente formule su svjetske konstante.
Na temelju drugog Faradayeva zakona, prvi zakon se može predstaviti kao:
![]()
Faraday je predložio terminologiju tih iona na temelju elektrode na koju se kreću. Pozitivni ioni nazivaju se kationi jer se kreću prema negativno nabijenoj katodi, negativni naboji se nazivaju anionima dok se kreću prema anodi.
Gornje djelovanje vode da razbije molekulu na dva iona naziva se elektrolitička disocijacija.
Osim otopina, taline mogu biti i vodiči druge vrste. U ovom slučaju, prisutnost slobodnih iona postiže se činjenicom da vrlo aktivna molekularna kretanja i vibracije počinju na visokoj temperaturi, uslijed čega se molekule raspadaju na ione.
Praktična primjena elektrolize
Prva praktična primjena elektrolize dogodila se 1838. godine od strane ruskog znanstvenika Jacobija. Uz pomoć elektrolize dobio je otisak figura za Izakova katedralu. Ova primjena elektrolize naziva se galvanizacija. Drugo područje primjene je galvanizacija - prekrivanje jednog metala drugim (kromiranje, niklanje, pozlata, itd., sl. 5)
- Fatyf.narod.ru ().
- ChemiK ().
- Ens.tpu.ru ().
Domaća zadaća
- Što su elektroliti?
- Koje su dvije bitno različite vrste tekućina u kojima može teći električna struja?
- Koji su mogući mehanizmi za stvaranje slobodnih nositelja naboja?
- *Zašto je masa oslobođena na elektrodi proporcionalna naboju?
« Fizika - 10. razred
Koji su nosioci električne struje u vakuumu?
Kakva je priroda njihova kretanja?
Tekućine, poput krutih tvari, mogu biti dielektrici, vodiči i poluvodiči. Dielektrici uključuju destiliranu vodu, vodiče - otopine i taline elektrolita: kiseline, lužine i soli. Tekući poluvodiči su rastaljeni selen, sulfidne taline itd.
elektrolitička disocijacija.
Kada se elektroliti otapaju pod utjecajem električnog polja polarnih molekula vode, molekule elektrolita se razlažu na ione.
Raspad molekula na ione pod utjecajem električnog polja polarnih molekula vode naziva se elektrolitička disocijacija.
Stupanj disocijacije- udio molekula u otopljenoj tvari koje su se raspale na ione.
Stupanj disocijacije ovisi o temperaturi, koncentraciji otopine i električnim svojstvima otapala.
S povećanjem temperature povećava se stupanj disocijacije i, posljedično, povećava se koncentracija pozitivno i negativno nabijenih iona.
Ioni različitih predznaka, pri susretu, mogu se ponovno ujediniti u neutralne molekule.
U konstantnim uvjetima u otopini se uspostavlja dinamička ravnoteža pri kojoj je broj molekula koje se u sekundi raspadaju na ione jednak broju parova iona koji se u isto vrijeme rekombiniraju u neutralne molekule.
Ionska vodljivost.
Nosioci naboja u vodenim otopinama ili talinama elektrolita su pozitivno i negativno nabijeni ioni.
Ako je posuda s otopinom elektrolita uključena u električni krug, tada će se negativni ioni početi kretati prema pozitivnoj elektrodi - anodi, a pozitivni - prema negativnoj - katodi. Kao rezultat toga, električna struja će teći kroz krug.
Vodljivost vodenih otopina ili talina elektrolita, koju provode ioni, naziva se ionska vodljivost.
Elektroliza. Uz ionsku vodljivost, prolazak struje povezan je s prijenosom tvari. Na elektrodama se oslobađaju tvari koje čine elektrolite. Na anodi negativni ioni doniraju svoje dodatne elektrone (u kemiji se to naziva oksidativna reakcija), a na katodi pozitivni ioni primaju nedostajuće elektrone (reakcija redukcije).
Tekućine također mogu imati elektronsku vodljivost. Takvu vodljivost posjeduju, na primjer, tekući metali.
Proces oslobađanja tvari na elektrodi, povezan s redoks reakcijama, naziva se elektroliza.
Što određuje masu tvari koja se oslobađa u određenom vremenu? Očito, masa m oslobođene tvari jednaka je umnošku mase m 0i jednog iona s brojem N i iona koji su stigli do elektrode za vrijeme Δt:
m = m 0i N i . (16.3)
Masa iona m 0i je:
gdje je M molarna (ili atomska) masa tvari, a N A Avogadrova konstanta, tj. broj iona u jednom molu.
Broj iona koji dospiju do elektrode je
gdje je Δq = IΔt naboj koji je prošao kroz elektrolit tijekom vremena Δt; q 0i je naboj iona, koji je određen valencijom n atoma: q 0i \u003d ne (e je elementarni naboj). Tijekom disocijacije molekula, na primjer KBr, koje se sastoje od jednovalentnih atoma (n = 1), pojavljuju se ioni K + i Br -. Disocijacija molekula bakrenog sulfata dovodi do pojave dvostruko nabijenih iona Cu 2+ i SO 2- 4 (n = 2). Zamjenom izraza (16.4) i (16.5) u formulu (16.3) i uzimajući u obzir da je Δq = IΔt, a q 0i = ne, dobivamo
Faradayev zakon.
Označimo s k koeficijent proporcionalnosti između mase m tvari i naboja Δq = IΔt koji prolazi kroz elektrolit:
gdje je F \u003d eN A \u003d 9,65 10 4 C / mol - Faradayeva konstanta.
Koeficijent k ovisi o prirodi tvari (vrijednosti M i n). Prema formuli (16.6) imamo
m = kIΔt. (16.8)
Faradayev zakon elektrolize:
Masa tvari koja se oslobađa na elektrodi tijekom vremena Δt. tijekom prolaska električne struje, proporcionalna je jačini struje i vremenu.
Ovu tvrdnju, dobivenu teoretski, prvi je eksperimentalno ustanovio Faraday.
Vrijednost k u formuli (16.8) se zove elektrokemijski ekvivalent danu supstancu i izraženu u kilograma po privjesku(kg/C).
Iz formule (16.8) se vidi da je koeficijent k brojčano jednak masi tvari koja se oslobađa na elektrodama tijekom prijenosa naboja od 1 C ionima.

Elektrokemijski ekvivalent ima jednostavno fizičko značenje. Budući da je M / N A \u003d m 0i i en \u003d q 0i, onda prema formuli (16.7) k = rn 0i / q 0i, tj. k je omjer mase iona i njegovog naboja.
Mjerenjem vrijednosti m i Δq mogu se odrediti elektrokemijski ekvivalenti raznih tvari.
Valjanost Faradayeva zakona možete provjeriti iskustvom. Sastavimo instalaciju prikazanu na slici (16.25). Sve tri elektrolitičke kupke napunjene su istom otopinom elektrolita, ali su struje koje prolaze kroz njih različite. Označimo jačinu struja kroz I1, I2, I3. Tada je I 1 = I 2 + I 3 . Mjerenjem masa m 1 , m 2 , m 3 tvari koje se oslobađaju na elektrodama u različitim kupkama može se uvjeriti da su one proporcionalne odgovarajućim strujama I 1 , I 2 , I 3 .
Određivanje naboja elektrona.
Formula (16.6) za masu tvari oslobođene na elektrodi može se koristiti za određivanje naboja elektrona. Iz ove formule slijedi da je modul naboja elektrona jednak:
Znajući masu m oslobođene tvari tijekom prolaska naboja IΔt, molarnu masu M, valenciju n atoma i Avogadrovu konstantu N A, može se pronaći vrijednost modula naboja elektrona. Ispada da je jednako e = 1,6 10 -19 C.
Na taj je način prvi put dobivena vrijednost elementarnog električnog naboja 1874. godine.
Primjena elektrolize. Elektroliza se široko koristi u strojarstvu u različite svrhe. Elektrolitički prekriti površinu jednog metala tankim slojem drugog ( nikliranje, kromiranje, pozlaćivanje itd.). Ovaj izdržljivi premaz štiti površinu od korozije. Ako se osigura dobro ljuštenje elektrolitičke prevlake s površine na koju se metal taloži (to se postiže npr. nanošenjem grafita na površinu), tada se može dobiti kopija s reljefne površine.
Postupak dobivanja premaza koji se može ljuštiti - elektrotipija- razvio ga je ruski znanstvenik B. S. Jacobi (1801.-1874.), koji je 1836. primijenio ovu metodu za izradu šupljih figura za katedralu sv. Izaka u Sankt Peterburgu.
Prije su se u tiskarstvu kopije s reljefne površine (stereotipi) dobivale iz matrica (otisak garniture na plastičnom materijalu), za koje se na matrice nanosio debeli sloj željeza ili neke druge tvari. To je omogućilo reprodukciju kompleta u potrebnom broju primjeraka.
Elektroliza uklanja nečistoće iz metala. Tako se sirovi bakar dobiven iz rude lijeva u obliku debelih limova, koji se zatim stavljaju u kadu kao anode. Tijekom elektrolize, anodni bakar se otapa, nečistoće koje sadrže vrijedne i rijetke metale padaju na dno, a čisti bakar se taloži na katodi.
Aluminij se dobiva iz rastaljenog boksita elektrolizom. Upravo je ovaj način dobivanja aluminija učinio jeftinim i uz željezo najčešćim u tehnici i svakodnevnom životu.
Uz pomoć elektrolize dobivaju se elektroničke ploče koje služe kao osnova svih elektroničkih proizvoda. Na dielektrik je zalijepljena tanka bakrena ploča, na koju se posebnom bojom nanosi složen uzorak spojnih žica. Zatim se ploča stavlja u elektrolit, gdje se urezuju područja bakrenog sloja koja nisu prekrivena bojom. Nakon toga, boja se ispere, a na ploči se pojavljuju detalji mikrosklopa.
Električna struja u tekućinama uzrokovana je kretanjem pozitivnih i negativnih iona. Za razliku od struje u vodičima gdje se kreću elektroni. Dakle, ako u tekućini nema iona, onda je to dielektrik, na primjer, destilirana voda. Budući da su nositelji naboja ioni, odnosno molekule i atomi tvari, kada električna struja prolazi kroz takvu tekućinu, to će neminovno dovesti do promjene kemijskih svojstava tvari.
Odakle dolaze pozitivni i negativni ioni u tekućini? Recimo odmah da se nosači naboja ne mogu formirati u svim tekućinama. Oni u kojima se pojavljuju nazivaju se elektroliti. To uključuje otopine soli kiselina i lužina. Kada otapate sol u vodi, na primjer, uzmite kuhinjsku sol NaCl, razgrađuje se pod djelovanjem otapala, odnosno vode u pozitivan ion Na naziva se kation i negativni ion Cl naziva anion. Proces stvaranja iona naziva se elektrolitička disocijacija.
Provedimo eksperiment, za njega nam je potrebna staklena žarulja, dvije metalne elektrode, ampermetar i izvor istosmjerne struje. Tikvicu napunimo otopinom kuhinjske soli u vodi. Zatim u ovu otopinu stavljamo dvije pravokutne elektrode. Elektrode spajamo na izvor istosmjerne struje kroz ampermetar.
Slika 1 - Tikvica s otopinom soli
Kad se između ploča uključi struja, pojavit će se električno polje pod čijim će se djelovanjem početi kretati ioni soli. Pozitivni ioni će juriti na katodu, a negativni ioni na anodu. Istovremeno će napraviti kaotičan pokret. Ali istovremeno će mu se pod djelovanjem polja dodati i naručeno.
Za razliku od vodiča u kojima se kreću samo elektroni, odnosno jedna vrsta naboja, u elektrolitima se kreću dvije vrste naboja. To su pozitivni i negativni ioni. Kreću jedno prema drugome.
Kada pozitivni natrijev ion dođe do katode, dobit će elektron koji nedostaje i postati atom natrija. Sličan proces će se dogoditi s ionom klora. Tek kada dođe do anode, ion klora će odustati od elektrona i pretvoriti se u atom klora. Dakle, struja se održava u vanjskom krugu zbog kretanja elektrona. A u elektrolitu se čini da ioni prenose elektrone s jednog pola na drugi.
Električni otpor elektrolita ovisi o količini nastalih iona. U jakim elektrolitima, razina disocijacije je vrlo visoka kada su otopljeni. Slabi su niski. Također, na električni otpor elektrolita utječe temperatura. S njegovim povećanjem, viskoznost tekućine se smanjuje, a teški i nespretni ioni počinju se kretati brže. Sukladno tome, otpor se smanjuje.
Ako se otopina soli zamijeni otopinom bakrenog sulfata. Zatim, kada kroz njega prođe struja, kada bakreni kation dođe do katode i tamo primi elektrone koji nedostaju, bit će vraćen u atom bakra. A ako nakon toga uklonite elektrodu, na njoj možete pronaći naslage bakra. Taj se proces naziva elektroliza.