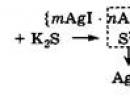Koagulacija i čimbenici koji je uzrokuju. Schulze-Hardyjevo pravilo. Važnost procesa koagulacije za život organizama. Koagulacija koloidnih sustava Biološki značaj koagulacije
Liofobne koloidne otopine, kao termodinamički nestabilni sustavi, mogu kolabirati spontano ili pod utjecajem vanjskih utjecaja. Razgradnja koloidnih otopina počinje njihovom koagulacijom.
Zgrušavanje je proces agregacije koloidnih čestica uz stvaranje većih agregata zbog gubitka agregativne stabilnosti koloidnom otopinom.
Uslijed koagulacije, uvećane čestice disperzne faze lako se talože i dolazi do raslojavanja sustava. Dakle, uzrok koagulacije je gubitak agregativne stabilnosti koloidne otopine, a posljedica koagulacije je smanjenje njezine sedimentacijske stabilnosti.
U praksi koagulaciju mogu izazvati različiti vanjski utjecaji: dodavanje male količine elektrolita, koncentriranje koloidne otopine, promjena temperature, izlaganje ultrazvuku, elektromagnetskom polju itd.
Fenomen koagulacije je temelj mnogih patoloških procesa koji se odvijaju u živim sustavima. Koagulacija koloidnih otopina kalcijevog fosfata i kolesterola u krvi dovodi do stvaranja taloga i njihovog taloženja na unutarnjoj površini krvnih žila (aterosklerotične promjene na krvnim žilama).
Koagulacija se javlja tijekom procesa zgrušavanja krvi. Zgrušavanje krvi ima dvije suprotne uloge u tijelu: s jedne strane, smanjuje gubitak krvi pri oštećenju tkiva, s druge strane, uzrokuje stvaranje krvnih ugrušaka u krvožilnom sustavu. Zgrušavanje krvi je vrlo složen enzimski proces. Istodobno u krvi djeluje antikoagulacijski sustav čija je osnova heparin, antikoagulant krvi.
Prilikom čuvanja mora se voditi računa o prirodi krvi. Budući da kalcijevi kationi pospješuju zgrušavanje krvi, oni se različitim fizikalno-kemijskim metodama uklanjaju iz krvi namijenjene konzerviranju. Na primjer, dodavanjem natrijevog citrata taloži se kalcij, nakon čega se krv čuva u hladnjaku i ostaje prikladna za transfuziju 30 dana. Puna krv također se može dekalcificirati ionskom izmjenom pomoću Na-kationskih izmjenjivača.
Koagulacija pod utjecajem elektrolita. U biološkim sustavima koagulacija ima najveću praktičnu važnost pri dodavanju malih količina elektrolita, budući da su koloidne otopine stanica i biološke tekućine u kontaktu s elektrolitima. Svaki elektrolit može izazvati koagulaciju koloidne otopine. Međutim, svaki elektrolit zahtijeva svoju minimalnu koncentraciju, koja se naziva koagulacijski prag (C pc).
Koagulacijski prag je minimalna količina elektrolita koja se mora dodati koloidnoj otopini da bi se izazvala očita koagulacija (vidljiva oku) – zamućenje otopine ili promjena njezine boje. Koagulacijski prag može se izračunati pomoću formule:
gdje je Sel početna koncentracija otopine elektrolita; Vel je volumen otopine elektrolita koji se dodaje koloidnoj otopini; Vkp je volumen koloidne otopine.
Recipročna vrijednost praga koagulacije naziva se koagulacijski učinak(y): y=1/Spk
Koagulacijski učinak elektrolita na koloidne otopine s ionskim stabilizatorom podliježe Schulze-Hardyjevo pravilo: koagulaciju koloidnih otopina uzrokuju svi ioni koji imaju predznak naboja suprotan naboju granula. Što je veći naboj iona koagulansa, to je jači koagulacijski učinak iona (y).
Koagulacijski učinak iona koagulansa izravno je proporcionalan njegovom naboju na šestu potenciju: y = f(z 6). Na primjer, do koagulacije AgI sola s negativno nabijenim granulama (ioni koji određuju potencijal - anioni I -) dolazi zbog djelovanja pozitivno nabijenih iona. Stoga, kada se u ovaj sol dodaju otopine NaCl, CaCl 2, AlCl 3, koagulacijski učinak kationa Na +, Ca 2+, Al 3+ naglo će se povećati; y(Na+):y(Ca2+):y(Al3+) = 1:64:729. Koagulacija AgI sola s pozitivno nabijenim granulama (ioni koji određuju potencijal Ag +), naprotiv, događa se zbog negativno nabijenih iona. Dodavanje otopina KCl, K 2 SO 4, K 3 u sol izazvat će povećanje koagulacijskog učinka aniona sljedećim redom: y(Cl -):y(SO 4 (2-)):y 3- = 1:64:729.
Postoje odstupanja od Schulze-Hardyjevog pravila, budući da na koagulacijski učinak iona, osim naboja, utječe i polumjer iona koji koagulira, kao i priroda iona koji prati ion koagulansa.
Prilikom unošenja otopina soli u žive organizme treba uzeti u obzir jak utjecaj elektrolita na koagulaciju koloidnih otopina. U ovom slučaju nije važna samo koncentracija, već i naboj uvedenih iona. Dakle, fiziološka otopina natrijevog klorida (0,9%) ne može se zamijeniti izotoničnom otopinom magnezijevog sulfata, jer ova sol sadrži dvostruko nabijene ione Mg 2+ i SO 4 (2-), koji imaju veći koagulacijski učinak od Na + i Cl-ioni.
Kod ubrizgavanja elektrolita u mišićno tkivo ili ljudsku krv, potrebno ga je ubrizgavati postupno, polako, kako ne bi došlo do koagulacije bioloških koloidnih sustava. Brzo davanje elektrolita, zbog niske brzine difuzije u krvi ili mišićnom tkivu, dovodi do nakupljanja elektrolita, lokalnog (lokalnog) prekoračenja njegove granične koncentracije i uzrokuje koagulaciju biosupstrata, koju je teško zaustaviti. Uz polaganu primjenu, elektrolit ima vremena da se odnese krvotokom i difundira u susjedna tkiva, tako da se ne postiže granična koncentracija i ne dolazi do koagulacije. Ova pojava u živim tkivima naziva se "ovisnost".
Mehanizam koagulacije. Uloga elektrolita tijekom koagulacije je smanjenje tlaka razdvajanja između koloidnih čestica koje se približavaju. To se može dogoditi na dva načina: smanjenjem površinskog naboja krute faze (površinskog naboja jezgre), t.j. zbog smanjenja međufaznog potencijala Fmf, ili zbog smanjenja debljine (kompresije) ionskih atmosfera micela dok površinski naboj njihovih jezgri ostaje nepromijenjen. S tim u vezi, moguće su dvije vrste koagulacije: neutralizacija i koncentracija.
Neutralizacijska koagulacija nastaje pod utjecajem elektrolita, koji kemijski stupa u interakciju s ionima koji određuju potencijal, vezujući ih u jak spoj (na primjer, taloži ih) i time smanjuje naboj na površini jezgre. Neutralizacijska koagulacija opaža se npr. kada se K 2 S doda koloidnoj otopini AgI s pozitivno nabijenim granulama (ioni koji određuju potencijal - Ag + kationi). Dolazi do reakcije između koagulirajućih aniona S 2- i kationa Ag + koji određuju potencijal uz stvaranje slabo topljivog spoja Ag 2 S, što dovodi do razaranja micele AgI:

Kao rezultat vezanja kationa Ag + koji određuju potencijal, smanjuje se međufazni potencijal F mf i smanjuje se broj protuiona NO 3 (-) potrebnih za kompenzaciju naboja na površini jezgre. Dakle, ionske atmosfere oko jezgri postaju tanje, tlak razdvajanja između čestica koje se približavaju se smanjuje, a to zauzvrat dovodi do njihovog lijepljenja u veće agregate.
Koncentracijska koagulacija događa se pod utjecajem elektrolita, koji kemijski ne stupa u interakciju s ionima stabilizatora i ne mijenja površinski naboj jezgre micele. Međutim, u ovom slučaju koagulacijski učinak imaju oni ioni dodanog elektrolita, koji su protuioni za te micele, jer povećanjem svoje koncentracije prodiru u granulu, sabijajući (zgušćujući) ionsku atmosferu micele oko jezgre. . Koncentracijska koagulacija događa se pri konstantnom graničnom potencijalu F mf, ali je obično praćena smanjenjem ζ-potencijala. Koncentracijska koagulacija opaža se, na primjer, kada se nitrati dodaju u koloidnu otopinu AgI, čije micele sadrže NO 3 (-) protuione:

Kako koncentracija dodanih NO 3 (-) iona raste, oni potiču uvođenje protuiona difuznog sloja u adsorpcijski sloj. U tom je slučaju difuzni sloj komprimiran i može doći do stanja u kojem difuzni sloj potpuno nestaje, a granula postaje električki neutralna. U tom je stanju pritisak razdvajanja između čestica koje se približavaju minimalan, a to dovodi do lijepljenja čestica u veće agregate.
Budući da je naboj granula u ovim uvjetima 0, u električnom polju one ne postižu usmjereno kretanje prema elektrodama, jer je granula u izoelektričnom stanju.
Izoelektrično stanje je stanje koloidnih čestica u kojem je elektrokinetički potencijal ζ jednak 0 i koje je karakterizirano nepostojanjem usmjerenog gibanja granula u električnom polju.
U agregacijsko stabilnom stanju koloidne otopine vrijednost se kreće između 50-70 mV. Kada se ζ-potencijal smanji pod utjecajem elektrolita na 25-30 mV, u sustavu se ne opažaju nikakve vanjske promjene (zamućenje ili promjene boje), budući da je stopa koagulacije još uvijek vrlo niska, zbog čega je ova faza ( I) koagulacije naziva se "latentna" koagulacija (Sl. 6.10). Daljnje dodavanje elektrolita iznad Spk uzrokuje još veću kompresiju difuznog sloja i smanjenje ζ-potencijala, što je popraćeno zamućenjem otopine, te počinje “eksplicitna” koagulacija. U početku se brzina koagulacije brzo povećava (stadij II), a zatim postaje konstantna kada vrijednost ζ-potencijala postane nula i počinje stadij brze koagulacije (III).
Koagulacija mješavinama elektrolita. U praksi je koagulacija često uzrokovana djelovanjem mješavine elektrolita. U tom slučaju postoje tri moguće mogućnosti interakcije između elektrolita: aditivno djelovanje, antagonizam i sinergizam.
Riža. 6.10. Utjecaj koncentracije elektrolita na brzinu koagulacije
Aditivnost- ovo je zbroj koagulacijskog učinka iona koji uzrokuju koagulaciju.
Aditivni učinak javlja se u slučajevima kada elektroliti koji sadrže koagulirajuće ione međusobno kemijski ne reagiraju. Na primjer, mješavina soli KCl i NaNO3 pokazuje aditivni učinak u odnosu na koloidne otopine s negativno i pozitivno nabijenim granulama. U prvom slučaju, koagulaciju uzrokuju K + i Na + kationi, u drugom - Cl - i NO 3 (-) anioni.
Antagonizam- ovo je slabljenje koagulirajućeg učinka jednog elektrolita u prisutnosti drugog.
Pb 2+ + 2Cl - = PbCl 2 ↓
Antagonizam djelovanja opaža se u slučajevima kada se, kao rezultat kemijske reakcije između elektrolita, koagulacijski ioni vežu u netopljivi spoj (talog) ili u stabilan kompleks koji nema koagulirajuću sposobnost. Na primjer, koagulacijski učinak kationa Pb 2+ u odnosu na negativno nabijene granule slabi u prisutnosti NaCl, jer dolazi do reakcije u kojoj koncentracija koagulirajućih iona Pb 2+ u otopini opada zbog taloženja. PbCl 2:
Sinergija- ovo je povećanje koagulacijskog učinka jednog elektrolita u prisutnosti drugog.
Sinergističko djelovanje moguće je kada se između elektrolita dogodi kemijska interakcija, koja rezultira stvaranjem višestruko nabijenog iona s vrlo visokom koagulacijskom sposobnošću. Na primjer, koagulacijski učinak FeCl 3 i KCNS u odnosu na pozitivno nabijene granule (koagulirajući ioni Cl (-) i CNS -) višestruko je pojačan, jer dolazi do reakcije koja rezultira stvaranjem višestruko nabijenih 3- aniona koji pokazuju visoka sposobnost zgrušavanja:
FeCl 3 + 6KCNS → K 3 + 3KCl
Pri uporabi elektrolita u laboratorijskoj i medicinskoj praksi uvijek se mora voditi računa o mogućnosti koagulacije u biološkim medijima. Dakle, kod unošenja raznih ljekovitih tvari u organizam (u obliku injekcija) treba prvo paziti da te tvari nisu sinergisti kako bi se izbjegla moguća koagulacija. S druge strane, kod pročišćavanja industrijskih voda može biti štetan antagonizam unesenih elektrolita koji sprječava uništavanje koloidnih kontaminanata.
U prirodnim vodama, kao iu industrijskim otpadnim vodama, često dolazi do koagulacije kao rezultat miješanja disperznih sustava koji sadrže različite čestice. Heterokoagulacija zove se koagulacija koloidnih otopina koje sadrže različite čestice koje se razlikuju po kemijskoj prirodi, predznaku ili veličini naboja.
Poseban slučaj heterokoagulacije je međusobna koagulacija- sljepljivanje različito nabijenih granula koloidnih otopina. U ovom slučaju, koagulacija se događa to potpunije, što su naboji granula potpunije neutralizirani.
Heterokoagulacija se široko koristi u praksi u vezi s problemom pročišćavanja prirodnih i industrijskih voda. Vodi koja sadrži koloidne nečistoće dodaju se soli aluminija ili željeza (3), koje su dobri koagulansi. Kao rezultat hidrolize, ove soli daju slabo topljive hidrokside Al(OH) 3 ili Fe(OH) 3, tvoreći koloidne otopine s pozitivno nabijenim granulama. Kao rezultat toga dolazi do koagulacije, praćene stvaranjem ljuskica od agregiranih heterogenih micela, koje se talože.
Tijekom procesa koagulacije, povezanog s gubitkom agregatne stabilnosti, dolazi do razgradnje koloidne otopine, praćene taloženjem precipitata - koagulata. Međutim, ako se koagulumu vrati agregativna stabilnost, tada može doći do obrnutog procesa - peptizacije.
Peptizacija nazvan obrnutim procesom koagulacije – pretvorbom sedimenta nastalog kao rezultat koagulacije u stabilnu koloidnu otopinu.
Peptizacija se može provesti na dva načina, od kojih svaki dovodi do povećanja agregativne stabilnosti zbog obnove prilično labave ionske atmosfere u micelama:
· ispiranje koagulata čistim otapalom (disperzijskim medijem), što dovodi do ispiranja sustava iona koji je uzrokovao koagulaciju i labavljenja ionskih atmosfera oko čestica;
· dodavanjem posebnog elektrolita-peptizatora, čiji ioni, adsorbirani na površini čestica koagulata, obnavljaju rahlu ionsku atmosferu oko tih čestica i pridonose njihovom prijelazu u koloidno stanje.
Međutim, ne može se svaki talog dobiven koagulacijom peptizirati. Najvažniji uvjeti za učinkovitu peptizaciju su sljedeći:
· samo svježe dobiveni sedimenti sposobni su za peptizaciju, budući da povećanje trajanja međusobnog kontakta čestica dispergirane faze dovodi do postupnog zbijanja sedimenta i istiskivanja tekuće faze iz njegove strukture;
· potrebno je dodati male količine elektrolita-peptizatora, inače može ponovno doći do koagulacije;
· Peptizacija se pospješuje miješanjem i zagrijavanjem.
Proces peptizacije je temelj liječenja niza patoloških promjena u ljudskom organizmu: resorpcije aterosklerotičnih naslaga na stijenkama krvnih žila, bubrežnih i jetrenih kamenaca ili krvnih ugrušaka u krvnim žilama pod utjecajem antikoagulansa. U ovom slučaju potrebno je voditi računa o pravodobnom unosu ljekovitih tvari (antikoagulansa) u krv: stari krvni ugrušci u krvnim žilama, kao i stvrdnuti kamenci, praktički se ne peptiziraju, tj. ne otapaju se.
6.9. Grubo disperzni sustavi: suspenzije, emulzije, aerosoli
Grubo disperzni sustavi dijele se u tri skupine: emulzije, suspenzije i aerosoli.
Emulzije– to su disperzni sustavi s tekućim disperzijskim medijem i tekućom disperznom fazom.
Također se mogu podijeliti u dvije skupine:
1. direktni – kapljice nepolarne tekućine u polarnom sredstvu (ulje u vodi);
2. revers (voda u ulju).
Promjene u sastavu emulzija ili vanjski utjecaji mogu dovesti do transformacije izravne emulzije u obrnutu emulziju i obrnuto. Primjeri najpoznatijih prirodnih emulzija su mlijeko (izravna emulzija) i ulje (reverzna emulzija). Tipična biološka emulzija su kapljice masti u limfi. U kemijskoj tehnologiji emulzijska polimerizacija se široko koristi kao glavna metoda za proizvodnju guma, polistirena, polivinil acetata itd.
Suspenzije– to su grubi sustavi s čvrstom disperznom fazom i tekućim disperzijskim medijem.
Posebnu skupinu čine grubo disperzni sustavi, u kojima je koncentracija disperzne faze relativno visoka u odnosu na njezinu nisku koncentraciju u suspenzijama. Takvi disperzni sustavi nazivaju se paste. Na primjer, stomatološki, kozmetički, higijenski itd., koji su vam dobro poznati iz svakodnevnog života.
Aerosoli– to su grubo disperzni sustavi u kojima je disperzni medij zrak, a disperzna faza mogu biti kapljice tekućine (oblaci, duge, lak za kosu ili dezodorans ispušteni iz limenke) ili čestice krute tvari (oblak prašine, tornado).
Koloidni sustavi zauzimaju srednji položaj između grubih sustava i pravih otopina. Rasprostranjene su u prirodi. Tlo, glina, prirodne vode, mnogi minerali, uključujući i drago kamenje, svi su koloidni sustavi.
Koloidni sustavi od velike su važnosti za biologiju i medicinu. Sastav svakog živog organizma uključuje čvrste, tekuće i plinovite tvari koje su u složenom odnosu s okolinom. S kemijskog gledišta, tijelo kao cjelina složena je zbirka mnogih koloidnih sustava.
Koloidni sustavi se dijele na sole (koloidne otopine) i gelove (žele).
Većina bioloških tekućina stanice (citoplazma, jezgrin sok - karioplazma, sadržaj vakuola) i živog organizma u cjelini su koloidne otopine (soli).
Za sols Karakterističan je fenomen koagulacije, tj. prianjanje koloidnih čestica i njihovo taloženje. U tom se slučaju koloidna otopina pretvara u suspenziju ili gel. Neki organski koloidi koaguliraju pri zagrijavanju (bjelanjci, ljepila) ili pri promjeni kiselinsko-bazne sredine (probavni sokovi).
Gelovi su koloidni sustavi u kojima čestice disperzne faze tvore prostornu strukturu.
Gelovi su disperzni sustavi s kojima se susrećete u svakodnevnom životu.
Tijekom vremena dolazi do poremećaja strukture gelova i oslobađanja tekućine iz njih. Događa se sinereza– spontano smanjenje volumena gela, praćeno odvajanjem tekućine. Sineresis određuje rok trajanja prehrambenih, medicinskih i kozmetičkih gelova. Biološka sinereza vrlo je važna kod proizvodnje sira i svježeg sira.
Po izgledu, pravu i koloidnu otopinu teško je razlikovati jedna od druge. Da biste to učinili, koristite Tyndallov učinak– formiranje stošca “svjetleće staze” kada snop svjetlosti prolazi kroz koloidnu otopinu. Čestice disperzne faze sola svojom površinom odbijaju svjetlost, ali čestice prave otopine ne. Možete primijetiti sličan učinak, ali samo za aerosol, a ne za tekući koloid, u kinu kada zraka svjetlosti s filmske kamere prolazi kroz prašnjavi zrak gledališta.
6.10. Elektrokinetičke pojave u disperznim sustavima: elektroforeza, elektroosmoza
Električni naboj može se pojaviti na bilo kojoj čvrstoj površini koja je u kontaktu s tekućinom. Vrijednost specifičnog naboja relativno je mala: na primjer, za glinu na granici s vodom iznosi nekoliko desetaka milikulomba, pa će površina komada gline težine 1 kg, jednaka stotinkama kvadratnog metra, imati zanemariv električni naboj. Čestice gline ukupne mase 1 kg stvaraju površinu milijunima puta veću od čvrstog komada, što dovodi do naglog povećanja površinskog naboja. Pojava značajnog površinskog naboja uzrok je posebnih elektrokinetičkih pojava karakterističnih samo za disperzne sustave.
Elektrokinetičke pojave su one koje nastaju djelovanjem električnog polja na disperzne sustave i kao rezultat gibanja čestica disperzne faze ili disperzijskog medija. Unatoč razlikama u elektrokinetičkim pojavama, svi su povezani s prisutnošću dvostrukog električnog sloja i određeni su ζ-potencijalom, zbog čega se nazivaju elektrokinetičkim.
Vanjsko električno polje uzrokuje takve elektrokinetičke pojave disperziranih sustava kao što su elektroforeza i elektroosmoza.
elektroforeza je kretanje čestica disperzne faze u odnosu na disperzijsko sredstvo pod utjecajem električnog polja. Shema elektroforeze prikazana je na sl. 6.11, gdje je čestica dispergirane faze prikazana u uvećanom mjerilu radi jasnoće. Kada se nanese vanjsko električno polje, čestice disperzne faze počinju se kretati prema elektrodi, predznak naboja je suprotan predznaku ζ-potencijala; Smjer gibanja čestica na slici je prikazan strelicom.
Kretanje čestica tijekom elektroforeze nastaje zbog privlačenja različitih naboja. Difuzni sloj ne sprječava međudjelovanje različitih naboja. Protuioni u ovom sloju su pokretni, neravnomjerno raspoređeni i nisu u stanju zaštititi učinak vanjskog električnog polja na čestice disperzne faze. Kretanje čestica događa se duž granice klizanja.
Tijekom elektroforeze narušava se sferna simetrija difuznog sloja protuiona i on se počinje kretati u smjeru suprotnom od kretanja čestica. Suprotno usmjeren tok čestica u difuznom sloju usporava kretanje čestica. Taj se učinak naziva elektroforetska inhibicija (kratka strelica na slici 6.11).

Riža. 6.11. Shema elektroforeze:
Tijekom elektroforeze čestice disperzne faze gibaju se u smjeru linija električnog polja. Elektroforezom se dobivaju novi materijali, nanose prevlake, pročišćavaju tvari od nečistoća i izoliraju proizvodi. U medicini se elektroforeza koristi za davanje lijekova. Tampon navlažen otopinom lijeka stavlja se na kožu pacijenta, a na vrh se postavljaju elektrode na koje se primjenjuje nizak potencijal koji je siguran za tijelo. Tijekom ovog postupka čestice lijeka se pod utjecajem električnog polja prenose u tkiva ljudskog tijela.
Elektroosmoza naziva se kretanje disperzijskog medija pod utjecajem vanjskog električnog polja (sl. 6.12). Gibanje disperzijskog medija uzrokovano je privlačenjem različitih naboja. Često se javlja u kapilarama i kanalima poroznih tijela. Kada je ζ potencijal negativan, pozitivno nabijeni protuioni u difuznom sloju privlače negativnu elektrodu. Protuioni nose sa sobom tekućinu koja čini disperzijski medij. Kao rezultat toga dolazi do kretanja tekućine, a kretanje tekućeg disperzijskog medija u odnosu na čestice disperzne faze, kao u slučaju elektroforeze, događa se duž granice klizanja.

Riža. 6.12. Krug elektroosmoze
1 - raspršeni sustav; 2 - pregrada
Elektroosmoza se koristi npr. za dehidraciju drva i drugih poroznih materijala: građevinskih materijala, zemlje, hrane, sirovina za prehrambenu industriju itd. Mokra masa se postavlja između elektroda, a voda, ovisno o strukturi DEL, prelazi u jedan od njih i skuplja se u poseban spremnik.
Za provođenje elektroforeze ili elektroosmoze potrebno je vanjsko električno polje, tj. kretanje čestica tijekom elektroforeze ili medija tijekom elektroosmoze posljedica je utjecaja ovog polja.
Treba napomenuti da je pojava elektroforeze karakteristična uglavnom za koloidne otopine (solove), tj. za sustave u kojima veličina čestica disperzne faze ne prelazi 0,1 mikrona. Elektroosmoza se može uočiti ne samo u odnosu na koloidne otopine, koje su visoko disperzni sustavi, već i u odnosu na srednje i grubo disperzne sustave.
Teorija koagulacije koloidnih otopina s elektrolitima prilično je složena. Trenutno mehanizam koagulacije predstavite to na ovaj način: razmotrite to na primjeru koagulacije sola arsenovog sulfida pod djelovanjem elektrolita magnezijevog sulfata: (m(As 2 S 3)n S 2- (2n-x)H + ) X – xH +
MgSO 4 → Mg 2+ + SO 4 2-
1. Ioni - koagulanti, Mg 2+, suprotno nabijeni u odnosu na zrnce, privlače ga.
2. Na putu se nalaze jednako nabijeni ioni difuznog sloja, koji se odbijaju u granulu.
3. Kada se svih x iona difuzijskog sloja pomakne u granulu, ona gubi naboj - difuzijski sloj je komprimiran u adsorpcijski sloj.
4. Stanje sola, kada je naboj granule nula, naziva se izoelektrični, IES. Ovo je najnestabilnije stanje sol.
5. Kompresija difuzijskog sloja dovodi do gubitka hidratacijske ljuske. U tom slučaju nestaje rastavljajući tlak i dolazi do koagulacije.
6. Ioni koagulansa sami ulaze u granulu, neutraliziraju njen naboj i time ubrzavaju koagulaciju.
Testni zadaci za samokontrolu na temu
"Koloidni sustavi"
1. Koja izjava suvišan: koloidne čestice veličine 10 -9 - 10 -7 m toliko su male da:
1) nije vidljivo kroz mikroskop; 2) ne talože se pod utjecajem gravitacije;
3) proći kroz filter; 4) prolaze kroz membranu
5) raspršeno svjetlo.
2. Metodama dobivanja koloidnih otopina
A. Disperzivni; B. Kondenzacija uključuje:
1) mljevenje u kuglastim i koloidnim mlinovima;
2) peptizacija;
3) metoda zamjene otapala;
4) reakcije hidrolize soli;
3. Koja izjava suvišan: uvjeti za nastanak koloidnih otopina su:
1) dobivanje čestica veličine 10 -9 – 10 -7 m;
2) netopljivost disperzne faze u mediju;
3) visoko razrjeđenje;
4) prisutnost stabilizatora;
5) visoka temperatura.
4. Koloidne otopine možemo razlikovati od pravih:
1) zamućenjem;
2) stvaranjem Faraday-Tyndallovog stošca;
3) električnom vodljivošću
5. Višak elektrolita pri pripravi koloidnih otopina reakcijom kemijske izmjene nastaje:
1) jedinica; 4) difuzni sloj;
2) granula; 5) adsorpcijski sloj;
3) micel; 6) električni dvoslojni (EDL).
6. Redoslijed rasporeda komponenti stabilizatora u koloidnoj čestici:
a) difuzni sloj; b) protuioni; c) ioni koji određuju potencijal.
1) a, b, c; 2) b,a,c; 3) c, a, b; 4) c, b, a.
7. Prema Paneth-Fajansovom pravilu, na površini agregata dobivenog reakcijom: LiNO 3 + NaF = LiF¯ + NaNO 3 može se adsorbirati:
1) Li+; 2) NE 3-; 3) Na+; 4) F - .
8. Navedite stabilizatorske ione koji određuju potencijal u micelama koloidne otopine Ni(OH) 2 dobivene reakcijom izmjene.
NiCl 2 + NaOH u suvišku lužine:
1) Ni2+; 2) Cl -; 3) Na+; 4) OH - ; 5) H+.
9. Koagulacija sol olovnog sulfata dobivenog reakcijom:
Pb(NO 3) 2 + H 2 SO 4 = PbSO 4 ¯ + 2HNO 3, uzrokuju katione. Njegov ion koji određuje potencijal je:
1)Pb 2+; 2) NE 3 - ; 3) H+; 4) SO 4 2-.
10. Micela sola živinog (II) sulfida dobivena u suvišku sumporovodika ima granularni naboj:
1) +; 2) –; 3) 0.
11. Koloidna otopina CuS dobivena reakcijom izmjene: CuCl 2 + H 2 S ® CuS¯ + 2HCl, stabilizirana bakrovim (II) kloridom ima:
1) granula s nabojem "+"; 4) micel s nabojem "+"
2) granula s nabojem "-"; 5) micel s nabojem "-"
3) granula s nabojem "0"; 6) micel s nabojem "0".
12. Osmotski tlak koloidnih otopina u usporedbi s pravim pri istoj masenoj koncentraciji disperzne faze:
1) veći zbog velike veličine čestica;
2) niža zbog velike veličine čestica i niske koncentracije;
3) isti, zbog iste masene koncentracije;
4) isti, zbog istog broja čestica.
13. Agregacijska stabilnost koloidnih čestica (njihova otpornost na aglomeraciju) je posljedica:
1) njihova mala veličina;
2) intenzivno Brownovo gibanje;
3) niska koncentracija čestica;
4) tlak rastavljanja hidratiziranih ionskih atmosfera.
Poglavlje 3. LIOFILNI KOLOIDNI SUSTAVI.
OTOPINE KOLOIDNIH POVRŠINSKIH TVARI.
Liofilne koloidne otopine su ultramikroheterogeni sustavi s “dobrom” interakcijom između disperzne faze i disperzijskog medija s veličinom čestica disperzne faze od 10 –9 – 10 –7 m.
Disperznu fazu u njima tvore tvari difilne molekularne strukture: koloidni surfaktanti i neki BMC. Sve površinski aktivne tvari mogu se podijeliti u dvije vrste:
1. Zaista topiv. To su površinski aktivne tvari s kratkim ugljikovodičnim radikalima. Prilično se dobro otapaju iu polarnim iu nepolarnim otapalima i tvore samo prave otopine. To uključuje niže alkohole, karboksilne kiseline i njihove soli, amine i fenole.
2. Surfaktanti s dugim ugljikovodičnim radikalima koji sadrže više od 10 atoma ugljika i slabo su topljivi. Upravo se te tvari podrazumijevaju pod pojmom koloidne tenzide.
Koloidni surfaktanti su tvari difilne prirode koje s istim otapalom pri niskim koncentracijama stvaraju prave otopine, a pri visokim koncentracijama koloidne otopine s micelama različitog oblika.
Procesi koagulacije često se događaju u prirodi, na primjer, tamo gdje se rijeke ulijevaju u mora. Riječna voda uvijek sadrži koloidne čestice mulja, gline, pijeska ili zemlje.
Kada se riječna voda pomiješa sa slanom morskom vodom (koja sadrži veću količinu elektrolita), počinje koagulacija ovih čestica, a smanjenje brzine protoka vode doprinosi njihovom taloženju na ušćima rijeka, što rezultira stvaranjem plićaka i otoci.
Koagulacija se široko koristi u pročišćavanju vode koja ulazi u vodoopskrbnu mrežu. Da bi se to postiglo, dodaju mu se aluminijev i željezo(III) sulfati, koji, kao dobri koagulanti, također hidroliziraju u solove metalnih hidroksida. Čestice ovih solova obično imaju naboj suprotan naboju granula prisutnih u vodi. Kao rezultat toga dolazi do međusobne koagulacije sola i njihovog taloženja.
Koloidne otopine nalaze se u otpadnim vodama iz mnogih industrija: na primjer, stabilne emulzije naftnih proizvoda i raznih drugih organskih tekućina. Uništavaju se tretiranjem otpadnih voda solima zemnoalkalijskih metala.
U industriji šećera, procesi koagulacije koriste se za pročišćavanje soka šećerne repe. Osim saharoze i vode sadrži nešećerne tvari, često u koloidno raspršenom stanju. Za njihovo uklanjanje u sok se dodaje Ca(OH) 2 . Njegov maseni udio obično ne prelazi 2,5%. Nečistoće u koloidnom stanju koaguliraju i talože se. Da bi se uklonio višak Ca(OH) 2 iz soka, kroz njega se propušta ugljikov dioksid. Kao rezultat toga nastaje talog CaCO 3 koji sa sobom nosi mnoge topive nečistoće iz otopine.
Procesi koagulacije igraju značajnu ulogu u živom organizmu, jer biološke tekućine sadrže koloidno raspršene čestice koje su u kontaktu s otopljenim elektrolitima. Normalno, ti su sustavi obično u stanju ravnoteže i u njima se ne događaju koagulacijski procesi. Ali ta se ravnoteža lako može poremetiti uvođenjem dodatnog elektrolita izvana. Štoviše, pri uvođenju u tijelo potrebno je uzeti u obzir ne samo njegovu koncentraciju u biološkoj tekućini, već i naboj iona. Dakle, izotonična otopina NaCl ne može se zamijeniti izotoničnom otopinom MgCl 2, budući da ova sol, za razliku od NaCl, sadrži dvostruko nabijene ione Mg 2+, koji imaju veću koagulacijsku sposobnost od iona Na +.
Pri unošenju mješavine soli u krvotok prvo se treba uvjeriti da ta mješavina ne djeluje sinergistički, kako bi se izbjegla koagulacija štetna za organizam.
Rješenje mnogih problema u medicini: protetika krvnih žila, srčanih zalistaka itd. – ovisi o procesima zgrušavanja krvi. Mogu se smatrati koagulacijom crvenih krvnih stanica. U kirurgiji se tijekom operacija u krv ubrizgavaju antikoagulansi (heparin, modificirani dekstran, poliglukin). Nakon operacija iu slučaju unutarnjeg krvarenja, naprotiv, koristite elektrolite koji potiču koagulaciju: kaproinska kiselina, protamin sulfat.
Za dijagnosticiranje mnogih bolesti u kliničkim laboratorijima određuje se brzina sedimentacije eritrocita (ESR). U različitim patologijama, iz više razloga, koagulacija eritrocita se povećava, a njihova sedimentacija postaje veća od normalne.
Stvaranje žučnih, mokraćnih i drugih kamenaca u tijelu također je povezano s pojačanom koagulacijom kolesterola, bilirubina i soli mokraćne kiseline u patološkim stanjima zbog slabljenja prirodnog zaštitnog učinka. Proučavanje mehanizma ovih procesa iznimno je važno za razvoj načina liječenja ovih bolesti.
Kraj posla -
Ova tema pripada odjeljku:
opća kemija
Obrazovna ustanova Grodno State Medical University.. Odjel za opću i bioorgansku kemiju..
Ako trebate dodatne materijale o ovoj temi ili niste pronašli ono što ste tražili, preporučamo pretraživanje naše baze radova:
Što ćemo učiniti s primljenim materijalom:
Ako vam je ovaj materijal bio koristan, možete ga spremiti na svoju stranicu na društvenim mrežama:
| Cvrkut |
Sve teme u ovom odjeljku:
Termodinamički parametri
Fizičke veličine koje karakteriziraju bilo koje svojstvo sustava nazivaju se termodinamički parametri. Mogu biti mikroskopske i makroskopske.
Unutarnja energija sustava
Najvažnija karakteristika termodinamičkog sustava je vrijednost njegove unutarnje energije. Svi termodinamički sustavi skup su nekog broja
U najopćenitijem obliku, unutarnja energija sustava može se definirati kao zbroj potencijalne i kinetičke energije svih njegovih sastavnih čestica
Ova nam definicija, međutim, ne dopušta nedvosmislen odgovor na pitanje čemu je jednaka energija određenog sustava koji se sastoji od određenog broja strukturnih jedinica, na primjer, molekula. Prvo najprije
Oblik izmjene energije s okolinom
Tijekom termodinamičkih procesa unutarnja energija sustava može se povećati ili smanjiti. U prvom slučaju kažu da je sustav apsorbirao dio energije iz vanjskog okruženja, u drugom sa
Izobarni i izohorni procesi. Entalpija. Toplinski učinci kemijskih reakcija
Postoje procesi tijekom kojih samo jedan ili više parametara sustava ostaju nepromijenjeni, dok se svi ostali mijenjaju. Dakle, proces koji se odvija na konstanti
U izohornim procesima, sva toplina koju sustav preda ili oslobodi određena je promjenom unutarnje energije sustava
U2 – U1 = ΔU, gdje je U1 unutarnja energija početnog stanja sustava; U2 – unutarnja energija konačnog stanja sustava
Ti se uvjeti inače nazivaju standardnim uvjetima
Ovako određene entalpije tvorbe tvari nazivaju se standardne entalpije tvorbe (DHo298). Mjere se u kJ/mol. Toplina ili entalpija o
Utjecaj temperature i tlaka na toplinski učinak reakcije
Koristeći referentne podatke za topline stvaranja ili topline izgaranja kemikalija, moguće je teoretski izračunati toplinski učinak reakcije koja se odvija pod standardnim uvjetima. Ali kako bi mogao
Primjena Hessova zakona u biokemijskim istraživanjima
Hessov zakon vrijedi ne samo za čisto kemijske reakcije, već i za složene biokemijske procese. Dakle, količina topline dobivena tijekom potpune oksidacije u CO2 i H2O
Entropija
Na temelju prvog zakona termodinamike nemoguće je utvrditi u kojem će se smjeru iu kojoj mjeri odvijati pojedini proces povezan s transformacijom energije. Od promatranih
Princip energetskog sprezanja
Reakcije koje se javljaju spontano u danim uvjetima nazivamo egzergonijskim; nazivaju se reakcije koje se mogu javiti samo pod stalnim vanjskim utjecajem
Kemijska ravnoteža
Reverzibilne i ireverzibilne reakcije. Konstanta ravnoteže Tijekom spontanog procesa, Gibbsova energija se smanjuje na određenu vrijednost, uzimajući najmanju moguću vrijednost.
Taj se izraz također naziva jednadžba izoterme kemijske reakcije
2) ∆ h.r. = - RTln (Uzimajući u obzir činjenicu da je u uvjetima kemijske ravnoteže ∆Gh.r. = 0). U ovom slučaju, Kequal= gdje je CA,
Koncepti otapala i otopljene tvari ne odnose se na čvrste otopine i plinske smjese.
Tekuće otopine u kojima H2O djeluje kao otapalo nazivamo vodenim. Ako je otapalo neka druga tekućina – nevodena.
Mehanizam stvaranja otopine
Otopine zauzimaju srednji položaj između mehaničkih smjesa tvari i pojedinačnih kemijskih spojeva, posjedujući određena svojstva oba sustava, a istodobno poznavajući
Utjecaj prirode tvari na topljivost
Eksperimentalno je utvrđeno da se tvari nastale ionskim ili kovalentnim polarnim vezama najbolje otapaju u otapalu čije su molekule polarne. A u otapalu, molekule
Utjecaj tlaka na topljivost tvari
Utjecaj tlaka na topljivost čvrstih i tekućih tvari praktički nema nikakvog utjecaja jer volumen sustava se neznatno mijenja. Samo pri vrlo visokim tlakovima dolazi do promjene topljivosti
Utjecaj elektrolita na topljivost tvari
Ako otapalo sadrži nečistoće, smanjuje se topljivost tvari u njemu. To je osobito vidljivo kada je u ulozi takvog stranog spoja elektrolit, te otopljene tvari
Međusobna topljivost tekućina
Kod miješanja tekućina, ovisno o njihovoj prirodi, naravi i snazi međudjelovanja među molekulama, moguća su 3 slučaja topljivosti: 1) neograničena topljivost; 2) ograničen
Metoda ekstrakcije iz razrijeđene otopine temelji se na različitoj topljivosti iste tvari u tekućinama koje se ne miješaju.
Prema ovoj metodi, izvornoj razrijeđenoj otopini dodaje se drugo otapalo koje se ne miješa s otapalom u prvoj otopini, ali dobro otapa ekstrahiranu tvar. Istovremeno, od prve
Metode iskazivanja sastava otopina
Sastav bilo koje otopine može se izraziti i kvalitativno i kvantitativno. Obično, kada se kvalitativno procjenjuje rješenje, koncepti kao što su zasićeno, nezasićeno
Termodinamički aspekti procesa otapanja. Idealna rješenja
Prema drugom zakonu termodinamike, u izobarno-izoteričnim uvjetima (p, T = const), tvari se mogu spontano otopiti u bilo kojem otapalu ako tijekom tog procesa nema
Koligativna svojstva razrijeđenih otopina
Rješenja imaju niz svojstava, inače se nazivaju koligativnim (kolektivnim). Oni su zbog općih razloga i određeni su samo koncentracijom p
Difuzija i osmoza u otopinama
U otopinama su čestice otapala i otopljene tvari jednoliko raspoređene po cijelom volumenu sustava zbog njihovog nasumičnog toplinskog kretanja. Ovaj proces se zove
Uloga osmoze u biološkim procesima
Osmoza je od velike važnosti u životu ljudi, životinja i biljnih organizama. Kao što je poznato, sva biološka tkiva sastoje se od stanica koje sadrže tekućinu (citoplazmu)
Otopine se smrzavaju na nižoj temperaturi od čistog otapala
Pogledajmo ih detaljnije. Vrenje je fizički proces promjene tekućine u plinovito stanje ili paru, pri čemu se u tekućini stvaraju mjehurići plina.
Koligativna svojstva otopina elektrolita. Izotonični van't Hoffov koeficijent
Za idealna rješenja vrijede Van't Hoffov i Raoultov zakon, tj. one u kojima nema kemijske interakcije između komponenti otopine, te ne dolazi do disocijacije ili asocijacije
Elektrolitička disocijacija
Elektroliti i neelektroliti. Teorija elektrolitičke disocijacije Sve tvari se dijele u 2 velike skupine: elektroliti i neelektroliti.
Opće karakteristike elektrolita
Neki se elektroliti u otopinama potpuno raspadaju na ione. Zovu se jaki. Ostali elektroliti samo se djelomično raspadaju na ione, tj. veliki ča
Slabi elektroliti
Za slabe elektrolite stupanj disocijacije je vrlo mali (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 10–9. Это означает, что только одна молекула из милли
Jaki elektroliti
Prema teoriji elektrolitičke disocijacije S. Arrheniusa, jaki elektroliti u otopinama trebali bi se potpuno raspasti na ione (α = 1). Ali eksperimentalno određene vrijednosti stupnja dis
Aktivnost iona podrazumijeva njihovu efektivnu (uvjetnu) koncentraciju, prema kojoj se oni kvantitativno očituju u otopini
Aktivnost iona a jednaka je njegovoj molarnoj koncentraciji C pomnoženoj s koeficijentom aktivnosti γ a = C γ
Disocijacija vode. pH vrijednost
Čista voda je loš vodič električne energije, ali još uvijek ima mjerljivu električnu vodljivost, što se objašnjava djelomičnom disocijacijom molekula H2O na vodikove ione i hidroksidne ione:
Teorija kiselina i baza
Sadržaj pojmova "kiselina" i "baza" značajno se promijenio u procesu razvoja kemijske znanosti, ostajući jedno od glavnih pitanja kemije. Godine 1778. francuski znanstvenik Lavoisier je
Što je niža vrijednost, to je baza jača.
Za kiselinu i njenu konjugiranu bazu u razrijeđenoj vodenoj otopini vrijedi jednakost: Kw = Ka · Kv gdje je K
Stoga je svaki acidobazni puferski sustav ravnotežna smjesa koja se sastoji od donora i akceptora protona
U takvom sustavu koji sadrži slabu kiselinu, razlikuje se ukupna, aktivna i potencijalna kiselost: 1) ukupna kiselost prema
Mehanizam djelovanja tamponskih sustava
Bit puferskog učinka mješavine slabe kiseline i njezine soli može se razmotriti na primjeru otopine acetatnog pufera. Kada mu se doda jaka kiselina (na primjer, HCl), dolazi do reakcije:
Veličina puferskog kapaciteta ovisi o koncentracijama komponenti puferskog sustava i njihovom omjeru
Što je puferska otopina koncentriranija, to je njen puferski kapacitet veći, jer u ovom slučaju dodavanje male količine jake kiseline ili lužine neće uzrokovati značajnu promjenu
Puferski sustavi ljudskog tijela
U ljudskom organizmu, kao rezultat različitih metaboličkih procesa, stalno se stvaraju velike količine kiselih produkata. Prosječna dnevna stopa njihovog izlučivanja odgovara 20-30 litara
Kinetika kemijskih reakcija
Proučavanje kemijskih procesa sastoji se od dva dijela: 1) kemijska termodinamika; 2) kemijska kinetika. Kao što je ranije pokazano, kemijski
Redoslijed i molekularnost jednostavnih kemijskih reakcija
U glavnoj kinetičkoj jednadžbi kemijske reakcije aA + bB + … → u = k · · · … a, b, … su konstantni brojevi koji ne ovise o koncentraciji tvari, tzv.
Trimolekularne reakcije uključuju jednostavne reakcije u čijem se elementarnom činu sudaraju i mijenjaju tri čestice.
Ovisno o prirodi tih čestica (tj. jesu li iste ili različite), kinetička jednadžba takve reakcije može imati tri različita oblika: u = k (sve tri početne čestice su apsolutno iste
Pojam složenih kemijskih reakcija
Treba naglasiti da su jednostavne mono- i bimolekularne reakcije u neovisnom ili "čistom" obliku također rijetke. U većini slučajeva oni su sastavni dio tzv
To jest, u kojem iste početne tvari, istodobno reagirajući jedna s drugom, tvore različite proizvode
Primjer ove reakcije je reakcija razgradnje Bertoletove soli KClO3, koja se pod određenim uvjetima može odvijati u dva smjera.
Kemijske metode temelje se na izravnom određivanju količine tvari ili njezine koncentracije u reakcijskoj posudi
Najčešće se u te svrhe koriste takve vrste kvantitativne analize kao što su titrimetrija i gravimetrija. Ako se reakcija odvija sporo, onda kontrolirati potrošnju reagensa kroz određene
Konstanta brzine izračunava se formulom
k = (–) i mjeri se u l∙s-1∙mol-1, tj. njegova brojčana vrijednost ovisi o jedinicama u kojima se mjeri koncentracija tvari
Utjecaj temperature na brzinu kemijske reakcije
Brzina kemijskih reakcija ovisi o mnogim čimbenicima, a glavni su koncentracija i priroda početnih materijala, temperatura reakcijskog sustava i prisutnost katalizatora u njemu.
Množitelj A odražava udio učinkovitih sudara između molekula polaznih tvari u njihovom ukupnom broju
Očito, njegove vrijednosti moraju biti u rasponu od 0 do 1. Kada je A = 1, svi sudari su učinkoviti. Pri A = 0 ne dolazi do kemijske reakcije, unatoč sudaru između molekula
Opće odredbe i principi katalize
Brzina kemijske reakcije može se kontrolirati pomoću katalizatora. Nazivaju se tvarima koje mijenjaju brzinu reakcije, ali se, za razliku od reagensa, ne troše
Mehanizam homogene i heterogene katalize
Mehanizam homogene katalize obično se objašnjava pomoću intermedijarne teorije. Prema ovoj teoriji, katalizator (K) prvo stvara intermedijer s jednom od polaznih tvari
Značajke katalitičke aktivnosti enzima
Enzimi su prirodni katalizatori koji ubrzavaju biokemijske reakcije u životinjskim i biljnim stanicama, kao i u ljudskim stanicama. Obično imaju proteine
Druga važna razlika između enzima i neproteinskih katalizatora je njihova visoka specifičnost, tj. selektivnost djelovanja
Postoje supstratne i grupne specifičnosti. U slučaju specifičnosti supstrata, enzimi pokazuju katalitičku aktivnost
Definicija disperznih sustava
Sustavi u kojima je jedna tvar, koja je u raspršenom (zdrobljenom ili usitnjenom) stanju, ravnomjerno raspoređena u volumenu druge tvari nazivaju se dispergiranim.
Stupanj disperzije je vrijednost koja pokazuje koliko čestica može biti zbijeno zbijeno na segmentu dugom 1 m
Pojam poprečne veličine ima jasno definirano značenje za sferne čestice (i jednaka je promjeru d tih čestica) i za čestice koje imaju oblik kocke (i jednaka je duljini brida l kocke). Za
U koloidnim disperznim sustavima čestice disperzne faze sastoje se od mnogo međusobno povezanih atoma, molekula ili iona.
Broj ovih strukturnih jedinica u jednoj čestici može fluktuirati u širokim granicama ovisno o njihovoj vlastitoj veličini i masi (na primjer, mogući broj atoma leži u int.
Za raspršivanje krutih tvari koriste se mehaničke, ultrazvučne, kemijske metode i eksplozije
Ovi se procesi široko koriste u nacionalnom gospodarstvu: u proizvodnji cementa, za mljevenje žitarica i drugih proizvoda, mljevenje ugljena u energetskom sektoru, u proizvodnji boja, punila itd. Mirov
Tekućine za raspršivanje
Za raspršivanje tekućina i dobivanje malih kapljica u aerosolima i emulzijama koriste se pretežno mehaničke metode: mućkanje, brzo miješanje, praćeno kavitacijom
Disperzija plina
Za dobivanje mjehurića plina u tekućini koristi se nekoliko opcija disperzije: 1) mjehurići - prolazak mlaza plina kroz tekućinu s dovoljno
Metode kondenzacije
Ove metode omogućuju dobivanje raspršenih čestica bilo koje veličine, uključujući 10–8 – 10–9 m. Stoga se naširoko koriste u nanotehnologiji i koloidnoj kemiji. razlikovati
Metode fizičke kondenzacije
Aerosoli se dobivaju kondenzacijom para raznih tvari u plinovitom okolišu. U prirodnim uvjetima tako nastaju magla i oblaci. Kokondenzacija netopljiva
Metode kemijske kondenzacije
Kod ovih metoda nova faza nastaje tijekom odvijanja homogenih kemijskih reakcija koje dovode do stvaranja tvari netopljivih u određenom mediju. To mogu biti reakcije
Sol pročišćavanje
Koloidne otopine dobivene na ovaj ili onaj način (osobito metodom kemijske kondenzacije) gotovo uvijek sadrže određenu količinu spojeva niske molekulske mase u obliku cca.
Kompenzatorna dijaliza i vividijaliza
Za pročišćavanje bioloških tekućina, koje su koloidni sustavi, koristi se kompenzacijska dijaliza u kojoj se umjesto čistog otapala koristi fiziolog.
MOLEKULARNO-kinetička svojstva sola
U početnoj fazi razvoja koloidne kemije tvrdilo se da disperzni sustavi, za razliku od pravih otopina, nemaju takva molekularna kinetička svojstva kao što je toplinsko kretanje čestica.
Brownovo gibanje
Najvažniji čimbenik koji utječe na molekularna kinetička svojstva sola je Brownovo gibanje čestica disperzne faze. Ime je dobio po engleskom botaničaru Robertu Broughu
Difuzija
Pod utjecajem toplinskog i Brownovog gibanja dolazi do spontanog procesa izjednačavanja koncentracija čestica u cijelom volumenu koloidne otopine. Ovaj proces se inače naziva difuzija. Di
Sedimentacija u solima
Koloidne čestice u pepelu stalno su pod utjecajem dviju suprotno usmjerenih sila: gravitacije, zbog čijeg se djelovanja tvar postupno taloži, i difuzijske sile, pod
Osmotski tlak u solima
Koloidne otopine, kao i prave, imaju osmotski tlak, iako u solima ima znatno nižu vrijednost. To se objašnjava činjenicom da pri istoj težinskoj koncentraciji
Ultramikroskop
Koloidne čestice su manje veličine od poluvalne duljine vidljive svjetlosti i stoga se ne mogu vidjeti konvencionalnim optičkim mikroskopom. Godine 1903. austrijski znanstvenici R. Zsigmondy i G. Z
Razmotrimo najprije mehanizam nastanka DES koloidne čestice adsorpcijom
Kao primjer, uzmimo sol dobiven metodom kemijske agregacije miješanjem pravih otopina dviju tvari: srebrnog nitrata i kalijevog jodida Ag
Elektrokinetička svojstva sola
Dokaz da se koloidne čestice u solima sastoje od dva suprotno nabijena dijela koji se mogu međusobno kretati može se dobiti utjecajem na dispergirane
Vrste stabilnosti sola
Kao što je ranije pokazano, hidrofobne koloidne disperzne sustave, u usporedbi s pravim otopinama, karakterizira termodinamička nestabilnost i tendencija spontanog smanjenja
Deryagin-Landau-Verwey-Overbeckova teorija koagulacije
Pri proučavanju koagulacije sola nastale su mnoge teorije uz pomoć kojih su pokušali objasniti sve uočene obrasce na kvalitativnoj i kvantitativnoj razini. Dakle, 1908. G. Freundl
Utjecaj elektrolita na stabilnost sola. Koagulacijski prag. Schultz-Hardyjevo pravilo
Čimbenik koji uzrokuje koagulaciju može biti svaki vanjski utjecaj koji narušava agregativnu stabilnost sustava. Osim promjena temperature, mehanički učinci mogu igrati ulogu
Izmjena zona koagulacije
Pri dodavanju elektrolita koji sadrže ione s povećanom koagulacijskom sposobnošću (veliki organski anioni, ioni trovalentnih ili četverovalentnih metala) u koloidne otopine, m
Koagulacija sola mješavinama elektrolita
Koagulacijski učinak mješavine elektrolita očituje se na različite načine, ovisno o prirodi iona koji uzrokuju koagulaciju. Ako su elektroliti u smjesi slični po svojstvima (na primjer, NaCl i KCl), tada
Stopa koagulacije
Proces koagulacije kvantitativno je karakteriziran brzinom zgrušavanja. Brzina koagulacije, kao i brzina kemijske reakcije, određena je promjenom (smanjenjem) broja koloidnih čestica po jedinici
Koloidna zaštita
Često se uočava povećanje otpornosti liofobnih sola na koagulirajuće djelovanje elektrolita kada se dodaju određene tvari. Takve tvari nazivamo zaštitnim, a njihov stabilizirajući učinak na
Otopine spojeva visoke molekulske mase
Osim takozvanih liofobnih solova (o kojima se gore detaljno govori), koloidna kemija proučava i druge visoko disperzne sustave - otopine polimera: proteina, polisaharida, kaučuka itd. Prich
Čestice disperzne faze u njima nisu micele (kao u liofobnim solima), već pojedinačne makromolekule (veličinom usporedive s micelama)
U tom smislu, za razrijeđene otopine spirale, izraz "liofilni sol" je u osnovi netočan. Ali s povećanjem koncentracije polimera ili pogoršanjem sposobnosti otapanja
Opće karakteristike spojeva visoke molekulske mase
Spojevi velike molekulske mase (HMC) ili polimeri su složene tvari čije se molekule sastoje od velikog broja ponavljajućih skupina atoma iste strukture.
Oticanje i otapanje spirale
Otapanje spojeva visoke molekularne mase složen je proces koji se razlikuje od otapanja tvari niske molekularne mase. Dakle, kada se potonji otope, dolazi do međusobnog miješanja biljaka
Termodinamički aspekti procesa bubrenja
Termodinamički gledano, spontano bubrenje ili otapanje spojeva visoke molekulske mase uvijek je popraćeno smanjenjem Gibbsove slobodne energije (∆G = ∆H – T∆S< 0).
Pritisak bubrenja
Ako se tijekom bubrenja uzorka polimera na bilo koji način spriječi povećanje njegove veličine, tada u njemu nastaje tzv. tlak bubrenja. Ekvivalentan je vanjskom pritisku
Osmotski tlak otopina spirale
Kao i svi visoko dispergirani sustavi čije su čestice podložne toplinskom kretanju, IUD otopine imaju osmotski tlak. Određen je koncentracijom polimera, ali gotovo uvijek jest
Onkotski krvni tlak
Osmotski tlak u biološkim tekućinama: krvi, limfi, intra- i međustaničnoj tekućini određen je ne samo sadržajem različitih niskomolekularnih tvari u njima, već i prisutnošću otopljenih
Viskoznost otopina polimera
Što se tiče viskoznosti, otopine spojeva visoke molekularne težine oštro se razlikuju od otopina tvari niske molekularne težine i sola. Pri istoj težinskoj koncentraciji viskoznost otopina polimera je značajno
Slobodna i vezana voda u otopinama
U otopinama polimera, dio otapala se ispostavlja da je čvrsto vezan za makromolekule zbog pojave procesa solvatacije i, zajedno s njima, sudjeluje u Brownovom gibanju. ostalo
Polielektroliti
Mnogi prirodni i sintetski polimeri sadrže različite ionske funkcionalne skupine u elementarnim jedinicama svojih makromolekula koje mogu disocirati u vodenim otopinama.
Čimbenici koji utječu na stabilnost polimernih otopina. Odsoljavanje
Otopine pravih polimera, kao i otopine spojeva niske molekulske mase, agregacijsko su stabilne i, za razliku od sola, mogu postojati dugo vremena bez dodatka stabilizatora. Kršiti
Otopine elektrolita kao vodiči druge vrste. električna vodljivost otopina elektrolita
Ovisno o sposobnosti provođenja električne struje, sve se tvari dijele u 3 glavne vrste: vodiče, poluvodiče i dielektrike. Supstance prve vrste mogu
Ekvivalentna električna vodljivost otopina
Ekvivalentna električna vodljivost je električna vodljivost otopine elektrolita debljine 1 m, smještene između istih elektroda s takvom površinom da volumen tekućine
Ova se jednakost naziva zakon neovisnog gibanja iona ili Kohlrauschov zakon
Veličine λk i λa nazivaju se još i pokretljivosti kationa i aniona. One su redom jednake λk = F ͨ
Praktična primjena električne vodljivosti
Poznavajući ekvivalentnu električnu vodljivost otopine, možemo izračunati stupanj (a) i konstantu disocijacije (K) slabog elektrolita otopljenog u njoj: gdje je λV –
Metalna elektroda
Kad se metalna ploča spusti u vodu, na njezinoj se površini pojavi negativan električni naboj. Mehanizam njegovog izgleda je sljedeći. U čvorovima kristalne rešetke metala postoje
Mjerenje potencijala elektroda
Apsolutna vrijednost potencijala elektrode ne može se izravno odrediti. Možete mjeriti samo razliku potencijala koja se javlja između dvije elektrode koje tvore zatvoreni električni krug
Redox elektrode
Postoje otopine koje sadrže dvije tvari u kojima su atomi istog elementa u različitim stanjima oksidacije. Takve se otopine također nazivaju oksidirati
Difuzijski i membranski potencijali
Difuzijski potencijali nastaju na granici između dviju otopina. Štoviše, to mogu biti i otopine različitih tvari i otopine iste tvari, samo u
Među ion-selektivnim elektrodama, staklena elektroda je postala široko rasprostranjena, koja se koristi za određivanje pH otopina.
Središnji dio staklene elektrode (slika 91) je kuglica izrađena od specijalnog vodljivog hidratiziranog stakla. Napunjen je vodenom otopinom HCl poznate koncentracije
Kemijski izvori električne struje ili galvanske ćelije pretvaraju energiju oslobođenu tijekom redoks reakcija u električnu energiju
Potenciometrija
Potenciometrija je skupina metoda kvantitativne analize koja se temelji na korištenju ovisnosti ravnotežnog potencijala elektrode uronjene u otopinu o aktivnosti (koncentraciji
Postoji izravna i neizravna potenciometrija ili potenciometrijska titracija
Izravna potenciometrija (ionometrija) je potenciometrijska metoda u kojoj je indikatorska elektroda ion-selektivna elektroda. Ionometrija – zgodno, jednostavno, ekspresno
Jedna od najčešće korištenih metoda redukcije suspendiranih tvari u vodi je taloženje pod utjecajem gravitacije. Međutim, nečistoće koje uzrokuju mutnoću i boju prirodnih voda male su veličine, zbog čega se njihovo taloženje odvija izuzetno sporo, budući da sile difuzije prevladavaju nad silama gravitacije. Osim toga, prisutnost koloidnih nečistoća dodatno komplicira proces sedimentacije. Da bi se ubrzali procesi taloženja, filtracije, flotacije i povećala njihova učinkovitost, pribjegavaju koagulaciji nečistoća vode.
Koagulacija nečistoća vode je proces uvećanja koloidnih i suspendiranih čestica disperznog sustava, koji nastaje kao rezultat njihove interakcije i spajanja u agregate. Koagulacija je kompleks kemijskih i fizičkih interakcija između negativno nabijenih koloidnih čestica i kationa, tj. pozitivno nabijeni kemijski reagensi. Koristi različite sile odbijanja i privlačenja, koje osiguravaju stabilnost ili, obrnuto, nestabilnost koloidne suspenzije, naime:
Elektrostatske sile odbijanja;
Brownovo gibanje;
Van der Waalsove privlačne sile;
Sila univerzalne gravitacije.
Koagulacija destabilizira koloidnu suspenziju kroz dva različita mehanizma:
- neutralizacija naboja
Energija miješanja primijenjena u procesu čišćenja povećava broj i učestalost ovih sudara čestica, povećavajući aglomeraciju čvrstih tvari i potičući stvaranje pahuljica.
- kemijsko vezivanje
Od dva mehanizma uključena u proces koagulacije, neutralizacija naboja ima mnogo važniju ulogu od kemijskog vezivanja. Ovi procesi se završavaju odvajanjem agregata zalijepljenih čestica iz tekuće faze.
Riječ "koagulacija" dolazi od latinske riječi "coagulare", što znači "sastaviti". Koagulacija igra važnu ulogu u procesima obrade vode za uklanjanje suspendiranih koloidnih čestica koje mogu dati neugodan okus, boju, miris ili zamućenost vodi za piće. To se postiže dodavanjem posebnih kemikalija (koagulansa) netretiranoj vodi. Pod djelovanjem koagulansa, vrlo male, izuzetno fine koloidne čestice spajaju se u velike mase (flokule), koje se zatim mogu ukloniti metodama razdvajanja kruto-tekuće kao što su sedimentacija, flotacija i filtracija.
Glavni čimbenici koji utječu na proces koagulacije vodenih nečistoća u volumenu (konvektivna koagulacija) su: temperatura i lužnatost vode; koncentracija vodikovih iona i anionski sastav vode; pravilan izbor doze koagulansa, brzine miješanja i ravnomjerne raspodjele u vodi; sadržaj prirodnih suspenzija u vodi; uvjeti za proces flokulacije (ortokinetička faza procesa koagulacije).
Pravilan izbor doze koagulansa je od najveće važnosti za koagulaciju nečistoća vode. Doza koagulanta označava određenu masenu količinu reagensa koja se dodaje jedinici volumena vode koja se tretira. Doza koagulansa mjeri se u mg/l, g/m3.
Vizualni prikaz utjecaja doze koagulansa na procese bistrenja i obezbojenja vode daje koagulacijska krivulja. Može se podijeliti u tri zone. U zoni I, pri malim dozama koagulansa, učinak bistrenja i obezbojavanja vode taloženjem ili filtracijom je neznatan. U zoni II, povećanje doze koagulansa ima dramatičan učinak na učinak bistrenja i obezbojenosti vode. Granica između zona I i II naziva se koagulacijski prag. U zoni III povećanje doze koagulansa ne poboljšava značajno učinak bistrenja i obezbojenja vode. Krivulja je gotovo paralelna s x-osi. Granica između zona II i III naziva se optimalna doza.
Pri koagulaciji nečistoća vode potrebno je brzo i ravnomjerno rasporediti reagense po njenom volumenu kako bi se osigurao maksimalan kontakt čestica nečistoća s međuproizvodima hidrolize koagulansa (koji postoje kratko vrijeme), budući da se procesi hidrolize, polimerizacije i adsorpcije odvijaju u vodi. dogodi unutar 1 sekunde.
Da bi se osiguralo ravnomjerno i brzo miješanje reagensa s vodom, treba ih uvesti u zone najveće turbulencije protoka na nekoliko točaka u njegovom presjeku. Za miješanje reagensa s vodom potrebno je osigurati distributere reagensa (uređaje za unos reagensa), koji osiguravaju njihovu brzu ravnomjernu raspodjelu u dovodnom kanalu ili cjevovodu, te miješalice, gdje se naknadno intenzivno miješa uneseni reagens s pročišćenom vodom. Razdjelnike reagensa preporučuje se izraditi u obliku perforiranih cjevastih sustava ili umetaka u cjevovod, koji predstavljaju lokalni otpor. Gubitak tlaka u cjevovodu pri ugradnji gore navedenih uređaja uzima se 0,1 ... 0,2 odnosno 0,2 ... 0,3 m.
Perikinetička (molekularno-kinetička) koagulacija završava kada čestice dosegnu veličinu od 1...10 mikrona, što se praktički poklapa s periodom brze raspodjele koagulansa u pročišćenoj vodi u miješalicama. Neučinkovito miješanje dovodi do prekomjerne potrošnje koagulansa i niske stope aglomeracije nečistoća vode pri danoj dozi reagensa. Stoga je potrebno stvoriti optimalan način rada mješalica, u kojem bi koagulant došao u kontakt sa maksimalnim brojem čestica nečistoće vode prije završetka reakcija hidrolize i polimerizacije.
Upotreba polimernih flokulanata nakon destabilizacije koloidne suspenzije koagulansima omogućuje povećanje učinkovitosti procesa pročišćavanja. Zbog svoje vrlo velike molekularne težine, polimerni flokulanti iznimno su učinkoviti u stvaranju mostova između mikroflokula nastalih tijekom koagulacije, stvarajući veće makroflokule. Korištenje vrlo malih količina flokulanata (0,01 - 0,5 mg/l) nakon koagulacije povećava hvatanje čestica, ubrzava stvaranje flokula i čini flokule gušćima i bržim za taloženje. Korištenje flokulanata za ovu svrhu također omogućuje ograničavanje doziranja koagulansa na minimalnu količinu potrebnu za destabilizaciju koloidne suspenzije, budući da nije potrebna suvišna količina koagulansa da bi se formirala suspenzija koja se može taložiti.
Rezultat procesa koagulacije je uklanjanje kontaminanata u obliku netopljivog sedimenta ili flotacijskog mulja.
Pravila za koagulaciju s elektrolitima. Koagulacijski prag. Schulze-Hardyjevo pravilo. Vrste koagulacije: koncentracija i neutralizacija. Koagulacija mješavinama elektrolita. Fenomen "pogrešnih redova". Mehanizam i kinetika koagulacije
Zgrušavanje je proces spajanja čestica u velike agregate. Kao rezultat koagulacije, sustav gubi svoju sedimentacijsku stabilnost, budući da čestice postaju prevelike i ne mogu sudjelovati u Brownovom gibanju.
Koagulacija je spontani proces, jer dovodi do smanjenja međufazne površine i, posljedično, do smanjenja slobodne površinske energije.
Postoje dvije faze koagulacije.
Faza 1 – latentna koagulacija. U ovoj fazi čestice postaju veće, ali još ne gube svoju sedimentacijsku stabilnost.
Faza 2 - očita koagulacija. U ovoj fazi čestice gube svoju sedimentacijsku stabilnost. Ako je gustoća čestica veća od gustoće disperzijskog medija, nastaje talog.
Uzroci koagulacije su različiti. Gotovo da nema vanjskog utjecaja koji, ako je dovoljno intenzivan, ne bi uzrokovao koagulaciju.
Pravila koagulacije:
1. Svi jaki elektroliti dodani solu u dovoljnim količinama uzrokuju njegovu koagulaciju.
Minimalna koncentracija elektrolita pri kojoj počinje koagulacija naziva se koagulacijski prag C k .
Ponekad se umjesto praga koagulacije koristi vrijednost VK, koja se naziva sposobnost zgrušavanja. Ovo je volumen sola koji koagulira pod djelovanjem 1 mola elektrolita:
,oni. što je koagulacijski prag niži, to je koagulacijska sposobnost elektrolita veća.
2. Koagulirajući učinak nema cijeli elektrolit, već samo onaj ion čiji se naboj po predznaku podudara s nabojem protuiona micele liofobnog sola. Ovaj ion se zove koagulantni ion .
3. Što je veći naboj iona, veća je koagulacijska sposobnost iona koagulansa.
Ovaj obrazac je kvantitativno opisan empirijskim Schulze-Hardyjevo pravilo:
gdje je a konstantna vrijednost za dati sustav;
Z– naboj iona koagulansa;
- koagulacijski prag jednonabijenog, dvostruko nabijenog i trostruko nabijenog koagulantnog iona.Pravilo postavlja, Što Koagulacijske sile iona to su veće što je njegova valencija veća. Eksperimentalno je utvrđeno da ioni s višom valencijom imaju nižu vrijednost praga koagulacije od iona s nižom. Stoga je za koagulaciju bolje uzeti ione s najvišim oksidacijskim stanjem. Ako je valencija iona ista, tada koagulacijska sposobnost ovisi o veličini i stupnju hidratacije iona. Što je veći radijus iona, veća je njegova sposobnost zgrušavanja. Prema ovom pravilu sastavljen liotropni niz. Organski ioni koagulansa u pravilu bolje koaguliraju hidrosole od anorganskih, jer lako se polariziraju i adsorbiraju. Sa stajališta dvostrukog električnog sloja (EDL), vjeruje se da do koagulacije dolazi kada je z-potencijal > 30 mV.
Sposobnost koagulacije iona s istim nabojem je veća, veći je njegov polumjer kristala. Razlog je, s jedne strane, velika polarizabilnost iona najvećeg radijusa, dakle njihova sposobnost da ih privuče površina koja se sastoji od iona i polarnih molekula. S druge strane, što je veći radijus iona, to je manja, za istu vrijednost naboja, hidratacija iona. Hidracijska ljuska smanjuje električnu interakciju. Koagulacijska sposobnost organskih iona veća je u usporedbi s anorganskim ionima.
Za jednostruko nabijene anorganske katione koagulacijska sposobnost opada sljedećim redoslijedom:
- liotropna serija.S povećanjem koncentracije iona koagulansa, z – potencijal sol micele opada u apsolutnoj vrijednosti. Koagulacija može započeti već kada z-potencijal padne na 0,025 - 0,040 V (a ne na nulu).
Pri koagulaciji sola elektrolitima razlikuju se koncentracija I neutralizacija zgrušavanje.
Koncentracijska koagulacija nastaje kada nastaje pod utjecajem indiferentnog elektrolita zbog kompresije difuznog sloja protuiona i smanjenja apsolutne vrijednosti z-potencijala.
Razmotrimo koncentracijsku koagulaciju sola srebrovog klorida stabiliziranog srebrnim nitratom kada se u sol uvede kalijev nitrat.
Formula micela je:
.Na sl. Slika 3.1.2.1 prikazuje graf promjene potencijala u DES micele srebrovog klorida. Krivulja 1 odnosi se na početni micel, krivulja 2 – nakon dodavanja KNO 3 u količini koja uzrokuje koagulaciju. Prilikom dodavanja KNO 3 Difuzni sloj protuiona je komprimiran, formula micele ima oblik:

Na sl. 3.1.2.2 prikazuje potencijalne krivulje koje karakteriziraju interakciju čestica u ovom pepelu. Z-potencijal početne koloidne čestice je pozitivan, što stvara potencijalnu prepreku koagulaciji ∆ U Do =0 (krivulja 2 sl. 3.1.2.2). Stoga ništa ne sprječava koloidne čestice da se približe na takvu udaljenost gdje prevladavaju privlačne sile - dolazi do koagulacije. Budući da je u ovom slučaju uzrok koagulacije povećanje koncentracije protuiona, tzv koncentracijska koagulacija.
Za ovaj slučaj teorija daje formulu
gdje je g koagulacijski prag;
S– konstanta koja slabo ovisi o asimetriji elektrolita, tj. omjer broja naboja kationa i aniona;
A- konstantno;
e– naboj elektrona;
e - dielektrična konstanta;
Z– naboj koagulirajućeg iona;
T- temperatura.
Iz jednadžbe proizlazi da bi vrijednost koagulacijskih pragova za ione s jednim, dva, tri, četiri naboja trebala biti u omjeru 1 prema (1/2) 6 do (1/3) 6 do (1/4 ) 6 itd., tj. prethodno predstavljeno empirijsko Schulze–Hardyjevo pravilo je opravdano.
Neutralizacijska koagulacija nastaje kada se u sol doda neindiferentni elektrolit. U tom slučaju ioni koji određuju potencijal se vežu u slabo topljivi spoj, što dovodi do smanjenja apsolutnih vrijednosti termodinamičkog potencijala, a time i z-potencijala, do nule.
Ako uzmemo upravo spomenuti sol srebrnog klorida kao početni materijal, tada je za neutralizaciju iona Ag + koji određuju potencijal potrebno uvesti, na primjer, kalijev klorid u sol. Nakon dodavanja određene količine ovog neindiferentnog elektrolita, micel će izgledati ovako:
U sustavu neće biti iona koji se mogu adsorbirati na površini čestice AgCl, a površina će postati električki neutralna. Kada se takve čestice sudare, dolazi do koagulacije.
Budući da je uzrok koagulacije u ovom slučaju neutralizacija iona koji određuju potencijal, takva se koagulacija naziva neutralizacijska koagulacija.
Treba napomenuti da se za potpunu neutralizacijsku koagulaciju mora dodati neindiferentni elektrolit u strogo ekvivalentnoj količini.
Kod koagulacije mješavinom elektrolita razlikuju se dvije vrste procesa :
· homokoagulacija
· heterokoagulacija
Homokoagulacija - konsolidacija sličnih čestica u veći sedimentni agregat. Štoviše, tijekom procesa taloženja male se čestice otapaju, a velike se zbog njih povećavaju. To je osnova za pojavu aktivacije i rekristalizacije. Ovaj proces je opisan Kelvin-Thomsonova jednadžba:
Gdje S¥ - topljivost makročestica;
S– topljivost mikročestica;
V m – molarni volumen;
R– univerzalna plinska konstanta;
T- temperatura;
r– radijus čestice.
Iz jednadžbe proizlazi da je koncentracija oko malog radijusa veća, pa se difuzija odvija od veće koncentracije prema manjoj.
U drugom tipu, različite čestice se spajaju ili se čestice raspršenog sustava lijepe za strana tijela ili površine unesene u sustav.
Heterokoagulacija - međusobna koagulacija heterogenih disperznih sustava.
Koagulacija sa smjesom elektrolita je od velike praktične važnosti, jer čak i kada je jedan elektrolit koagulansa dodan u sol, u stvarnosti se koagulacija događa barem pod utjecajem dva elektrolita, jer sustav sadrži elektrolit stabilizator. Osim toga, u tehnologiji koagulacije često se koristi mješavina dvaju elektrolita. Razumijevanje obrazaca međusobnog djelovanja elektrolita također je važno pri proučavanju učinaka biološki aktivnih iona na organe i tkiva živog organizma.

Na zgrušavanje Zola mješavina dva ili više elektrolita moguća su tri slučaja (sl. 3.1.2.3). Na apscisnoj osi prikazana je koncentracija prvog elektrolita S 1, a C k1 – njegov koagulacijski prag. Slično, koncentracija drugog elektrolita je nacrtana duž ordinate S 2, a S k2 je njegov koagulacijski prag.