Catalyse. Catalyseur. Types de catalyse : homogène, hétérogène, autocatalyseur. Mécanisme des réactions catalytiques. Catalyse et catalyseurs Le principe de fonctionnement d'un catalyseur dans une réaction chimique
Les taux de réactions chimiques peuvent augmenter considérablement en présence de diverses substances qui ne sont pas des réactifs et ne font pas partie des produits de réaction. Ce phénomène remarquable est appelé catalyse(du grec "katalysis" - destruction). Une substance qui augmente la vitesse d'une réaction dans un mélange est appelée catalyseur. Sa quantité avant et après la réaction reste inchangée. Les catalyseurs ne représentent aucune classe particulière de substances. Dans diverses réactions, les métaux, les oxydes, les acides, les sels et les composés complexes peuvent présenter un effet catalytique. Les réactions chimiques dans les cellules vivantes se déroulent sous le contrôle de protéines catalytiques appelées enzymes. La catalyse doit être considérée comme un véritable facteur chimique dans l'augmentation de la vitesse des réactions chimiques, puisque le catalyseur est directement impliqué dans la réaction. La catalyse est souvent plus puissante et moins risquée pour accélérer une réaction que l'élévation de la température. Cela se manifeste clairement dans l'exemple des réactions chimiques dans les organismes vivants. Les réactions, telles que l'hydrolyse des protéines, qui dans les laboratoires doivent être effectuées avec un chauffage prolongé jusqu'au point d'ébullition, se déroulent pendant la digestion sans chauffage à la température du corps.
Pour la première fois, le phénomène de catalyse a été observé par le chimiste français L. J. Tenard (1777-1857) en 1818. Il a découvert que les oxydes de certains métaux, lorsque du peroxyde d'hydrogène est ajouté à une solution, provoquent sa décomposition. Une telle expérience est facile à reproduire en ajoutant des cristaux de permanganate de potassium à une solution de peroxyde d'hydrogène à 3 %. Le sel KMp0 4 se transforme en Mn0 2 et l'oxygène est rapidement libéré de la solution sous l'action de l'oxyde :
L'effet direct du catalyseur sur la vitesse de réaction est associé à une diminution de l'énergie d'activation. À la baisse de température normale? et de 20 kJ/mol augmente la constante de vitesse d'environ 3000 fois. rétrograder E L peut être beaucoup plus fort. Cependant, la diminution de l'énergie d'activation est une manifestation externe de l'action du catalyseur. La réaction est caractérisée par une certaine valeur E. v qui ne peut changer que si la réaction elle-même change. Donnant les mêmes produits, la réaction avec la participation de la substance ajoutée se déroule selon un chemin différent, à travers différentes étapes et avec une énergie d'activation différente. Si l'énergie d'activation est plus faible sur cette nouvelle voie et que la réaction est proportionnellement plus rapide, alors on dit que cette substance est un catalyseur.
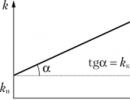
Le catalyseur interagit avec l'un des réactifs, formant un composé intermédiaire. À l'une des étapes ultérieures de la réaction, le catalyseur est régénéré - il laisse la réaction dans sa forme d'origine. Les réactifs, participant à une réaction catalytique, continuent d'interagir les uns avec les autres et le long d'un chemin lent sans la participation d'un catalyseur. Par conséquent, les réactions catalytiques appartiennent à une variété de réactions complexes appelées série-parallèle. Sur la fig. 11.8 montre la dépendance de la constante de vitesse sur la concentration du catalyseur. Le graphique de dépendance ne passe pas par zéro, puisqu'en l'absence de catalyseur, la réaction ne s'arrête pas.

Riz. 11.8.
constante observable k exprimée en somme k tu+ & kc(k)
Exemple 11.5. A une température de -500 °C, la réaction d'oxydation de l'oxyde de soufre (IV)
qui est l'une des étapes de la production industrielle de l'acide sulfurique, est très lente. Une nouvelle augmentation de la température est inacceptable car l'équilibre se déplace vers la gauche (réaction exothermique) et le rendement en produit chute trop. Mais cette réaction est accélérée par divers catalyseurs, dont l'un peut être le monoxyde d'azote (II). Premièrement, le catalyseur réagit avec l'oxygène : ![]()
puis transfère un atome d'oxygène à l'oxyde de soufre (IV) :
Ainsi, le produit final de la réaction est formé et le catalyseur est régénéré. Pour la réaction, la possibilité de s'écouler le long d'un nouveau chemin a été ouverte, dans laquelle les constantes de vitesse ont considérablement augmenté:

Le schéma ci-dessous montre les deux voies du processus d'oxydation du S0 2 . En l'absence de catalyseur, la réaction ne se déroule que le long du chemin lent, et en présence d'un catalyseur, le long des deux.
Il existe deux types de catalyse - homogène et hétérogène. Dans le premier cas, le catalyseur et les réactifs forment un système homogène sous la forme d'un mélange gazeux ou d'une solution. Un exemple d'oxydation de l'oxyde de soufre est la catalyse homogène. La vitesse d'une réaction catalytique homogène dépend à la fois des concentrations des réactifs et de la concentration du catalyseur.
En catalyse hétérogène, le catalyseur est un solide à l'état pur ou supporté sur transporteur. Par exemple, le platine comme catalyseur peut être fixé sur l'amiante, l'alumine, etc. Les molécules de réactif sont adsorbées (absorbées) à partir d'un gaz ou d'une solution à des points spécifiques sur la surface du catalyseur - centres actifs et sont activées en même temps. Après la transformation chimique, les molécules de produit résultantes sont désorbées de la surface du catalyseur. Les actes de transformation des particules se répètent aux centres actifs. Entre autres facteurs, la vitesse d'une réaction catalytique hétérogène dépend de la surface du matériau catalytique.
La catalyse hétérogène est particulièrement largement utilisée dans l'industrie. Ceci est dû à la facilité de réalisation d'un procédé catalytique en continu avec passage d'un mélange de réactifs dans un appareil de mise en contact avec un catalyseur.
Les catalyseurs agissent de manière sélective, accélérant un type de réaction très spécifique ou même une seule réaction sans affecter les autres. Cela permet d'utiliser des catalyseurs non seulement pour accélérer les réactions, mais aussi pour convertir à dessein les matières premières en produits souhaités. Le méthane et l'eau à 450°C sur le catalyseur Fe 2 0 3 sont transformés en dioxyde de carbone et en hydrogène :
Les mêmes substances à 850 °C réagissent à la surface du nickel pour former du monoxyde de carbone (II) et de l'hydrogène :

La catalyse appartient aux domaines de la chimie dans lesquels il n'est pas encore possible de faire des prédictions théoriques précises. Tous les catalyseurs industriels pour le traitement des produits pétroliers, du gaz naturel, la production d'ammoniac et bien d'autres ont été développés sur la base d'études expérimentales laborieuses et longues.
La capacité de contrôler la vitesse des processus chimiques est d'une importance inestimable dans l'activité économique humaine. Dans la production industrielle de produits chimiques, il est généralement nécessaire d'augmenter les taux des processus chimiques technologiques, et dans le stockage des produits, il est nécessaire de réduire le taux de décomposition ou d'exposition à l'oxygène, à l'eau, etc. Substances connues pouvant ralentir les réactions chimiques. Ils s'appellent inhibiteurs, ou catalyseurs négatifs. Les inhibiteurs diffèrent fondamentalement des véritables catalyseurs en ce qu'ils réagissent avec des espèces actives (radicaux libres) qui, pour une raison ou une autre, apparaissent dans une substance ou son environnement et provoquent des réactions de décomposition et d'oxydation précieuses. Les inhibiteurs sont progressivement consommés, mettant fin à leur action protectrice. Le type le plus important d'inhibiteurs sont les antioxydants, qui protègent divers matériaux des effets de l'oxygène.
Il convient également de rappeler ce qui ne peut être réalisé à l'aide de catalyseurs. Ils ne sont capables d'accélérer que des réactions spontanées. Si la réaction ne se déroule pas spontanément, le catalyseur ne pourra pas l'accélérer. Par exemple, aucun catalyseur ne peut provoquer la décomposition de l'eau en hydrogène et en oxygène. Ce processus ne peut être effectué que par électrolyse, tout en dépensant des travaux électriques.
Les catalyseurs peuvent également activer des processus indésirables. Au cours des dernières décennies, il y a eu une destruction progressive de la couche d'ozone de l'atmosphère à une altitude de 20-25 km. On suppose que certaines substances sont impliquées dans la dégradation de l'ozone, par exemple les hydrocarbures halogénés émis dans l'atmosphère par les entreprises industrielles, ainsi qu'utilisés à des fins domestiques.
YouTube encyclopédique
1 / 5
✪ Chimie physique. Cours 3. Cinétique chimique et catalyse
✪ Chimie. Cinétique des réactions chimiques. Vitesse d'une réaction chimique. Centre d'apprentissage en ligne de Foxford
✪ Cours vidéo "Catalyseurs et catalyse" - CHIMIE - 9 cellules.
✪ Cours 2. "La catalyse en tant que phénomène chimique et cinétique"
✪ Introduction à la cinétique
Les sous-titres
Principes de base de la catalyse
Le catalyseur modifie le mécanisme de réaction en un mécanisme énergétiquement plus favorable, c'est-à-dire qu'il réduit l'énergie d'activation. Le catalyseur forme un composé intermédiaire avec une molécule de l'un des réactifs, dans lequel les liaisons chimiques sont affaiblies. Ceci facilite sa réaction avec le second réactif. Il est important de noter que les catalyseurs accélèrent les réactions réversibles dans les sens direct et inverse. Par conséquent, ils ne modifient pas l'équilibre chimique.
Types de catalyse
Selon l'influence sur la vitesse de réaction, la catalyse est divisée en positive (la vitesse de réaction augmente) et négative (la vitesse de réaction diminue). Dans ce dernier cas, un processus d'inhibition a lieu, qui ne peut être considéré comme une "catalyse négative", puisque l'inhibiteur est consommé au cours de la réaction.
La catalyse se produit homogène et hétérogène(prendre contact). En catalyse homogène, le catalyseur est dans la même phase que les réactifs, tandis que les catalyseurs hétérogènes diffèrent en phase.
catalyse homogène
Un exemple de catalyse homogène est la décomposition du peroxyde d'hydrogène en présence d'ions iode. La réaction se déroule en deux étapes :
H 2 O 2 + I → H 2 O + IO H 2 O 2 + IO → H 2 O + O 2 + I
En catalyse homogène, l'action du catalyseur est due au fait qu'il interagit avec les réactifs pour former des composés intermédiaires, ce qui entraîne une diminution de l'énergie d'activation.
catalyse hétérogène
En catalyse hétérogène, l'accélération du processus se produit généralement à la surface d'un corps solide - un catalyseur, de sorte que l'activité d'un catalyseur dépend de la taille et des propriétés de sa surface. En pratique, le catalyseur est généralement supporté sur un support solide poreux.
Le mécanisme de la catalyse hétérogène est plus compliqué que celui de la catalyse homogène. Le mécanisme de la catalyse hétérogène comprend cinq étapes, toutes réversibles.
- Diffusion des réactifs à la surface d'un solide
- Adsorption physique sur les sites actifs de la surface solide des molécules en réaction puis leur chimisorption
- Réaction chimique entre molécules en réaction
- Désorption des produits de la surface du catalyseur
- Diffusion du produit de la surface du catalyseur dans le flux général
Un exemple de catalyse hétérogène est l'oxydation de SO 2 en SO 3 sur un catalyseur V 2 O 5 dans la production d'acide sulfurique (méthode de contact).
Le déroulement de la réaction à la surface du catalyseur peut être démontré dans une expérience dans laquelle une plaque de platine est chauffée dans la flamme d'un brûleur à gaz, puis la flamme est éteinte et un jet de gaz du brûleur est soufflé sur la plaque , tandis que la plaque redevient rouge - une oxydation du méthane se produit à la surface du métal.
Porte-catalyseur
support de catalyseur, autrement substrat (catalyseur) (support ou support en anglais) - un matériau inerte ou peu actif qui sert à stabiliser les particules de la phase catalytique active à sa surface.
Le rôle du support en catalyse hétérogène est d'éviter l'agglomération ou le frittage du composant actif, ce qui permet de maintenir une surface de contact élevée entre la matière active (voir phase catalytique active) et les réactifs. La quantité de support est généralement bien supérieure à la quantité d'ingrédient actif qui lui est appliqué. Les principales exigences pour les supports sont une grande surface et une grande porosité, une stabilité thermique, une inertie chimique, une résistance mécanique élevée. Dans certains cas, le support affecte les propriétés de la phase active (l'effet de "forte interaction métal-support"). Comme supports, des matériaux naturels (argiles, pierre ponce, diatomite, amiante, etc.) et synthétiques (charbons actifs, gel de silice, aluminosilicates, oxydes d'aluminium, magnésium, zirconium, etc.) sont utilisés.
Chimie de la catalyse
Chimie de la catalyseétudie les substances qui modifient la vitesse des réactions chimiques. Les substances qui ralentissent les réactions sont appelées inhibiteurs. Enzymes sont des catalyseurs biologiques. Le catalyseur n'est pas en relation stoechiométrique avec les produits et est régénéré après chaque cycle de conversion des réactifs en produits. Malgré l'émergence de nouvelles voies d'activation des molécules (chimie du plasma, rayonnement et effets laser, etc.), la catalyse est à la base de la production chimique (la part relative des procédés catalytiques est de 80 à 90 %).
La réaction qui a nourri l'humanité (la solution au problème de l'azote lié) est le cycle Haber-Bosch. L'ammoniac est produit avec un catalyseur de fer poreux. Se produit à P = 30 MPa et Т = 420-500 °C
3H 2 + N 2 \u003d 2NH 3
L'hydrogène pour la synthèse de NH 3 est obtenu par deux processus catalytiques séquentiels : la conversion de CH 4 (CH 4 + H 2 O → CO + 3H 2) sur des catalyseurs Ni - et la conversion du monoxyde de carbone résultant (CO + H 2 O → CO 2 + H 2) . Pour atteindre des taux de conversion élevés, la dernière réaction est réalisée en deux étapes : haute température (315-480 °C) - sur Fe - Cr - catalyseurs oxydes et basse température (200-350 °C) - sur Cu - Zn - catalyseurs d'oxyde. De l'ammoniac, de l'acide nitrique et d'autres composés azotés sont obtenus - des médicaments et des engrais aux explosifs.
Distinguer la catalyse "" homogène, hétérogène, interface, micellaire, enzymatique.
Énergie d'activation E les réactions catalytiques sont bien moindres que pour la même réaction en l'absence de catalyseur. Par exemple, pour la décomposition non catalytique de NH 3 en N 2 + H 2 E~ 320 kJ/mole, pour la même décomposition en présence de platine E~ 150 kJ/mole. Grâce à la réduction E les réactions catalytiques sont accélérées par rapport aux réactions non catalytiques.
Application de la catalyse dans l'industrie
hydrogénation
Un grand nombre de réactions catalytiques sont associées à l'activation d'un atome d'hydrogène et d'une autre molécule, conduisant à leur interaction chimique. Ce processus s'appelle l'hydrogénation et sous-tend de nombreuses étapes du raffinage du pétrole et de la production de combustibles liquides à partir du charbon (le processus Bergius). La production d'essence d'aviation et de carburant à partir du charbon s'est développée en Allemagne pendant la Seconde Guerre mondiale, car il n'y a pas de gisements de pétrole dans ce pays. Le procédé Bergius est l'addition directe d'hydrogène au carbone. Le charbon est chauffé sous pression en présence d'hydrogène et un produit liquide est obtenu, qui est ensuite transformé en essence d'aviation et en carburant. L'oxyde de fer est utilisé comme catalyseur, ainsi que des catalyseurs à base d'étain et de molybdène. Pendant la guerre, environ 1 400 tonnes de carburant liquide par jour ont été obtenues dans 12 usines allemandes utilisant le procédé Bergius. Un autre procédé, Fischer - Tropsch, se compose de deux étapes. Tout d'abord, le charbon est gazéifié, c'est-à-dire qu'il est mis à réagir avec de la vapeur d'eau et de l'oxygène et un mélange d'hydrogène et d'oxydes de carbone est obtenu. Ce mélange est transformé en combustible liquide à l'aide de catalyseurs contenant du fer ou du cobalt. Avec la fin de la guerre, la production de carburant synthétique à partir du charbon en Allemagne a été interrompue. À la suite de la hausse des prix du pétrole qui a suivi l'embargo sur le pétrole en 1973-1974, des efforts vigoureux ont été faits pour développer une méthode économiquement viable pour produire de l'essence à partir du charbon. Ainsi, la liquéfaction directe du charbon peut être réalisée plus efficacement en utilisant un procédé en deux étapes dans lequel le charbon est d'abord mis en contact avec un catalyseur alumine-cobalt-molybdène à une température relativement basse puis à une température plus élevée. Le coût d'une telle essence synthétique est plus élevé que celui obtenu à partir du pétrole.
catalyse acide
L'activité catalytique d'une grande classe de catalyseurs est due à leurs propriétés acides. Selon J. Bronsted et T. Lowry, un acide est un composé capable de donner un proton. Les acides forts cèdent facilement leurs protons aux bases. Le concept d'acidité a été développé dans les travaux de G. Lewis, qui a défini un acide comme une substance capable d'accepter une paire d'électrons d'une substance donneuse avec la formation d'une liaison covalente due à la socialisation de cette paire d'électrons. Ces idées, ainsi que des idées sur les réactions qui forment des ions carbénium, ont aidé à comprendre le mécanisme de diverses réactions catalytiques, en particulier celles impliquant des hydrocarbures.
La force d'un acide peut être déterminée à l'aide d'un ensemble de bases qui changent de couleur lorsqu'un proton est ajouté. Il s'avère que certains catalyseurs industriels importants se comportent comme des acides très forts. Ceux-ci incluent un catalyseur de Friedel-Crafts tel que HCl-AlCl 2 O 3 (ou HAlCl 4 ) et des aluminosilicates. La force d'un acide est une caractéristique très importante, puisqu'elle détermine le taux de protonation, étape clé du processus de catalyse acide.
L'activité des catalyseurs tels que les aluminosilicates utilisés dans le craquage du pétrole est déterminée par la présence d'acides de Bronsted et de Lewis à leur surface. Leur structure est similaire à la structure de la silice (dioxyde de silicium), dans laquelle certains des atomes de Si 4+ sont remplacés par des atomes d'Al 3+. La charge négative en excès qui apparaît dans ce cas peut être neutralisée par les cations correspondants.
L'activité des catalyseurs acides est déterminée par leur capacité à réagir avec les hydrocarbures avec formation d'un ion carbénium comme produit intermédiaire. Les ions alkylcarbénium contiennent un atome de carbone chargé positivement lié à trois groupes alkyle et/ou atomes d'hydrogène. Ils jouent un rôle important en tant qu'intermédiaires formés dans de nombreuses réactions impliquant des composés organiques. Le mécanisme d'action des catalyseurs acides peut être illustré par l'exemple de la réaction d'isomérisation n-butane en isobutane en présence de HCl-AlCl 3 ou Pt-Cl-Al 2 O 3 . Tout d'abord, une petite quantité d'oléfine C4H8 fixe l'ion hydrogène chargé positivement du catalyseur acide pour former un ion carbénium tertiaire. Ensuite, l'ion hydrure chargé négativement H - se sépare de n-butane pour former de l'isobutane et un ion butylcarbénium secondaire. Ce dernier, à la suite du réarrangement, se transforme en un ion carbénium tertiaire. Cette chaîne peut continuer avec l'élimination d'un ion hydrure de la molécule suivante n- butane, etc...
De manière significative, les ions carbénium tertiaires sont plus stables que les ions primaires ou secondaires. En conséquence, ils sont principalement présents à la surface du catalyseur et, par conséquent, le produit principal de l'isomérisation du butane est l'isobutane.
Les catalyseurs acides sont largement utilisés dans le raffinage du pétrole - craquage, alkylation, polymérisation et isomérisation des hydrocarbures. Le mécanisme d'action des ions carbénium, qui jouent le rôle de catalyseurs dans ces processus, a été établi. Dans le même temps, ils participent à un certain nombre de réactions, notamment la formation de petites molécules en divisant les grosses, la combinaison de molécules (oléfine avec oléfine ou oléfine avec isoparaffine), le réarrangement structurel par isomérisation, la formation de paraffines et d'hydrocarbures aromatiques par transfert d'hydrogène.
L'une des dernières applications industrielles de la catalyse acide est la production de carburants au plomb par addition d'alcools à l'isobutylène ou à l'isoamylène. L'ajout de composés oxygénés à l'essence réduit la concentration de monoxyde de carbone dans les gaz d'échappement. Méthyle- tert-butyl éther (MTBE) d'indice d'octane de mélange de 109 permet également d'obtenir le carburant à indice d'octane élevé nécessaire au fonctionnement d'un moteur automobile à taux de compression élevé sans recourir à l'introduction de plomb tétraéthyle dans l'essence. La production de carburants aux indices d'octane 102 et 111 est également organisée.
Hydrogénation d'huile végétale
L'une des réactions d'hydrogénation les plus importantes dans la pratique est l'hydrogénation incomplète des huiles végétales en margarine, huile de cuisson et autres produits alimentaires. Les huiles végétales sont obtenues à partir de graines de soja, de graines de coton et d'autres cultures. Ils comprennent des esters, à savoir des triglycérides d'acides gras avec différents degrés d'insaturation. L'acide oléique CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH a une double liaison C \u003d C, l'acide linoléique - deux et linolénique - trois. L'ajout d'hydrogène pour rompre cette liaison empêche les huiles de s'oxyder (rancissement). Cela augmente leur point de fusion. La dureté de la plupart des produits obtenus dépend du degré d'hydrogénation. L'hydrogénation est réalisée en présence d'une fine poudre de nickel déposée sur un substrat ou un catalyseur de nickel de Raney dans une atmosphère d'hydrogène hautement purifié.
Déshydrogénation
La déshydrogénation est également une réaction catalytique industriellement importante, bien que l'échelle de son application soit incomparablement plus petite. Avec son aide, par exemple, le styrène, un monomère important, est obtenu. Pour ce faire, déshydrogéner l'éthylbenzène en présence d'un catalyseur contenant de l'oxyde de fer ; le potassium et certains stabilisants structurels contribuent également à la réaction. À l'échelle industrielle, le propane, le butane et d'autres alcanes sont déshydrogénés. La déshydrogénation du butane en présence d'un catalyseur alumine-chrome produit des butènes et du butadiène.
Ammoniac
L'un des procédés d'hydrogénation les plus simples d'un point de vue chimique est la synthèse d'ammoniac à partir d'hydrogène et d'azote. L'azote est une substance très inerte. Pour rompre la liaison N-N dans sa molécule, une énergie de l'ordre de 200 kcal/mol est nécessaire. Cependant, l'azote se lie à la surface du catalyseur de fer à l'état atomique, et cela ne nécessite que 20 kcal / mol. L'hydrogène se lie encore plus facilement au fer.
catalyse basique
L'activité des catalyseurs est déterminée par leurs propriétés fondamentales. Un exemple ancien et bien connu de tels catalyseurs est l'hydroxyde de sodium utilisé pour hydrolyser ou saponifier les graisses dans la fabrication de savon, et un exemple récent est les catalyseurs utilisés dans la production de plastiques et de mousses de polyuréthane. L'uréthane est formé par l'interaction de l'alcool avec l'isocyanate, et cette réaction est accélérée en présence d'amines basiques. Au cours de la réaction, la base est attachée à l'atome de carbone dans la molécule d'isocyanate, à la suite de quoi une charge négative apparaît sur l'atome d'azote et son activité par rapport à l'alcool augmente. Un catalyseur particulièrement efficace est la triéthylènediamine. Les plastiques polyuréthanes sont obtenus en faisant réagir des diisocyanates avec des polyols (polyalcools). Lorsque l'isocyanate réagit avec l'eau, l'uréthane précédemment formé se décompose en libérant du CO2. Lorsqu'un mélange de polyalcools et d'eau réagit avec des diisocyanates, la mousse de polyuréthane résultante mousse avec du CO 2 gazeux.
Catalyseurs à double action
Ces catalyseurs accélèrent deux types de réactions et donnent de meilleurs résultats que le passage des réactifs en série dans deux réacteurs contenant chacun un seul type de catalyseur. Cela est dû au fait que les sites actifs du catalyseur à double effet sont très proches les uns des autres et que le produit intermédiaire formé sur l'un d'eux se transforme immédiatement en produit final sur l'autre. La combinaison d'un catalyseur activant l'hydrogène avec un catalyseur favorisant l'isomérisation des hydrocarbures donne un bon résultat. L'activation de l'hydrogène est réalisée par certains métaux, et l'isomérisation des hydrocarbures par des acides. Un catalyseur à double effet efficace utilisé dans le raffinage du pétrole pour convertir le naphta en essence est le platine finement dispersé déposé sur de l'alumine acide. La conversion des composants naphta tels que le méthylcyclopentane méthylcyclopentane (MCP) en benzène augmente l'indice d'octane de l'essence. Tout d'abord, le MCP est déshydrogéné sur la partie platine du catalyseur en une oléfine avec le même squelette carboné ; puis l'oléfine passe dans la partie acide du catalyseur, où elle s'isomérise en cyclohexène. Ce dernier passe dans la partie platine et se déshydrogéne en benzène et hydrogène. Les catalyseurs à double action accélèrent considérablement le reformage de l'huile. Ils sont utilisés pour isomériser les paraffines normales en isoparaffines. Ces derniers, bouillant aux mêmes températures que les fractions essence, sont précieux car ils ont un indice d'octane plus élevé par rapport aux hydrocarbures purs. De plus, la conversion du n-butane en isobutane s'accompagne d'une déshydrogénation, contribuant à la production de MTBE.
Polymérisation stéréospécifique
Une étape importante dans l'histoire de la catalyse a été la découverte de la polymérisation catalytique des oléfines avec formation de polymères stéréoréguliers. Les catalyseurs de polymérisation stéréospécifiques ont été découverts par K. Ziegler lorsqu'il a tenté d'expliquer les propriétés inhabituelles des polymères qu'il a obtenus. Un autre chimiste, J. Natta, a suggéré que l'unicité des polymères de Ziegler est déterminée par leur stéréorégularité. Des expériences de diffraction des rayons X ont montré que les polymères préparés à partir de propylène en présence de catalyseurs de Ziegler sont hautement cristallins et ont en effet une structure stéréorégulière. Natta a introduit les termes "isotactique" et "syndiotactique" pour décrire de telles structures ordonnées. Lorsqu'il n'y a pas d'ordre, le terme "atactique" est utilisé.
Une réaction stéréospécifique se produit à la surface des catalyseurs solides contenant des métaux de transition des groupes IVA-VIII (tels que Ti, V, Cr, Zr) dans un état incomplètement oxydé, et tout composé contenant du carbone ou de l'hydrogène, qui est associé à un métal de groupes I-III. Un exemple classique d'un tel catalyseur est le précipité formé lors de l'interaction de TiCl 4 et Al(C 2 H 5 ) 3 dans l'heptane, où le titane est réduit à l'état trivalent. Ce système extrêmement actif catalyse la polymérisation du propylène à température et pression normales.
oxydation catalytique
L'utilisation de catalyseurs pour contrôler la chimie des processus d'oxydation est d'une grande importance scientifique et pratique. Dans certains cas, l'oxydation doit être complète, par exemple lors de la neutralisation des contaminants CO et hydrocarbures dans les gaz d'échappement des voitures. Le plus souvent, cependant, il est souhaitable que l'oxydation soit incomplète, par exemple dans de nombreux procédés largement utilisés dans l'industrie pour la conversion d'hydrocarbures en intermédiaires de valeur contenant des groupes fonctionnels tels que -CHO, -COOH, -C-CO, - CN. Dans ce cas, des catalyseurs homogènes et hétérogènes sont utilisés. Un exemple de catalyseur homogène est un complexe de métal de transition, qui est utilisé pour oxyder le para-xylène en acide téréphtalique, dont les esters sont à la base de la production de fibres de polyester.
Production d'éthylène par déshydrodimérisation du méthane
La synthèse de l'éthylène par déshydrodimérisation permet de transformer le gaz naturel en hydrocarbures plus facilement transportables. La réaction 2CH 4 + 2O 2 → C 2 H 4 + 2H 2 O est réalisée à 850 °C en utilisant divers catalyseurs ; les meilleurs résultats sont obtenus avec le catalyseur Li-MgO. Vraisemblablement, la réaction se déroule par la formation d'un radical méthyle en séparant un atome d'hydrogène d'une molécule de méthane. Le clivage est réalisé par de l'oxygène incomplètement réduit, par exemple O2−
2. Les radicaux méthyle dans la phase gazeuse se recombinent pour former une molécule d'éthane et sont convertis en éthylène lors de la déshydrogénation ultérieure. Un autre exemple d'oxydation incomplète est la conversion du méthanol en formaldéhyde en présence d'un catalyseur à l'argent ou au fer-molybdène.
Catalyseurs d'oxydation hétérogènes
Ces catalyseurs sont généralement des oxydes solides complexes. L'oxydation catalytique se déroule en deux étapes. Tout d'abord, l'oxygène de l'oxyde est capturé par une molécule d'hydrocarbure adsorbée sur la surface de l'oxyde. L'hydrocarbure est oxydé et l'oxyde est réduit. L'oxyde réduit réagit avec l'oxygène et retourne à son état d'origine. A l'aide d'un catalyseur au vanadium, l'anhydride phtalique est obtenu par oxydation partielle du naphtalène ou du butane.
Définition de la catalyse. Types de catalyse. Chimisorption et formation d'un complexe intermédiaire activé. Énergie d'activation d'une réaction catalytique. Catalyse et équilibre. application de la catalyse.
Catalyse- le phénomène d'excitation des réactions chimiques par des substances spéciales - catalyseurs. Le catalyseur entre à plusieurs reprises dans une interaction chimique intermédiaire avec les substances impliquées dans la réaction et restaure sa composition après chaque cycle d'interactions intermédiaires.
catalyse homogène– les réactifs et le catalyseur forment une seule phase.
catalyse hétérogène- les substances et le catalyseur sont dans des phases différentes.
Catalyse microhétérogène occupe une position intermédiaire entre la catalyse homogène et hétérogène. Le catalyseur est une grosse molécule de polymère. Pour les petites molécules qui interagissent dessus, elles s'apparentent à des particules hétérogènes, mais elles forment une phase avec les réactifs. Ce groupe comprend les réactions enzymatiques dans lesquelles le catalyseur (enzyme) est constitué de grosses molécules protéiques de composition et de structure complexes. Par conséquent, il est appelé catalyse enzymatique.
La transformation chimique passe par la formation d'un complexe actif avec un excès d'énergie. C'est suffisant pour le réarrangement de nouvelles substances - produits de réaction. Modification de l'énergie du système lors de l'interaction chimique le long du chemin de réaction (1).
A - complexe activé
K - connexion intermédiaire avec un catalyseur
E 0, E k - énergies des substances et produits initiaux
E 1, E 2 - énergies d'activation de la transformation dans les sens direct et inverse
∆H est la variation d'énergie résultant de la transformation (effet thermique).
Mais toutes les molécules n'ont pas suffisamment d'énergie pour former un complexe actif - seulement celles dont l'énergie dépasse l'énergie d'activation E 1 . Si l'énergie requise E 1 est grande, la réaction ne se déroule pratiquement pas.
Le catalyseur ouvre une nouvelle voie de réaction en réagissant chimiquement pour former un complexe activé avec moins d'énergie qu'il n'en faut pour former un complexe activé sans catalyseur. Le composé intermédiaire, qui comprend un catalyseur, est ensuite converti en produits par un autre complexe activé, mais également avec une énergie inférieure. Après la deuxième étape de la réaction, le catalyseur restaure sa composition chimique et ses composants n'entrent pas dans la composition des produits. Et bien que le chemin réactionnel s'allonge et devienne une étape, une diminution de l'énergie du complexe activé entraîne une augmentation de la vitesse de réaction (2).
Origine inconnue
Un intérêt particulier pour la catalyse s'est manifesté lors du développement de la chimie industrielle, car la capacité d'accélérer les réactions chimiques dans la bonne direction sans consommer d'énergie et essentiellement sans consommer la substance catalytique elle-même a donné à la catalyse une grande importance pratique. Avec l'aide de la catalyse, les problèmes rencontrés par la technologie de l'azote lié sont résolus, plus de 80% du pétrole est traité par des procédés catalytiques, il est impossible de réaliser la plupart des procédés de synthèse organique.
Catalyseurs- substances qui, entrant à plusieurs reprises dans une interaction intermédiaire avec les participants à la réaction, modifient son mécanisme et augmentent la vitesse de réaction; en même temps, ils restaurent leur composition chimique après chaque cycle d'expositions intermédiaires.
L'effet d'un catalyseur sur le mécanisme d'une réaction chimique peut être expliqué par un exemple classique. Soit une réaction en une étape se dérouler avec une énergie d'activation E 0 :
Le déroulement de la réaction sur le diagramme énergétique des réactions catalytiques et non catalytiques est représenté par la courbe 1. En présence d'un catalyseur, le mécanisme de la réaction change, il passe par plusieurs étapes successives (courbe 2). Par exemple, la première étape peut être la formation d'un complexe Akt activé intermédiaire :
A + Kt → AKt
Le complexe activé réagit alors avec un second réactif pour former un complexe catalyseur-produit :
ACT + V → RKt
La dernière étape est la décomposition du complexe RKt avec la formation du produit K et la libération du catalyseur pour un nouveau cycle catalytique :
Rkt → R + Kt
Chacun de ces étages successifs est caractérisé par ses énergies d'activation E 1 , E 2 , E 3 , mais, en règle générale, la hauteur de chacune de ces barrières de potentiel est inférieure à l'énergie d'activation E 0 . Ainsi, en présence d'un catalyseur, la réaction se déroule selon une voie énergétiquement plus favorable, ce qui permet de réaliser le processus à une vitesse plus élevée.
Les états énergétiques initial (I) et final (II) du système réactionnel en présence d'un catalyseur et sans celui-ci restent les mêmes ; Par conséquent: le catalyseur ne peut pas modifier l'état d'équilibre chimique, qui est indépendant du chemin de réaction.
Le rôle du catalyseur est uniquement de modifier la vitesse à laquelle l'état d'équilibre est atteint. Un catalyseur ne peut qu'augmenter la vitesse des processus thermodynamiquement autorisés, mais ne peut pas initier de réactions thermodynamiquement impossibles.
Certaines réactions chimiques sans catalyseur sont pratiquement impossibles à cause d'une énergie d'activation trop élevée. Il semblerait que pour franchir une barrière énergétique élevée, il soit possible d'augmenter l'énergie cinétique des molécules, c'est-à-dire d'augmenter la température. Mais pour de nombreuses réactions exothermiques réversibles, une augmentation de la température entraîne un déplacement de l'équilibre dans le sens opposé et rend la réaction non résolue thermodynamiquement. Dans de tels cas, l'utilisation de catalyseurs est non seulement justifiée, mais également nécessaire. Le catalyseur réduit énergie d'activation et permet ainsi de l'effectuer à des températures nettement inférieures.
Les molécules de réactif sont adsorbées sur la surface du catalyseur. L'adsorption est un phénomène lié à une diminution de la quantité de gaz lorsqu'un gaz (adsorbat) entre en contact avec un solide (adsorbant), et consiste en un certain compactage du gaz à la surface du solide. L'adsorption physique et la chimisorption se distinguent selon la nature des forces qui provoquent cette concentration de molécules d'adsorbat à la surface d'un solide. Si ces forces sont de même nature que l'action moléculaire dans les gaz, les liquides et les solides, on parle alors d'adsorption physique. À chimisorption des forces d'interaction de nature chimique se manifestent - les molécules d'adsorbat perdent leur individualité, formant des composés de surface avec l'adsorbant.
Au cours des processus catalytiques, le rôle principal appartient à la chimisorption, ou adsorption activée, qui aboutit à la formation complexe d'adsorption activé- un intermédiaire instable entre le réactif et le catalyseur. L'étape d'adsorption activée détermine la spécificité de l'action des catalyseurs vis-à-vis des différentes réactions. Si la liaison chimique du réactif avec l'adsorbant est trop forte, la destruction de la formation du complexe, conduisant à la formation de produits, est difficile. Si la liaison entre l'adsorbant et l'adsorbat est trop faible, de nature proche de l'adsorption physique, alors il n'y a pas de relâchement des liaisons dans la molécule d'adsorbat, ce qui conduit à une diminution de l'énergie d'activation du procédé catalytique par rapport au non -catalytique.
Technologie chimique générale, Kutepov A.M., Moscou, École supérieure, 1990, pp. 206-207, 214, 205
Catalyse(Le grec κατάλυσις remonte à καταλύειν - destruction) - accélération sélective de l'une des directions thermodynamiquement possibles d'une réaction chimique sous l'action d'un ou plusieurs catalyseurs, qui entrent à plusieurs reprises dans une interaction chimique intermédiaire avec les participants à la réaction et restaure sa composition chimique après chaque cycle d'interactions chimiques intermédiaires. Le terme « catalyse » a été introduit en 1835 par le scientifique suédois Jöns Jakob Berzelius (acide nitrique, etc.). La plupart de toutes les réactions industrielles sont catalytiques. Le cas où le catalyseur est l'un des produits de la réaction ou ses matières premières est appelé autocatalyse. Le catalyseur modifie le mécanisme de réaction en un mécanisme énergétiquement plus favorable, c'est-à-dire qu'il réduit l'énergie d'activation. Le catalyseur forme un composé intermédiaire avec une molécule de l'un des réactifs, dans lequel les liaisons chimiques sont affaiblies. Ceci facilite sa réaction avec le second réactif. Il est important de noter que les catalyseurs accélèrent les réactions réversibles dans les sens direct et inverse. Par conséquent, ils ne modifient pas l'équilibre chimique [
Application de la catalyse dans l'industrie
hydrogénation[éditer | modifier le texte du wiki]
Un grand nombre de réactions catalytiques sont associées à l'activation d'un atome d'hydrogène et d'une autre molécule, conduisant à leur interaction chimique. Ce processus s'appelle l'hydrogénation et sous-tend de nombreuses étapes du raffinage du pétrole et de la production de combustibles liquides à partir du charbon (le processus Bergius). La production d'essence d'aviation et de carburant à partir du charbon s'est développée en Allemagne pendant la Seconde Guerre mondiale, car il n'y a pas de gisements de pétrole dans ce pays. Le procédé Bergius est l'addition directe d'hydrogène au carbone. Le charbon est chauffé sous pression en présence d'hydrogène et un produit liquide est obtenu, qui est ensuite transformé en essence d'aviation et en carburant. L'oxyde de fer est utilisé comme catalyseur, ainsi que des catalyseurs à base d'étain et de molybdène. Pendant la guerre, environ 1 400 tonnes de carburant liquide par jour ont été obtenues dans 12 usines allemandes utilisant le procédé Bergius. Un autre procédé, Fischer - Tropsch, se compose de deux étapes. Tout d'abord, le charbon est gazéifié, c'est-à-dire qu'il est mis à réagir avec de la vapeur d'eau et de l'oxygène et un mélange d'hydrogène et d'oxydes de carbone est obtenu. Ce mélange est transformé en combustible liquide à l'aide de catalyseurs contenant du fer ou du cobalt. Avec la fin de la guerre, la production de carburant synthétique à partir du charbon en Allemagne a été interrompue. À la suite de la hausse des prix du pétrole qui a suivi l'embargo sur le pétrole en 1973-1974, des efforts vigoureux ont été faits pour développer une méthode économiquement viable pour produire de l'essence à partir du charbon. Ainsi, la liquéfaction directe du charbon peut être réalisée plus efficacement en utilisant un procédé en deux étapes dans lequel le charbon est d'abord mis en contact avec un catalyseur alumine-cobalt-molybdène à une température relativement basse puis à une température plus élevée. Le coût d'une telle essence synthétique est plus élevé que celui obtenu à partir du pétrole.
catalyse acide[éditer | modifier le texte du wiki]
L'activité catalytique d'une grande classe de catalyseurs est due à leurs propriétés acides. Selon J. Bronsted et T. Lowry, un acide est un composé capable de donner un proton. Les acides forts cèdent facilement leurs protons aux bases. Le concept d'acidité a été développé dans les travaux de G. Lewis, qui a défini un acide comme une substance capable d'accepter une paire d'électrons d'une substance donneuse avec la formation d'une liaison covalente due à la socialisation de cette paire d'électrons. Ces idées, ainsi que des idées sur les réactions qui forment des ions carbénium, ont aidé à comprendre le mécanisme de diverses réactions catalytiques, en particulier celles impliquant des hydrocarbures.
Selon l'influence sur la vitesse de réaction, la catalyse est divisée en positive (la vitesse de réaction augmente) et négative (la vitesse de réaction diminue). Dans ce dernier cas, un processus d'inhibition a lieu, qui ne peut être considéré comme une "catalyse négative", puisque l'inhibiteur est consommé au cours de la réaction.
La catalyse se produit homogène et hétérogène(prendre contact). En catalyse homogène, le catalyseur est dans la même phase que les réactifs, tandis que les catalyseurs hétérogènes diffèrent en phase.
catalyse homogène[éditer | modifier le texte du wiki]
Un exemple de catalyse homogène est la décomposition du peroxyde d'hydrogène en présence d'ions iode. La réaction se déroule en deux étapes :
H 2 O 2 + I → H 2 O + IO
H 2 O 2 + IO → H 2 O + O 2 + I
En catalyse homogène, l'action du catalyseur est due au fait qu'il interagit avec les réactifs pour former des composés intermédiaires, ce qui entraîne une diminution de l'énergie d'activation.
catalyse hétérogène[éditer | modifier le texte du wiki]
En catalyse hétérogène, l'accélération du processus se produit généralement à la surface d'un corps solide - le catalyseur, de sorte que l'activité du catalyseur dépend de la taille et des propriétés de sa surface. En pratique, le catalyseur est généralement supporté sur un support solide poreux.
Le mécanisme de la catalyse hétérogène est plus compliqué que celui de la catalyse homogène. Le mécanisme de la catalyse hétérogène comprend cinq étapes, toutes réversibles.
1. Diffusion de réactifs à la surface d'un solide
2. Adsorption physique sur les sites actifs de la surface d'une substance solide de molécules en réaction puis leur chimisorption
3. Réaction chimique entre molécules en réaction
4. Désorption des produits de la surface du catalyseur
5. Diffusion du produit de la surface du catalyseur dans le flux général
Un exemple de catalyse hétérogène est l'oxydation de SO 2 en SO 3 sur un catalyseur V 2 O 5 dans la production d'acide sulfurique (méthode de contact).
Le déroulement de la réaction à la surface du catalyseur peut être démontré dans une expérience dans laquelle une plaque de platine est chauffée dans la flamme d'un brûleur à gaz, puis la flamme est éteinte et un jet de gaz du brûleur est soufflé sur la plaque , tandis que la plaque redevient rouge - une oxydation du méthane se produit à la surface du métal.
La catalyse est l'une des méthodes les plus courantes en chimie pour accélérer les réactions chimiques.
catalyse appelée modification sélective de la vitesse des réactions chimiques en présence de substances (catalyseurs) qui, participant à des processus intermédiaires, sont régénérées au cours de la réaction et ne font pas partie des produits finaux.
catalyse positive, ou simplement catalyse, - il s'agit d'une augmentation significative de la vitesse d'une réaction, par exemple la production d'acide sulfurique ou l'oxydation de l'ammoniac en présence de platine. catalyse négative, ou inhibition, - il s'agit d'un ralentissement de la réaction, par exemple, l'interaction d'une solution de sulfite de sodium avec l'oxygène atmosphérique en présence d'alcool éthylique ou la décomposition du peroxyde d'hydrogène à de faibles concentrations d'acide sulfurique (inhibiteurs, respectivement, alcool éthylique et acide sulfurique) .
Les réactions qui se produisent sous l'action de catalyseurs sont dites catalytiques.
L'action d'un catalyseur dans le processus de modification d'un système chimique peut être non seulement accélérant, mais aussi guidage: si le système chimique initial peut se développer dans plusieurs directions thermodynamiquement possibles dans des conditions données, le catalyseur accélère majoritairement l'une d'entre elles.
La catalyse modifie le mécanisme de réaction. Le catalyseur et l'une des matières premières forment complexe activé- un composé intermédiaire qui réagit avec un autre produit de départ pour former des produits de réaction et régénérer des molécules de catalyseur.
Soit une réaction A + B = AB ayant une énergie d'activation très élevée E un et donc procéder lentement. Son diagramme d'énergie est représenté sur la fig. 4.4, une.
Riz. 4.4. Changement d'enthalpie au cours de la réaction : a - sans catalyseur : b- avec catalyseur
Si cette réaction est effectuée en présence de catalyseur K (Fig. 4.4, b), elle entre alors en interaction chimique avec l'une des substances de départ (par exemple, A), à la suite de quoi, à travers la batterie activée complexe *, un composé chimique instable AK se forme selon la réaction A + K = AK. L'énergie d'activation de ce processus E" inférieur à celui en l'absence de catalyseur (E a "par conséquent, la réaction se déroule rapidement. De plus, l'intermédiaire AA via un autre complexe activé, AVK *, interagit avec le deuxième matériau de départ B: AK + B \u003d AB + K; dans ce cas, le catalyseur revient à son état d'origine L'énergie d'activation de ce processus est également faible (E "qui le fait se dérouler à grande vitesse. En additionnant les deux processus se produisant successivement, l'équation finale d'une réaction rapide est obtenue: A + B (+ K) \u003d AB (+ K). Le catalyseur est indiqué dans cette équation uniquement pour souligner le fait de sa régénération.
Le point commun à tous les catalyseurs est qu'ils modifient toujours l'énergie d'activation, la diminuant avec une catalyse positive, c'est-à-dire abaissement de la hauteur de la barrière énergétique. En présence d'un catalyseur, un complexe activé se forme avec un niveau d'énergie plus faible que sans lui, ce qui entraîne une augmentation significative de la vitesse de réaction.
Selon la caractéristique de phase, on distingue la catalyse homogène (homogène) et hétérogène (non uniforme); la catalyse enzymatique est considérée séparément.
À catalyse homogène le catalyseur et les réactifs forment une phase (gaz ou solution) dans laquelle il n'y a pas d'interfaces (limites de phase). Les procédés catalytiques en phase gazeuse et liquide sont très nombreux. Un exemple de catalyse homogène en phase gazeuse est l'oxydation catalytique de l'oxyde de soufre (IV) dans le procédé en chambre de production d'acide sulfurique. Oxydation du dioxyde de soufre en trioxyde selon la réaction :
coule lentement. L'introduction du catalyseur NO modifie le mécanisme de réaction : 
et réduit l'énergie d'activation, et augmente donc la vitesse de la réaction.
En catalyse homogène, la vitesse d'une réaction chimique est proportionnelle à la concentration du catalyseur. Les inconvénients de la catalyse homogène en solution sont la plage de température limitée et, dans certains cas, la difficulté à séparer le catalyseur des produits de réaction.
À catalyse hétérogène le catalyseur (généralement un solide) est dans le système en tant que phase indépendante, c'est-à-dire il existe une interface entre le catalyseur et les réactifs (gaz ou liquides). Ainsi, l'oxydation de l'ammoniac (phase gazeuse) s'effectue en présence de platine (phase solide), et la décomposition du peroxyde d'hydrogène (phase liquide) est accélérée par le charbon ou l'oxyde de manganèse (IV), présent sous la forme d'un phase solide :
En catalyse hétérogène, toutes les réactions se déroulent à la limite de phase, c'est-à-dire à la surface du catalyseur, dont l'activité dépend des propriétés de sa surface - taille de la zone, composition chimique, défaut de la structure et de l'état. Les caractéristiques de la cinétique des processus sont déterminées par la diffusion et l'adsorption.
La surface du catalyseur (adsorbant) est physiquement inhomogène et présente ce que l'on appelle centres actifs, sur lequel les réactions catalytiques se déroulent principalement en raison de l'adsorption de réactifs (adsorbats) sur ces centres et d'une augmentation de leur concentration à la surface du catalyseur. Cela accélère en partie la réaction. Cependant, la raison principale de l'augmentation de la vitesse de réaction est une augmentation significative de l'activité chimique des molécules adsorbées, dans laquelle les liaisons entre atomes sont affaiblies sous l'action d'un catalyseur, ce qui rend ces molécules plus réactives. L'accélération de la réaction dans ce cas se produit également à la suite d'une diminution de l'énergie d'activation, à laquelle la formation d'intermédiaires de surface apporte également une certaine contribution.
Substances empoisonnant le catalyseur solide, c'est-à-dire réduire ou détruire complètement son activité sont appelés poisons catalytiques. Par exemple, les composés d'arsenic, de mercure, de plomb, de cyanures empoisonnent les catalyseurs au platine, qui doivent être régénérés dans les conditions de production dans ce cas.
Les substances qui renforcent l'action des catalyseurs pour une réaction donnée, mais ne sont pas elles-mêmes des catalyseurs, sont appelées promoteurs. Il est connu, par exemple, de favoriser les catalyseurs au platine avec des ajouts de fer, d'aluminium, etc.
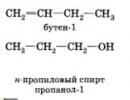
Sélectivité (sélectivité) d'action L'utilisation de catalyseurs se manifeste notamment par le fait qu'à l'aide de différents catalyseurs, il est possible d'obtenir différents produits à partir de la même substance. Ainsi, en présence d'un catalyseur Al 2 O e à 300°C, l'eau et l'éthylène sont obtenus à partir d'alcool éthylique :

Mais si la poudre de cuivre est utilisée comme catalyseur à la même température, l'alcool éthylique se décompose en hydrogène et acétaldéhyde :
Ainsi, pour chaque réaction, il y a un catalyseur.
Avec la participation de catalyseurs biologiques, enzymes des processus chimiques complexes ont lieu dans les organismes végétaux et animaux. Par exemple, la salive contient l'enzyme ptyaline, qui catalyse la conversion de l'amidon en sucre, et la pepsine, présente dans le suc gastrique, favorise la dégradation des protéines. Il existe environ 3 000 enzymes différentes dans le corps humain, dont chacune est un catalyseur efficace pour la réaction correspondante.
De nombreux catalyseurs, en particulier des enzymes, ont purement individuel action catalytique, c'est pourquoi on les appelle spécifique individuellement.