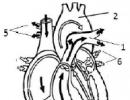
Segude eraldamise meetodid. Segude valmistamine ja nende eraldamise meetodid Vedelsegude eraldamise protsess
Tunni eesmärgid:
Haridus - luua tingimused homogeensete ja mittehomogeensete segude kontseptsiooniga tutvumiseks, puhta aine kui püsivate omadustega ainega, näidata selle erinevust segudest. Näidake erinevaid segude eraldamise meetodeid.
Haridus - luua tingimused huvi tekkimiseks teadmiste, oskuste vastu, nende tegevuse adekvaatseks hindamiseks. Jätkata keskkonnakasvatust, austust keskkonna vastu.
Arendav - Luua tingimused õpilaste oskuste kujunemise jätkamiseks koostada anorgaaniliste ainete valemeid nimetuse järgi ja nimetada aineid valemite järgi; õpilaste anorgaaniliste ühendite klasside valemite järgi äratundmise oskuse arendamise jätkamine; puhaste ainete ja ainesegude äratundmise oskuse arendamine; ainesegude eraldamise tegevuskava koostamise oskuse kujundamine; segude eraldamise võime tekkimine settimise, filtreerimise, magneti abil, aurustamise teel.
Eesmärgid õpilasele:
- tundma puhta aine mõistet
– tundma heterogeensete ja homogeensete segude mõisteid
– tunneb segude eraldamise meetodeid: settimine, filtreerimine, aurustamine, destilleerimine
Teadma kaasaegseid veepuhastusmeetodeid
Oskab eraldada segusid settimise, filtreerimise, magneti kasutamise, aurustamise teel
Tundide ajal
1. Organisatsioonimoment
(tunni alguse korraldamine)
Tervitamine, soodsa emotsionaalse fooni loomine, kohalolijate kontrollimine, tunniks valmisoleku kontrollimine.
2. Kodutööde kontrollimine (kodutööde kontrollimine)
§ 1
Ülesanded 7–10
§ 4
3. Eesmärkide seadmine, motiveerimine (teema sõnum, tunni eesmärgid)
Tunni teema: Puhtad ained ja segud. Segude eraldamise meetodid.
Mida arvate, milliseid eesmärke saame tänaseks tunniks seada?
(Eesmärgid õpilasele)
Me teame väga hästi, mis on puhtus. Puhas tuba, puhas märkmik, puhtad riided... Ja mida tähendab puhta aine mõiste? Mis vahe on puhtal ainel ja ainete segul?
4. Põhiteadmiste ja -oskuste aktualiseerimine
Uurime välja küsimused: Mida nimetatakse aineks? (Aine on see, millest füüsilised kehad koosnevad)
5. Uue materjali õppimine (uute teadmiste ja tegevusmeetodite omandamine)
puhas aine.
Destilleeritud ja merevesi kuumutati kahes anumas keemiseni. Teatud aja pärast mõõdeti nendes anumates keemistemperatuurid). Õpilased arutavad katse tulemusi. Iseenesest tekib küsimus-probleem, mille ütleb õpetaja: "Miks ei ole merevee pall erinevate intervallidega konstantne, võrreldes t destilleeritud veepallidega." Õpilased järeldavad, et merevee soolsus mõjutab t palli Õpetaja abiga formuleeritakse definitsioon „Puhas aine on aine, millel on püsivad füüsikalised omadused (keemistemperatuurid, sulamistemperatuurid, tihedus).
Segud ja nende klassifikatsioon
Õpetaja kutsub õpilasi üles kaaluma näidislaual olevaid segusid. Järgmisena määratlevad poisid segu mitme oma aine kombinatsioonina, mis on üksteisega otseses kokkupuutes. Õpetaja lisab, et absoluutselt puhtaid aineid looduses pole. Ained esinevad peamiselt segudena. Ta räägib õhust kui segust, mis koosneb gaasidest - lämmastik, hapnik, argoon jne. Õhusaaste: Õhu väävli ja vääveldioksiidi sisalduse muutused toovad kaasa puulehtede kollaseks muutumise või värvimuutuse ja kääbuse. Inimestel ärritab see gaas ülemisi hingamisteid. Süsinikmonooksiidi sisalduse suurenemine õhus viib erütrotsüütide hemoglobiini hapniku transportimise võime vähenemiseni, mille tõttu inimese reaktsioonid aeglustuvad, taju on nõrgenenud, ilmnevad peavalu, unisus, iiveldus. Suures koguses süsinikmonooksiidi kokkupuude võib põhjustada minestamist, koomat ja isegi surma.
See hägune vedelik on vee ja kriidi segu. Segus olevad kriidiosakesed on palja silmaga nähtavad. Välimuselt pole aga alati võimalik aimata, et sul on segu ees. Näiteks piim tundub meile homogeenne, kuid mikroskoobi all on märgata, et see koosneb rasvapiiskadest, lahuses hõljuvatest valgumolekulidest. Kas sa arvad, et vihmavesi on puhas aine? Ja õhk? Teie ees on kaks klaasi, millest ühes on selge vedelik - vesi ja teises - suhkru lahus vees. Suhkruosakesi ei saa näha mitte ainult palja silmaga, vaid isegi kõige võimsama mikroskoobiga. Seega on segud erinevad. Millisesse kahte rühma saab segusid välimuse järgi jagada? (homogeenne ja heterogeenne). Täida töökaartidel olev skeem. Milliseid segusid nimetatakse heterogeenseteks? (Heterogeensed segud on need, milles segu moodustavate ainete osakesi on näha palja silmaga või mikroskoobiga.) Milliseid segusid võib nimetada homogeenseteks? (Homogeensed segud on segud, milles isegi mikroskoobiga on võimatu tuvastada segus sisalduvate ainete osakesi.)
Homogeenne – suhkrulahused vees, NaCl, õhk
Heterogeenne - Fe +S, NaCl ja suhkru segu, savi veega
Uute teadmiste mõistmise esmane test
Poisid, kas me kohtame looduses sageli puhtaid aineid? (Ei, ainete segud on levinumad).
Graniit on teie ees. Mis on segu või puhas aine? (Segu).
Kuidas sa arvasid? (Graniit on teralise struktuuriga, selles on märgata kvartsi, vilgukivi, päevakivi osakesi.).
Segu eraldamise peamised meetodid.
Näidiskatse "Taimeõli ja vee segu eraldamine."
Siin on taimeõli ja vee segu. Määrake segu tüüp. (Heterogeenne). Võrrelge õli ja vee füüsikalisi omadusi. (Need on üksteises lahustumatud vedelad ained, millel on erinev tihedus). Soovitage selle segu eraldamise meetodit. (Laste soovitused). Seda meetodit nimetatakse settimiseks. See viiakse läbi eralduslehtri abil. Täidame töökaartidel tabeli "Heterogeensete segude eraldamise meetodid".
Näidiskatse "Segude eraldamine".
heterogeenne raua ja väävli segu. Seda segu saab eraldada setitamisega, nagu väävel ja raud on vees lahustumatud tahked ained. Kui valate selle segu vette, hõljub väävel pinnale ja raud vajub alla. Samuti saab seda segu eraldada magnetiga, kuna. rauda tõmbab magnet, väävlit aga mitte.
Liiva ja vee segu. See on ebahomogeenne segu. Eraldasime selle filtreerimise teel.
Erinevad viisid segude filtreerimiseks
Filtreerimist saab teha mitte ainult paberfiltriga. Filtreerimiseks võib kasutada ka muid lahtisi või poorseid materjale. Selle meetodi puhul kasutatavate puistematerjalide hulka kuuluvad näiteks kvartsliiv. Ja poorsele - põletatud savi ja klaasvill. Samuti on olemas "kuumfiltreerimise" meetodi kontseptsioon. Selle meetodi abil saab eraldada erineva sulamistemperatuuriga tahkete ainete segusid.
Soola lahus vees. See on homogeenne segu. Eraldasime selle aurustamisega.
Kuid on veel võimalusi homogeensete segude eraldamiseks. Üks neist on kromatograafia.
Kromatograafia avastamise ajalugu
Kromatograafia kui ainete eraldamise meetod pakkus 1903. aastal välja vene botaanik M.S. Värv (1872–1919). Teda huvitas probleem, kas looduslik roheline värvaine klorofüll, mis on taimede lehtede osa, on üksikaine või ainete segu? Selle väljaselgitamiseks täitis ta klaastoru kriidiga, valas ühest otsast klorofülli lahust ja pesi lahustiga. Mööda toru liikudes moodustas klorofüll mitu tsooni, mis erinevad värvi poolest. Selle tulemusena leidis teadlane, et klorofüll on ainete segu. Ta nimetas pakutud segude eraldamise meetodit kromatograafiaks. Sõna-sõnalt tähendab "värvimaali".
Teine võimalus homogeense segu eraldamiseks on destilleerimine või destilleerimine.
Destilleerimise ajalugu
Destilleerimine tähendab ladina keeles "tilguti". Vanimad destilleerimisahela kirjeldused on toodud Maarja alkeemiat käsitlevas töös (see on 1. sajand pKr). Destillaatoril oli anum, väljalasketoru ja niiske käsnaga jahutatud vastuvõtja. Nii et madalal temperatuuril keevate vedelike destilleerimine selles oli võimatu. Anuma külge sai kinnitada isegi mitu toruga vastuvõtjat.
7. Teadmiste kinnistamine, esmaste oskuste ja vilumuste kujundamine (teadmiste ja tegevusmeetodite kinnistamine)
ÜLESANNE nr 1
Tooge näiteid segudest, mida saab eraldada filtreerimise, settimisega. Kirjuta oma vastus tabelisse.
ÜLESANNE nr 2
Purustatud kork sattus kogemata suhkru sisse. Kuidas sellest suhkrut puhastada?
ÜLESANNE nr 3
Tooge näide kolme aine segust ja loetlege nende eraldamiseks vajalike toimingute jada.
8. Teadmiste üldistamine ja süstematiseerimine
Seega, poisid, tutvusime peamiste ainete puhastamise meetoditega (loetlege need). Tehke üldine järeldus, millel segude eraldamine alati põhineb? Kas segudes sisalduvad ained säilitavad oma omadused? Märkige väljundmärkmikus: segudes säilitavad ained oma individuaalsed omadused. Segude eraldamine põhineb segus sisalduvate ainete füüsikaliste omaduste erinevustel.
9. Teadmiste kontroll ja enesekontroll
Määrake tabelist seadmed, mis on vajalikud selles märgitud segude eraldamiseks. Õigetele vastustele vastavatest tähtedest moodustate veel ühe puhaste ainete saamise meetodi nime.
|
Seadme nimi |
Segu koostis |
|||
|
päevalilleõli ja vesi |
savi ja vesi |
Merevesi |
raud ja vask |
|
|
lehtri kemikaal |
||||
|
Eralduslehter |
||||
|
Keeduklaas |
||||
|
piirituslamp |
||||
|
Filter |
||||
|
portselanist tass |
||||
|
Magnet |
||||
10. Õppetunni kokkuvõtte tegemine
Mõistatuse kontrollimine, Tunnis töö hinded.
Kaardil pole valgeid laike,
Kogu maa on ammu avatud,
Oodatud on aga julgemad
Tõelised avastused!
11. Peegeldus
Mida uut sa täna tunnis õppisid?
Mida sa mäletad?
Mis teile meeldis ja mis teie arvates ei toiminud?
12. Info kodutööde kohta ja juhised selle täitmiseks (kodutöö, kodutööde konsultatsioon)
§ 2
Ülesanded 2, 4–6
Teadma mõistete definitsiooni: puhtad ained, homogeensed ja heterogeensed segud; iga segude eraldamise meetodi olemus. Vasta küsimustele 2, 4-6. Vabatahtlik: koosta sõnum teemal “Keemilise analüüsi meetodite rakendamine kohtuekspertiisi, arheoloogi, arsti, kunstiajaloolase töös” või koosta ristsõna, kasutades tänase tunni mõisteid ja segude eraldamiseks vajalike seadmete nimetust.
teoreetiline blokk.
Mõiste "segu" määratleti 17. sajandil. Inglise teadlane Robert Boyle: "Segu on terviklik süsteem, mis koosneb heterogeensetest komponentidest."
Segu ja puhta aine võrdlusomadused
Võrdlusmärgid | puhas aine | Segu |
Püsiv | püsimatu |
|
Ained | Sama | Erinevad |
Füüsikalised omadused | Alaline | Tujukas |
Energia muutub moodustumise ajal | edasi minema | Ei juhtu |
Eraldamine | Keemiliste reaktsioonide kaudu | Füüsikalised meetodid |
Segud erinevad üksteisest välimuse poolest.
Segude klassifikatsioon on näidatud tabelis:
Siin on näited suspensioonidest (jõeliiv + vesi), emulsioonidest (taimeõli + vesi) ja lahustest (õhk kolvis, sool + vesi, väike vahetus: alumiinium + vask või nikkel + vask).
Segude eraldamise meetodid
Looduses esinevad ained segudena. Laboriuuringuteks, tööstuslikuks tootmiseks, farmakoloogia ja meditsiini vajadusteks on vaja puhtaid aineid.
Ainete puhastamiseks kasutatakse erinevaid segude eraldamise meetodeid.
Aurustumine – vedelikus lahustunud tahkete ainete eraldamine selle auruks muutmise teel.

destilleerimine - destilleerimine, vedelsegudes sisalduvate ainete eraldamine keemistemperatuuride järgi, millele järgneb auru jahutamine.
Looduses vett puhtal kujul (ilma sooladeta) ei esine. Ookeani-, mere-, jõe-, kaevu- ja allikavesi on vees leiduvate soolalahuste sordid. Tihti vajavad inimesed aga puhast vett, mis ei sisalda soolasid (kasutatakse automootorites; keemiatootmises erinevate lahuste ja ainete saamiseks; fotode valmistamisel). Sellist vett nimetatakse destilleeritud ja selle saamise meetodit nimetatakse destilleerimiseks.

Filtreerimine on vedelike (gaaside) filtreerimine läbi filtri, et puhastada need tahketest lisanditest.

Need meetodid põhinevad segu komponentide füüsikaliste omaduste erinevustel.
Kaaluge eraldamise viise heterogeenneja homogeensed segud.
Segu näide | Eraldamise meetod |
Suspensioon - jõeliiva segu veega | settimine Eraldamine toetades mis põhinevad ainete erinevatel tihedustel. Raskem liiv settib põhja. Võite ka emulsiooni eraldada: õli või taimeõli eraldamiseks veest. Laboris saab seda teha eralduslehtri abil. Õli või taimeõli moodustab pealmise heledama kihi. Settumise tulemusena langeb udu seest välja kaste, suitsust ladestub tahm, koor settib piima sisse. Vee ja taimeõli segu eraldamine setitamisega |
Liiva ja lauasoola segu vees | Filtreerimine Mis on aluseks heterogeensete segude eraldamiseks, kasutades filtreerimine• Ainete erineva lahustuvuse kohta vees ja erineva suurusega osakeste kohta. Filtri pooridest läbivad ainult nendega proportsionaalsed ainete osakesed, suuremad osakesed aga jäävad filtrile. Nii saate eraldada lauasoola ja jõeliiva heterogeense segu. Filtritena saab kasutada erinevaid poorseid aineid: vatt, kivisüsi, põletatud savi, pressklaas jm. Filtreerimismeetod on kodumasinate, näiteks tolmuimejate, töö aluseks. Seda kasutavad kirurgid - marli sidemed; puurijad ja liftide töötajad - hingamisteede maskid. Ilfi ja Petrovi loomingu kangelasel Ostap Benderil õnnestus teelehtede filtreerimiseks mõeldud teesõela abil võtta Ellochka Ogrelt (“Kaksteist tooli”) üks toolidest. Tärklise ja vee segu eraldamine filtreerimise teel |
Rauapulbri ja väävli segu | Tegevus magneti või vee abil Rauapulbrit tõmbas magnet, väävlipulbrit aga mitte. Mittemärguv väävlipulber hõljus veepinnale, raske märguv rauapulber aga settis põhja. Väävli ja raua segu eraldamine magneti ja vee abil |
Soola lahus vees on homogeenne segu | Aurustumine või kristalliseerumine Vesi aurustub ja soolakristallid jäävad portselantopsi. Eltoni ja Baskunchaki järvede vee aurustamisel saadakse lauasool. See eraldamismeetod põhineb lahusti ja lahustunud aine keemispunktide erinevusel. Kui aine, näiteks suhkur, laguneb kuumutamisel, siis vesi ei aurustu täielikult - lahus aurustub ja seejärel sadestuvad küllastunud lahusest suhkrukristallid. Mõnikord on vaja eemaldada lisandid madalama keemistemperatuuriga lahustitest, näiteks veest soolast. Sel juhul tuleb aine aurud kokku koguda ja seejärel jahutamisel kondenseerida. Seda homogeense segu eraldamise meetodit nimetatakse destilleerimine või destilleerimine. Spetsiaalsetes seadmetes - destilleerijates saadakse destilleeritud vesi, mida kasutatakse farmakoloogia, laborite ja autode jahutussüsteemide vajadusteks. Kodus saate sellise destilleerija kujundada: Kui aga eraldada alkoholi ja vee segu, siis esimesena destilleeritakse ära (kogutakse vastuvõtukatseklaasi) keemistemperatuuriga 78 °C alkohol ja katseklaasi jääb vesi. Destilleerimist kasutatakse naftast bensiini, petrooleumi, gaasiõli saamiseks. Homogeensete segude eraldamine |
Spetsiaalne komponentide eraldamise meetod, mis põhineb nende erineval neeldumisel teatud aine poolt, on kromatograafia.
Vene botaanik eraldas kromatograafia abil esimesena klorofülli taimede rohelistest osadest. Tööstuses ja laborites kasutatakse kromatograafia filterpaberi asemel tärklist, kivisütt, lubjakivi ja alumiiniumoksiidi. Kas aineid on alati vaja sama puhastusastmega?
Erinevatel eesmärkidel on vaja erineva puhastusastmega aineid. Keeduvesi on piisavalt settinud, et eemaldada lisandid ja desinfitseerimiseks kasutatud kloor. Joogivesi tuleb esmalt keeta. Ja keemialaborites lahuste ja katsete valmistamiseks, meditsiinis on vaja destilleeritud vett, mis on võimalikult puhastatud selles lahustunud ainetest. Ülipuhtaid aineid, mille lisandite sisaldus ei ületa miljondik protsenti, kasutatakse elektroonikas, pooljuhtides, tuumatehnoloogias ja muudes täppistööstuses.
Segude koostise väljendamise meetodid.
· Komponendi massiosa segus- komponendi massi ja kogu segu massi suhe. Tavaliselt väljendatakse massiosa protsentides, kuid mitte tingimata.
ω ["omega"] = mkomponent / mm segu
· Komponendi mooliosa segus- komponendi moolide arvu (ainekoguse) suhe kõigi segus olevate ainete moolide koguarvusse. Näiteks kui segu sisaldab aineid A, B ja C, siis:
χ ["chi"] komponent A \u003d n komponent A / (n (A) + n (B) + n (C))
· Komponentide molaarsuhe. Mõnikord on segu ülesannetes näidatud selle komponentide molaarsuhe. Näiteks:
mittekomponent A: mittekomponent B = 2:3
· Komponendi mahuosa segus (ainult gaaside jaoks)- aine A mahu ja kogu gaasisegu kogumahu suhe.
φ ["phi"] = Vkomponent / Vsegu
Harjutusplokk.
Vaatleme kolme näidet probleemidest, millega metallide segud reageerivad vesinikkloriid hape:
Näide 1Kui 20 g kaaluv vase ja raua segu puutus kokku vesinikkloriidhappe liiaga, vabanes 5,6 liitrit gaasi (n.a.). Määrake metallide massiosad segus.
Esimeses näites ei reageeri vask vesinikkloriidhappega, see tähendab, et happe reageerimisel rauaga eraldub vesinik. Seega, teades vesiniku mahtu, saame kohe leida raua koguse ja massi. Ja vastavalt ainete massifraktsioonid segus.
Näide 1 lahendus.
n \u003d V / Vm \u003d 5,6 / 22,4 \u003d 0,25 mol.
2. Vastavalt reaktsioonivõrrandile:
3. Raua kogus on samuti 0,25 mol. Selle massi leiate:
mFe = 0,25 ± 56 = 14 g.
Vastus: 70% rauda, 30% vaske.
Näide 2Vesinikkloriidhappe liia mõjul alumiiniumi ja raua segule, mis kaalus 11 g, eraldus 8,96 liitrit gaasi (n.a.). Määrake metallide massiosad segus.
Teises näites on reaktsioon mõlemad metallist. Siin eraldub vesinik juba mõlemas reaktsioonis happest. Seetõttu ei saa siin otsearvutust kasutada. Sellistel juhtudel on mugav lahendada väga lihtsa võrrandisüsteemi abil, võttes x jaoks - ühe metalli moolide arvu ja y jaoks - teise aine koguse.
Näite 2 lahendus.
1. Leidke vesiniku kogus:
n \u003d V / Vm \u003d 8,96 / 22,4 \u003d 0,4 mol.
2. Olgu alumiiniumi kogus x mol ja raua kogus y mol. Seejärel saame väljendada eraldunud vesiniku kogust x ja y kaudu:
2HCl = FeCl2+ |
4. Teame vesiniku koguhulka: 0,4 mol. Tähendab,
1,5x + y = 0,4 (see on süsteemi esimene võrrand).
5. Metallide segu jaoks peate väljendama massid ainete koguste kaudu.
m = Mn
Nii et alumiiniumi mass
mAl = 27x,
raua mass
mFe = 56 aastat,
ja kogu segu mass
27x + 56y = 11 (see on süsteemi teine võrrand).
6. Seega on meil kahe võrrandi süsteem:
7. Selliseid süsteeme on palju mugavam lahendada lahutamise meetodil, korrutades esimese võrrandi 18-ga:
27x + 18a = 7,2
ja esimese võrrandi lahutamine teisest:
8. (56–18) a \u003d 11–7,2
y \u003d 3,8 / 38 \u003d 0,1 mol (Fe)
x = 0,2 mol (Al)
mFe = n M = 0,1 56 = 5,6 g
mAI = 0,2 ± 27 = 5,4 g
ωFe = mFe / mm segu = 5,6 / 11 = 0,50,91%),
vastavalt
ωAl = 100% - 50,91% = 49,09%
Vastus: 50,91% rauda, 49,09% alumiiniumi.
Näide 316 g tsingi, alumiiniumi ja vase segu töödeldi vesinikkloriidhappe lahusega. Sel juhul eraldus 5,6 liitrit gaasi (n.a.) ja 5 g ainet ei lahustunud. Määrake metallide massiosad segus.
Kolmandas näites reageerivad kaks metalli, kuid kolmas metall (vask) ei reageeri. Seetõttu on ülejäänud 5 g vase mass. Ülejäänud kahe metalli - tsingi ja alumiiniumi (pange tähele, et nende kogumass on 16 - 5 = 11 g) kogused saab leida võrrandisüsteemi abil, nagu näites nr 2.
Vastus näitele 3: 56,25% tsinki, 12,5% alumiiniumi, 31,25% vaske.
Näide 4Raua, alumiiniumi ja vase segu töödeldi külma kontsentreeritud väävelhappe liiaga. Samal ajal lahustus osa segust ja eraldus 5,6 liitrit gaasi (n.a.). Ülejäänud segu töödeldi naatriumhüdroksiidi lahusega. Gaasi eraldus 3,36 liitrit ja järele jäi 3 g lahustumata jääki. Määrake metallide esialgse segu mass ja koostis.
Selles näites pidage meeles seda külm kontsentreeritud väävelhape ei reageeri raua ja alumiiniumiga (passivatsioon), kuid reageerib vasega. Sel juhul eraldub vääveloksiid (IV).
Leelisega reageerib ainult alumiinium- amfoteerne metall (leelises lahustuvad lisaks alumiiniumile ka tsink ja tina ning kuumas kontsentreeritud leelises saab veel lahustuda berüllium).
Näite 4 lahendus.
1. Kontsentreeritud väävelhappega reageerib ainult vask, gaasimoolide arv:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
2H2SO4 (konts.) = CuSO4+ |
2. (ärge unustage, et sellised reaktsioonid tuleb võrdsustada elektroonilise kaaluga)
3. Kuna vase ja vääveldioksiidi molaarsuhe on 1:1, siis on ka vask 0,25 mol. Vase massi leiate:
mCu \u003d n M \u003d 0,25 64 \u003d 16 g.
4. Alumiinium reageerib leeliselahusega ning moodustub alumiiniumhüdroksokompleks ja vesinik:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Vesiniku moolide arv:
nH2 = 3,36 / 22,4 = 0,15 mol,
alumiiniumi ja vesiniku molaarsuhe on 2:3 ja seetõttu
nAl = 0,15 / 1,5 = 0,1 mol.
Alumiiniumi kaal:
mAl \u003d n M \u003d 0,1 27 \u003d 2,7 g
6. Ülejäänud osa on raud, mis kaalub 3 g. Segu massi leiate:
mmix \u003d 16 + 2,7 + 3 = 21,7 g.
7. Metallide massifraktsioonid:
ωCu = mCu / mm segu = 16 / 21,7 = 0,7,73%)
ωAl = 2,7 / 21,7 = 0,1,44%)
ωFe = 13,83%
Vastus: 73,73% vask, 12,44% alumiinium, 13,83% raud.
Näide 521,1 g tsingi ja alumiiniumi segu lahustati 565 ml lämmastikhappe lahuses, mis sisaldas 20 massiprotsenti. % HNO3 ja mille tihedus on 1,115 g/ml. Vabanenud gaasi, mis on lihtaine ja lämmastikhappe redutseerimise ainus saadus, maht oli 2,912 l (n.a.). Määrake saadud lahuse koostis massiprotsentides. (RCTU)
Selle ülesande tekst näitab selgelt lämmastiku redutseerimise produkti - "lihtne aine". Kuna lämmastikhape ei tooda metallidega vesinikku, on see lämmastik. Mõlemad metallid on happes lahustunud.
Probleem ei küsi mitte metallide algsegu koostist, vaid reaktsioonide järel saadud lahuse koostist. See muudab ülesande keerulisemaks.
Näite 5 lahendus.
1. Määrake gaasilise aine kogus:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
2. Määrake lämmastikhappe lahuse mass, lahustunud HNO3 aine mass ja kogus:
mlahus \u003d ρ V \u003d 1,115 565 \u003d 630,3 g
mHNO3 = ω mlahus = 0,2 630,3 = 126,06 g
nHNO3 = m/M = 126,06/63 = 2 mol
Pange tähele, et kuna metallid on täielikult lahustunud, tähendab see - just piisavalt hapet(need metallid ei reageeri veega). Sellest lähtuvalt on vaja kontrollida Kas hapet on liiga palju? ja kui palju sellest jääb pärast reaktsiooni saadud lahusesse.
3. Koostage reaktsioonivõrrandid ( ärge unustage elektroonilist tasakaalu) ja arvutuste hõlbustamiseks võtame 5x - tsingi koguse ja 10 aasta jaoks - alumiiniumi koguse. Seejärel on vastavalt võrrandite koefitsientidele lämmastik esimeses reaktsioonis x mol ja teises - 3y mol:
12HNO3 = 5Zn(NO3)2+ |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3+ |
Al0 − 3e = Al3+ | ||
5. Seejärel, arvestades, et metallide segu mass on 21,1 g, nende molaarmassid on tsingi puhul 65 g/mol ja alumiiniumi puhul 27 g/mol, saame järgmise võrrandisüsteemi:
6. Seda süsteemi on mugav lahendada, korrutades esimese võrrandi 90-ga ja lahutades esimese võrrandi teisest.
7. x \u003d 0,04, mis tähendab nZn \u003d 0,04 5 \u003d 0,2 mol
y = 0,03, mis tähendab, et nAl \u003d 0,03 10 \u003d 0,3 mol
8. Kontrollige segu massi:
0,2 65 + 0,3 27 \u003d 21,1 g.
9. Liigume nüüd lahuse koostise juurde. Mugav on reaktsioonid uuesti ümber kirjutada ja reaktsioonide peale kirjutada kõigi reageerinud ja moodustunud ainete kogused (v.a vesi):
10. Järgmine küsimus on: kas lämmastikhapet jäi lahusesse ja kui palju on alles?
Vastavalt reaktsioonivõrranditele reageerinud happe kogus:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
st hapet oli liiga palju ja saate arvutada selle jäägi lahuses:
nHNO3res. \u003d 2 - 1,56 \u003d 0,44 mol.
11. Niisiis, sisse lõplik lahendus sisaldab:
tsinknitraat koguses 0,2 mol:
mZn(NO3)2 = n M = 0,2 189 = 37,8 g
alumiiniumnitraat koguses 0,3 mol:
mAl(NO3)3 = n M = 0,3 213 = 63,9 g
lämmastikhappe liig koguses 0,44 mol:
mHNO3res. = n M = 0,44 63 = 27,72 g
12. Kui suur on lõpplahuse mass?
Tuletame meelde, et lõpplahuse mass koosneb nendest komponentidest, mille me segasime (lahused ja ained), millest on lahutatud need reaktsioonisaadused, mis lahusest lahkusid (sademed ja gaasid):
13.
Siis meie ülesandeks:
14. uus lahus \u003d happelahuse mass + metallisulami mass - lämmastiku mass
mN2 = n M = 28 (0,03 + 0,09) = 3,36 g
uus lahus = 630,3 + 21,1 - 3,36 \u003d 648,04 g
ωZn(NO3)2 \u003d mv-va / mr-ra \u003d 37,8 / 648,04 \u003d 0,0583
ωAl(NO3)3 \u003d mv-va / mr-ra \u003d 63,9 / 648,04 \u003d 0,0986
ωHNO3res. \u003d mv-va / mr-ra \u003d 27,72 / 648,04 \u003d 0,0428
Vastus: 5,83% tsinknitraati, 9,86% alumiiniumnitraati, 4,28% lämmastikhapet.
Näide 617,4 g vase, raua ja alumiiniumi segu töötlemisel kontsentreeritud lämmastikhappe liiaga eraldus 4,48 liitrit gaasi (n.a.) ja sama massi vesinikkloriidhappe liiaga kokkupuutel 8,96 l gaasi. (n.a.). u.). Määrake esialgse segu koostis. (RCTU)
Selle probleemi lahendamisel tuleb esiteks meeles pidada, et kontsentreeritud lämmastikhape koos mitteaktiivse metalliga (vasega) annab NO2, samas kui raud ja alumiinium sellega ei reageeri. Vesinikkloriidhape seevastu vasega ei reageeri.
Vastus näiteks 6: 36,8% vask, 32,2% raud, 31% alumiinium.
Ülesanded iseseisvaks lahendamiseks.
1. Lihtsad probleemid kahe segukomponendiga.
1-1. 20 g kaaluvat vase ja alumiiniumi segu töödeldi 96% lämmastikhappe lahusega ja eraldus 8,96 liitrit gaasi (n.a.). Määrake alumiiniumi massiosa segus.
1-2. 10 g kaaluvat vase ja tsingi segu töödeldi kontsentreeritud leeliselahusega. Antud juhul lasti välja 2,24 liitrit gaasi (n. y.). Arvutage tsingi massiosa algsegus.
1-3. Magneesiumi ja magneesiumoksiidi segu massiga 6,4 g töödeldi piisava koguse lahjendatud väävelhappega. Samal ajal paiskus välja 2,24 liitrit gaasi (n.a). Leidke magneesiumi massiosa segus.
1-4. Tsingi ja tsinkoksiidi segu massiga 3,08 g lahustati lahjendatud väävelhappes. Saadi tsinksulfaat massiga 6,44 g Arvutage tsingi massiosa algsegus.
1-5. 9,3 g kaaluva raua ja tsingi pulbrite segu toimel vask(II)kloriidi liia lahusega tekkis 9,6 g vaske. Määrake esialgse segu koostis.
1-6. Millise massi 20% vesinikkloriidhappe lahust on vaja 20 g tsingi ja tsinkoksiidi segu täielikuks lahustamiseks, kui vesinikku eraldub sel juhul 4,48 liitri (n.a.) mahuga?
1-7. Lahjendatuna lahjendatud lämmastikhappes eraldub 3,04 g raua ja vase segust lämmastikoksiid (II) mahuga 0,896 l (n.a.). Määrake esialgse segu koostis.
1-8. 1,11 g raua- ja alumiiniumviilude segu lahustamisel 16% vesinikkloriidhappe lahuses (ρ = 1,09 g / ml) vabanes 0,672 liitrit vesinikku (n.a.). Leidke segus metallide massiosad ja määrake tarbitud vesinikkloriidhappe maht.
2. Ülesanded on keerulisemad.
2-1. Kaltsiumi ja alumiiniumi segu kaaluga 18,8 g kaltsineeriti ilma õhu juurdepääsuta liigse grafiidipulbriga. Reaktsiooniprodukti töödeldi lahjendatud vesinikkloriidhappega ja eraldus 11,2 liitrit gaasi (n.a.). Määrake metallide massiosad segus.
2-2. 1,26 g magneesiumisulami ja alumiiniumi lahustamiseks kasutati 35 ml 19,6% väävelhappe lahust (ρ = 1,1 g/ml). Happe liig reageeris 28,6 ml 1,4 mol/l kaaliumvesinikkarbonaadi lahusega. Määrake metallide massiosad sulamis ja sulami lahustumisel eralduva gaasi maht (n.a.).
Kui dispergeeritud osakesed eralduvad söötmest aeglaselt või on vaja eelselgitada ebahomogeenset süsteemi, kasutatakse selliseid meetodeid nagu flokulatsioon, flotatsioon, klassifitseerimine, koagulatsioon jne.
Koagulatsioon on osakeste kokkukleepumise protsess kolloidsüsteemides (emulsioonid või suspensioonid) koos agregaatide moodustumisega. Kleepumine tekib osakeste kokkupõrke tõttu Browni liikumise ajal. Koagulatsioon viitab spontaansele protsessile, mis kipub liikuma olekusse, millel on madalam vaba energia. Hüübimislävi on süstitava aine minimaalne kontsentratsioon, mis põhjustab hüübimist. Kunstlikku koagulatsiooni saab kiirendada nii spetsiaalsete ainete - koagulaatorite lisamisega kolloidsüsteemi, kui ka süsteemile elektrivälja rakendamisega (elektrokoagulatsioon), mehaanilise toimega (vibratsioon, segamine) jne.
Koagulatsiooni käigus lisatakse eraldatavale heterogeensele segule sageli koaguleerivaid kemikaale, mis hävitavad solvateerunud kestad, vähendades samal ajal osakeste pinna lähedal asuva elektrilise kaksikkihi difusiooniosa. See hõlbustab osakeste aglomeratsiooni ja agregaatide moodustumist. Seega tänu hajutatud faasi suuremate fraktsioonide moodustumisele kiireneb osakeste settimine. Koagulantidena kasutatakse raua, alumiiniumi või muude mitmevalentsete metallide sooli.
Peptiseerimine on koagulatsiooni pöördprotsess, mis seisneb agregaatide lagunemises primaarseteks osakesteks. Peptiseerimine viiakse läbi peptiseerivate ainete lisamisega dispersioonikeskkonnale. See protsess aitab kaasa ainete lagunemisele primaarseteks osakesteks. Peptiseerivad ained võivad olla pindaktiivsed ained (pindaktiivsed ained) või elektrolüüdid, nagu humiinhapped või raudkloriid. Peptiseerimisprotsessi kasutatakse vedelate dispergeerimissüsteemide saamiseks pastadest või pulbritest.
Flokulatsioon on omakorda omamoodi koagulatsioon. Selles protsessis moodustavad gaasis või vedelas keskkonnas suspendeeritud väikesed osakesed helbeid, mida nimetatakse helvesteks. Flokulantidena kasutatakse lahustuvaid polümeere, näiteks polüelektrolüüte. Flokuleerivaid aineid saab kergesti eemaldada filtreerimise või settimisega. Flokulatsiooni kasutatakse vee puhastamiseks ja väärtuslike ainete eraldamiseks reoveest, samuti mineraalide töötlemiseks. Veepuhastuse puhul kasutatakse flokulande madalas kontsentratsioonis (0,1-5 mg/l).
Vedelate süsteemide agregaatide hävitamiseks kasutatakse lisandeid, mis tekitavad osakestel laenguid, mis takistavad nende lähenemist. Seda efekti saab saavutada ka söötme pH muutmisega. Seda meetodit nimetatakse deflokulatsiooniks.
Flotatsioon on tahkete hüdrofoobsete osakeste eraldamise protsess vedelast pidevast faasist, fikseerides need valikuliselt vedela ja gaasilise faasi vahelisel kokkupuutepinnal (vedeliku ja gaasi kokkupuutepinnal või vedelas faasis olevate mullide pinnal). tahked osakesed ja gaasisulgud eemaldatakse vedela faasi pinnalt. Seda protsessi ei kasutata mitte ainult hajutatud faasi osakeste eemaldamiseks, vaid ka erinevate osakeste eraldamiseks nende märguvuse erinevuse tõttu. Selle protsessi käigus fikseeritakse hüdrofoobsed osakesed liidesel ja eraldatakse hüdrofiilsetest osakestest, mis settivad põhja. Parimad flotatsioonitulemused saavutatakse siis, kui osakeste suurus on vahemikus 0,1–0,04 mm.
Flotatsiooni on mitut tüüpi: vaht, õli, kile jne. Kõige tavalisem on vahuflotatsioon. See protsess võimaldab reaktiividega töödeldud osakesed õhumullide abil vee pinnale viia. See võimaldab moodustada vahukihi, mille stabiilsust kontrollib vahutav aine.
Klassifikatsiooni kasutatakse muutuva ristlõikega seadmetes. Tema abiga on võimalik eraldada põhitootest teatud hulk väikseid osakesi, mis koosnevad suurtest osakestest. Klassifikatsioon toimub tsentrifugaaljõu mõju tõttu tsentrifuugide ja hüdrotsüklonite abil.
Suspensioonide eraldamine magnettöötlussüsteemide abil on väga paljutõotav meetod. Magnetväljas töödeldud vesi säilitab pikka aega muutunud omadused, näiteks väheneb märgamisvõime. See protsess võimaldab intensiivistada suspensioonide eraldamist.
KOOS segude eraldamise meetodid (nii heterogeensed kui ka homogeensed) põhinevad asjaolul, et segu moodustavad ained säilitavad oma individuaalsed omadused. Heterogeensed segud võivad koostise ja faasi oleku poolest erineda, näiteks: gaas + vedelik; tahke+vedelik; kaks segunematut vedelikku jne. Peamised segude eraldamise meetodid on näidatud alloleval diagrammil. Vaatleme iga meetodit eraldi.
Heterogeensete segude eraldamine
Sest heterogeensete segude eraldamine, mis on tahke-vedelik või tahkegaasi süsteemid, on kolm peamist viisi:
- filtreerimine,
- settimine (dekanteerimine,
- magnetiline eraldamine
FILTRERIMINE
meetod, mis põhineb ainete erineval lahustuvusel ja segu komponentide erineval osakeste suurusel. Filtreerimine eraldab tahke aine vedelikust või gaasist.
Vedelike filtreerimiseks võib kasutada filterpaberit, mis tavaliselt volditakse neljaks ja pistetakse klaaslehtrisse. Lehter asetatakse keeduklaasi, milles filtraat on filtrit läbinud vedelik.
Filterpaberi pooride suurus on selline, et see võimaldab veemolekulidel ja lahustunud aine molekulidel takistamatult läbi imbuda. Osakesed, mis on suuremad kui 0,01 mm, jäävad filtrile ja mitteläbivad seda, moodustades nii settekihi.
Pea meeles! Filtreerimise abil on võimatu eraldada ainete tõelisi lahuseid, see tähendab lahuseid, milles lahustus toimus molekulide või ioonide tasemel.
Lisaks filterpaberile kasutavad keemialaborid spetsiaalseid filtreid
erineva suurusega poorid.
Gaasisegude filtreerimine ei erine põhimõtteliselt vedelike filtreerimisest. Ainus erinevus on see, et gaaside filtreerimisel tahketest osakestest (SPM) kasutatakse gaasisegu läbi filtri surumiseks spetsiaalse konstruktsiooniga filtreid (paber, kivisüsi) ja pumpasid, näiteks õhu filtreerimine auto salongis või väljalaskekott. pliidi kohal.
Filtreerimist saab jagada:
- teravili ja vesi
- kriit ja vesi
- liiv ja vesi jne.
- tolm ja õhk (erineva disainiga tolmuimejad)
ASULEMINE
Meetod põhineb erineva massi (tihedusega) tahkete osakeste erinevatel settimiskiirustel vedelas või õhukeskkonnas. Meetodit kasutatakse kahe või enama tahke lahustumatu aine eraldamiseks vees (või muus lahustis). Lahustumatute ainete segu pannakse vette, segatakse põhjalikult. Mõne aja pärast settivad ained, mille tihedus on suurem kui ühik, anuma põhja ja ained, mille tihedus on väiksem kui ühik, ujuvad. Kui segus on mitu erineva raskusastmega ainet, siis alumisse kihti sadestuvad raskemad ja seejärel kergemad. Neid kihte saab ka eraldada. Varem eraldati sel viisil purustatud kulda sisaldavatest kivimitest kullaterad. Kulda kandev liiv asetati kaldrennile, millest läbi lasti veejuga. Veevool korjas üles ja kandis aherainet minema ning renni põhja settisid rasked kullaterad. Gaasisegude puhul on tegemist ka tahkete osakeste settimisega kõvadele pindadele, näiteks tolmu settimine mööblile või taimelehtedele.
Selle meetodiga saab eraldada ka segunematuid vedelikke. Selleks kasutage eralduslehtrit.
Näiteks bensiini ja vee eraldamiseks asetatakse segu eralduslehtrisse, oodates hetke, kuni ilmub selge faasipiir. Seejärel avage kraan õrnalt ja vesi voolab klaasi.
Segusid saab eraldada setitamisega:
- jõeliiv ja savi
- raske kristalne sade lahusest
- õli ja vesi
- taimeõli ja vesi jne.
MAGNETILINE ERALDAMINE
Meetod põhineb segu tahkete komponentide erinevatel magnetilistel omadustel. Seda meetodit kasutatakse segus ferromagnetiliste ainete, st magnetiliste omadustega ainete, näiteks raua, juuresolekul.
Kõik ained võib magnetvälja suhtes tinglikult jagada kolme suurde rühma:
- feromagnetilised: tõmbab magnetiga - Fe, Co, Ni, Gd, Dy
- paramagnetid: nõrgalt tõmmatud-Al, Cr, Ti, V, W, Mo
- diamagnetid: tõrjub magnet - Cu, Ag, Au, Bi, Sn, messing
Magneteraldus võib eraldada b:
- väävli ja raua pulber
- tahm ja raud jne.
Homogeensete segude eraldamine
Sest vedelate homogeensete segude eraldamine (tõelised lahused) kasutage järgmisi meetodeid:
- aurustamine (kristallisatsioon),
- destilleerimine (destilleerimine),
- kromatograafia.
AURUSTAMINE. KRISTALLISEMINE.
Meetod põhineb lahusti ja lahustunud aine erinevatel keemistemperatuuridel. Kasutatakse lahustuvate tahkete ainete eraldamiseks lahustest. Aurutamine toimub tavaliselt järgmiselt: lahus valatakse portselanist tassi ja kuumutatakse lahust pidevalt segades. Vesi aurustub järk-järgult ja tassi põhja jääb tahke aine.
MÄÄRATLUS
Kristallisatsioon- aine faasiüleminek gaasilisest (aurulisest), vedelast või tahkest amorfsest olekust kristallisse olekusse.
Sel juhul saab aurustunud aine (vee või lahusti) koguda kondensatsiooni teel külmemale pinnale. Näiteks kui asetate aurustusnõu kohale külma klaasslaidi, tekivad selle pinnale veepiisad. Destilleerimismeetod põhineb samal põhimõttel.
DESTILLERIMINE. DESTILLERIMINE.
Kui aine, näiteks suhkur, laguneb kuumutamisel, siis vesi ei aurustu täielikult - lahus aurustub ja seejärel sadestuvad küllastunud lahusest suhkrukristallid. Mõnikord on vaja lahustid puhastada lisanditest, näiteks vesi soolast. Sel juhul tuleks lahusti aurustada, seejärel koguda selle aurud kokku ja jahutamisel kondenseerida. Seda homogeense segu eraldamise meetodit nimetatakse destilleerimine, või destilleerimine.
Looduses vett puhtal kujul (ilma sooladeta) ei esine. Ookeani-, mere-, jõe-, kaevu- ja allikavesi on vees leiduvate soolalahuste sordid. Tihti vajavad inimesed aga puhast vett, mis ei sisalda soolasid (kasutatakse automootorites; keemiatootmises erinevate lahuste ja ainete saamiseks; fotode valmistamisel). Seda vett nimetatakse destilleeritud seda kasutatakse laboris keemilisteks katseteks.
Destillatsiooni saab jagada:
- vesi ja alkohol
- õli (erinevate fraktsioonide jaoks)
- atsetoon ja vesi jne.
KROMATOGRAAFIA
Ainete segude eraldamise ja analüüsi meetod. Põhineb uuritava aine erineval jaotuskiirusel kahe faasi – statsionaarse ja liikuva – vahel (eluent). Statsionaarne faas on reeglina arenenud pinnaga sorbent (peen pulber, näiteks alumiiniumoksiid või tsinkoksiid või filterpaber) ja liikuv faas on gaasi- või vedelikuvool. Mobiilse faasi vool filtreeritakse läbi sorbendikihi või liigub mööda sorbendikihti, näiteks filterpaberi pinnal.
Saate ise kromatogrammi teha ja meetodi olemust praktikas näha. On vaja segada mitu tinti ja kanda saadud segu tilk filterpaberile. Seejärel, täpselt värvilise koha keskel, hakkame tilkhaaval valama puhast vett. Iga tilk tuleb peale kanda alles siis, kui eelmine on imendunud. Vesi mängib eluendi rolli, mis kannab uuritavat ainet mööda sorbenti – poorset paberit. Segu moodustavaid aineid säilitab paber erineval viisil: osad säilivad selles hästi, teised aga imenduvad aeglasemalt ja levivad koos veega mõnda aega edasi. Varsti hakkab üle paberilehe levima tõeline värviline kromatogramm: sama värvi laik keskel, mida ümbritsevad mitmevärvilised kontsentrilised rõngad.
Orgaanilises analüüsis on eriti laialt levinud õhukese kihi kromatograafia. Õhukesekihikromatograafia eeliseks on see, et on võimalik kasutada kõige lihtsamat ja tundlikumat tuvastamismeetodit – visuaalset kontrolli. Silmale nähtamatud laigud saab tekitada erinevate reaktiivide, aga ka ultraviolettvalguse või autoradiograafia abil.
Orgaaniliste ja anorgaaniliste ainete analüüsimisel kasutatakse paberkromatograafiat. Keeruliste ioonide segude, näiteks haruldaste muldmetallide elementide, uraani lõhustumisproduktide, plaatinarühma elementide eraldamiseks on välja töötatud arvukalt meetodeid.
TÖÖSTUSES KASUTATAVAD SEGU ERALDAMISE MEETODID.
Tööstuses kasutatavad segude eraldamise meetodid erinevad vähe ülalkirjeldatud laborimeetoditest.
Õli eraldamiseks kasutatakse kõige sagedamini rektifikatsiooni (destilleerimist). Seda protsessi kirjeldatakse üksikasjalikumalt teemas. "Nafta rafineerimine".
Tööstuses levinumad ainete puhastamise ja eraldamise meetodid on settimine, filtreerimine, sorptsioon ja ekstraheerimine. Filtreerimis- ja settimismeetodid viiakse läbi sarnaselt laborimeetodile, selle erinevusega, et kasutatakse settimismahuteid ja suuremahulisi filtreid. Kõige sagedamini kasutatakse neid meetodeid reovee puhastamiseks. Seetõttu vaatame meetodeid lähemalt kaevandamine Ja sorptsioon.
Mõistet "ekstraheerimine" saab kasutada erinevate faaside tasakaalu kohta (vedelik-vedelik, gaas-vedelik, vedelik-tahke jne), kuid sagedamini kasutatakse seda vedelik-vedelik süsteemide puhul, seega võib sageli leida järgmise määratluse:
MÄÄRATLUS
Ekstraheerimine i - ainete eraldamise, puhastamise ja eraldamise meetod, mis põhineb aine jaotusprotsessil kahe segunematu lahusti vahel.
Üks segunematutest lahustitest on tavaliselt vesi, teine on orgaaniline lahusti, kuid see pole vajalik. Ekstraheerimismeetod on mitmekülgne, see sobib peaaegu kõigi elementide eraldamiseks erinevates kontsentratsioonides. Ekstraheerimine võimaldab eraldada keerukaid mitmekomponentseid segusid sageli tõhusamalt ja kiiremini kui muud meetodid. Ekstraheerimise eraldamise või eraldamise teostamine ei nõua keerulisi ja kalleid seadmeid. Protsessi saab automatiseerida, vajadusel saab seda kaugjuhtida.
MÄÄRATLUS
Sorptsioon- meetod ainete eraldamiseks ja puhastamiseks, mis põhineb mitmesuguste ainete (sorbaatide) gaasi- või vedelsegudest neeldumisel tahkes kehas (adsorptsioon) või vedelik-sorbendis (absorptsioon).
Kõige sagedamini kasutatakse tööstuses absorptsioonimeetodeid gaasi-õhu heitmete puhastamiseks tolmuosakestest või suitsust, samuti mürgistest gaasilistest ainetest. Gaasiliste ainete absorptsiooni korral võib sorbendi ja lahustunud aine vahel tekkida keemiline reaktsioon. Näiteks gaasilise ammoniaagi neelamiselNH3lämmastikhappe HNO 3 lahus moodustab ammooniumnitraadi NH 4 NO 3(ammooniumnitraat), mida saab kasutada ülitõhusa lämmastikväetisena.
Segude eraldamise meetodid
Enamik meie planeedil leiduvaid aineid ei ole puhtal kujul, vaid ühendites ja segudes koos teiste ainetega.
Niisiis, graniidi koostis sisaldab kolme palja silmaga nähtavat ainet.
Kuid piim tundub meile homogeenne, kuni see muutub hapuks. Hapu
piim eraldub läbipaistvaks vadakuks ja valgeks tahkeks sademeks – valguks
kaseiin. Mees ammu kasutab neid aineid , sisalduvad piimas, tuues need esile
segust. Kohupiim valmistatakse lahustumatust valgust - kaseiinist ja lahustuv
vadakuvalke kasutatakse kliinilises toitumises.
Kuidas saab segusid eraldada?
1. Kui aine on vees lahustumatu, näiteks teraviljad (riis, tatar, manna jne), jõeliiv, kriit, savi, siis võite kasutada filtreerimismeetodit.
Filtreerimine -vedelike (gaaside) filtreerimine läbi filtri, et puhastada need tahketest lisanditest.

1. Filtri paigaldamine. Asetame selle lehtrisse, niisutades seda veidi veega.
2. Sisestage lehter koos filtriga kolbi.
3. Laske lahustumata aine ja vee segu läbi filtri.
Järeldus. Filtreerimisega puhastatud vesi läbis filtri vabalt; vees lahustumatu aine jääb filtrile.
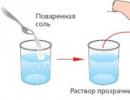
2. Kui tahke aine on vees lahustuv (sool, suhkur, sidrunhape), siis eraldadasegude puhul võib kasutada aurustamismeetodit.
Aurustumine- vedelikus lahustunud tahkete ainete eraldamine, muutes selle auruks.
Veeklaasis sool ei kadunud, kuigi muutus nähtamatuks – lahus on läbipaistev. Aurutamine võimaldas eraldada vees lahustunud ainet ainete segust (vesi ja sool). Klaasil on näha soolakristalle. See kinnitab järeldust, et et segu iga aine (nii vesi kui sool) säilitaks oma omadused.
Järeldus. Lahustuvaid aineid saab lahusest eraldada.
3 .Üksteises lahustuvate vedelike eraldamiseks ja puhta (ilma lisanditeta) vee saamiseks kasutatakse destilleerimismeetodit
(või destilleerimine)
destilleerimine -destilleerimine, vedelsegudes sisalduvate ainete eraldamine keemistemperatuuride järgi, millele järgneb auru jahutamine.
Looduses vett puhtal kujul (ilma sooladeta) ei esine. Ookeani-, mere-, jõe-, kaevu- ja allikavesi on vees leiduvate soolalahuste sordid. Tihti vajavad inimesed aga puhast vett, mis ei sisalda soolasid (kasutatakse automootorites; keemiatootmises erinevate lahuste ja ainete saamiseks; fotode valmistamisel). Sellist vett nimetatakse destilleeritud ja selle saamise meetodit nimetatakse destilleerimiseks.

Kraanivett soojendame alkoholilambi leegi kohal katseklaasis, mis on suletud gaasi väljalasketoruga korgiga. Katseklaasi otsa langetame puhtasse kuiva katseklaasi, mis asetatakse jääga klaasi. Katseklaasi põhja ja seintele ilmuvad jääga klaasis destilleeritud (sooladest ja lisanditest puhastatud) vee tilgad.
Harjutus
1. Vaadake tühja veekeetjasse, milles keedetakse vett. Kas vees lahustunud ainete seintel ja põhjas on valgeid ladestusi (katlakivi)?
2. Veekeetja kaanest, milles vett keedetakse, voolavad veepiisad. Milline vesi – kaanel või veekeetjas endas – sisaldab rohkem sooli? Selgitage oma vastust.
3. Mis on pildil kujutatud protsessi nimi?

4. Kui segu sisaldab rauda, siis saab selle isoleerimiseks kasutada magnetit, sest. rauda ja selle sulameid tõmbab magnet.
5. Kahe segunematu vedeliku (õli ja vesi, päevalilleõli ja vesi) eraldamiseks peate kasutama jaotuslehtrit.

Suurema tihedusega vedelik sulandub klaasiks ja jaotuslehtrisse jääb kergem vedelik.