Voolu rakendamine vedelikes. Elektrivool vedelikes: selle päritolu, kvantitatiivsed ja kvalitatiivsed omadused. elektrivool lahuses. elektrolüüdid
Kõik tunnevad elektrivoolu määratlust. Seda kujutatakse laetud osakeste suunatud liikumisena. Sellisel liikumisel erinevates keskkondades on põhimõttelised erinevused. Selle nähtuse põhinäitena võib ette kujutada elektrivoolu voolamist ja levikut vedelikes. Selliseid nähtusi iseloomustavad erinevad omadused ja need erinevad oluliselt laetud osakeste korrapärasest liikumisest, mis toimub tavatingimustes, mitte erinevate vedelike mõjul.
Joonis 1. Elektrivool vedelikes. Autor24 - üliõpilastööde veebivahetus
Elektrivoolu teke vedelikes
Hoolimata asjaolust, et elektrivoolu juhtivusprotsess toimub metallseadmete (juhtide) abil, sõltub voolutugevus vedelikes laetud ioonide liikumisest, mis on teatud põhjustel selliseid aatomeid ja molekule omandanud või kaotanud. Sellise liikumise indikaatoriks on teatud aine omaduste muutus, kust ioonid läbivad. Seega on vaja tugineda elektrivoolu põhidefinitsioonile, et kujundada konkreetne kontseptsioon voolu moodustumise kohta erinevates vedelikes. Tehtakse kindlaks, et negatiivselt laetud ioonide lagunemine aitab kaasa positiivsete väärtustega vooluallika piirkonna liikumisele. Positiivselt laetud ioonid liiguvad sellistes protsessides vastupidises suunas - negatiivsesse vooluallikasse.
Vedelikud juhid jagunevad kolme põhitüüpi:
- pooljuhid;
- dielektrikud;
- dirigendid.
Definitsioon 1
Elektrolüütiline dissotsiatsioon on teatud lahuse molekulide lagunemine negatiivse ja positiivse laenguga ioonideks.
Võib kindlaks teha, et vedelikes võib elektrivool tekkida pärast kasutatavate vedelike koostise ja keemiliste omaduste muutumist. See on täiesti vastuolus elektrivoolu muul viisil levimise teooriaga, kui kasutatakse tavalist metalljuhti.
Faraday katsed ja elektrolüüs
Elektrivoolu vool vedelikes on laetud ioonide liikumise tulemus. Vedelikes elektrivoolu tekkimise ja levimisega seotud probleemid viisid kuulsa teadlase Michael Faraday uuringuni. Arvukate praktiliste uuringute abil suutis ta leida tõendeid selle kohta, et elektrolüüsi käigus eralduva aine mass sõltub aja- ja elektrihulgast. Sel juhul on oluline aeg, mille jooksul katsed tehti.
Teadlasel õnnestus ka välja selgitada, et elektrolüüsi käigus on teatud koguse aine vabanemisel vaja sama palju elektrilaenguid. See suurus määrati täpselt kindlaks ja fikseeriti konstantses väärtuses, mida nimetati Faraday numbriks.
Vedelikes on elektrivoolul erinevad levimistingimused. See interakteerub veemolekulidega. Need takistavad oluliselt kogu ioonide liikumist, mida tavapärase metalljuhiga tehtud katsetes ei täheldatud. Sellest järeldub, et elektrolüütiliste reaktsioonide käigus tekkiv vool ei ole nii suur. Kuid kui lahuse temperatuur tõuseb, suureneb juhtivus järk-järgult. See tähendab, et elektrivoolu pinge suureneb. Ka elektrolüüsi käigus on täheldatud, et tõenäosus, et konkreetne molekul laguneb negatiivseteks või positiivseteks ioonilaenguteks, suureneb kasutatava aine või lahusti molekulide suure arvu tõttu. Kui lahus on küllastunud ioonidega, mis ületavad teatud normi, toimub vastupidine protsess. Lahuse juhtivus hakkab taas vähenema.
Praegu on elektrolüüsiprotsess leidnud rakendust paljudes teadusvaldkondades ja tootmises. Tööstusettevõtted kasutavad seda metalli tootmisel või töötlemisel. Elektrokeemilised reaktsioonid on seotud:
- soola elektrolüüs;
- galvaniseerimine;
- pinna poleerimine;
- muud redoksprotsessid.
Elektrivool vaakumis ja vedelikes
Elektrivoolu levimine vedelikes ja muudes keskkondades on üsna keeruline protsess, millel on oma omadused, omadused ja omadused. Fakt on see, et sellistes meediumites pole kehades laenguid, seetõttu nimetatakse neid tavaliselt dielektrikuteks. Uurimistöö põhieesmärk oli luua tingimused, mille korral aatomid ja molekulid saaksid liikuda ning alata elektrivoolu tekitamise protsess. Selleks on tavaks kasutada spetsiaalseid mehhanisme või seadmeid. Selliste moodulseadmete põhielemendiks on metallplaatide kujul olevad juhid.
Voolu põhiparameetrite määramiseks on vaja kasutada tuntud teooriaid ja valemeid. Kõige tavalisem on Ohmi seadus. See toimib universaalse amprikarakteristikuna, kus rakendatakse voolu-pinge sõltuvuse põhimõtet. Tuletage meelde, et pinget mõõdetakse ühikutes amprites.
Vee ja soolaga katsetamiseks on vaja soolase veega anum ette valmistada. See annab praktilise ja visuaalse ülevaate protsessidest, mis toimuvad vedelikes elektrivoolu tekitamisel. Samuti peaks paigaldus sisaldama ristkülikukujulisi elektroode ja toiteallikaid. Täielikuks katseteks ettevalmistamiseks peab teil olema ampri paigaldus. See aitab juhtida energiat toiteallikast elektroodidele.
Metallplaadid toimivad juhtidena. Need kastetakse kasutatud vedeliku sisse ja seejärel ühendatakse pinge. Osakeste liikumine algab kohe. See töötab juhuslikult. Kui juhtide vahele tekib magnetväli, on kogu osakeste liikumise protsess järjestatud.
Ioonid hakkavad laenguid muutma ja ühinema. Seega muutuvad katoodid anoodideks ja anoodid katoodideks. Selle protsessi käigus tuleb arvestada ka mitmete muude oluliste teguritega:
- dissotsiatsiooni tase;
- temperatuur;
- elektritakistus;
- vahelduv- või alalisvoolu kasutamine.
Katse lõpus moodustub plaatidele soolakiht.
Vedelikud, mis on juhid, hõlmavad sulameid ja elektrolüütide lahuseid, st. soolad, happed ja leelised.
Kui elektrolüüdid lahustuvad vees, lagunevad nende molekulid ioonideks – elektrolüütiline dissotsiatsioon. Dissotsiatsiooniaste, s.o. ioonideks lagunenud molekulide osa lahustunud aines sõltub temperatuurist, lahuse kontsentratsioonist ja lahusti elektrilistest omadustest. Temperatuuri tõustes suureneb dissotsiatsiooniaste ja sellest tulenevalt suureneb positiivselt ja negatiivselt laetud ioonide kontsentratsioon. Erineva märgiga ioonid võivad kohtumisel taas ühineda neutraalseteks molekulideks. Seda protsessi nimetatakse rekombinatsiooniks. Konstantsetes tingimustes tekib lahuses dünaamiline tasakaal, mille juures ioonideks lagunevate molekulide arv sekundis on võrdne ioonipaaride arvuga, mis rekombineeruvad sama aja jooksul neutraalseteks molekulideks.
Seega on juhtivates vedelikes vabad laengukandjad positiivsed ja negatiivsed ioonid. Kui vooluallikaga ühendatud elektroodid asetatakse vedelikku, hakkavad need ioonid liikuma. Üks elektroodidest on ühendatud vooluallika negatiivse poolusega - seda nimetatakse katoodiks - teine on ühendatud positiivse - anoodiga. Vooluallikaga ühendamisel hakkavad elektrolüüdi lahuses olevad ioonid, negatiivsed ioonid liikuma positiivse elektroodi (anood) ja positiivsed ioonid vastavalt negatiivse (katoodi) suunas. See tähendab, et luuakse elektrivool. Sellist juhtivust vedelikes nimetatakse ioonseks, kuna ioonid on laengukandjad.
Kui vool läbib elektroodidel olevat elektrolüüdilahust, vabaneb redoksreaktsioonidega seotud aine. Anoodil loovutavad negatiivselt laetud ioonid oma lisaelektrone (oksüdatiivne reaktsioon) ja katoodil võtavad positiivsed ioonid vastu puuduvad elektronid (redutseerimisreaktsioon). Seda protsessi nimetatakse elektrolüüsiks.
Elektrolüüsi käigus eraldub elektroodidel aine. Vabanenud aine m massi sõltuvuse voolu tugevusest, voolu läbimise ajast ja ainest endast tegi kindlaks M. Faraday. Seda seadust saab teoreetiliselt saada. Seega on eraldunud aine mass võrdne ühe iooni m i massi korrutisega ioonide arvuga N i, mis jõudsid elektroodile aja jooksul Dt. Iooni mass vastavalt aine koguse valemile on võrdne m i \u003d M / N a, kus M on aine molaarmass, N a on Avogadro konstant. Elektroodini jõudnud ioonide arv on N i =Dq/qi, kus Dq on laeng, mis läbis elektrolüüdi aja jooksul Dt (Dq=I*Dt), qi on iooni laeng, mis määratakse aatomi valentsi järgi (qi = n*e, kus n on aatomi valents, e on elementaarlaeng). Asendades need valemid, saame, et m=M/(neN a)*IDt. Kui tähistame k (proportsionaalsustegur) =M/(neN a), siis saame m=kIDt. See on Faraday esimese seaduse, ühe elektrolüüsi seaduse matemaatiline tähistus. Elektrivoolu läbimise ajal Dt elektroodile vabaneva aine mass on võrdeline voolu tugevusega ja selle ajaintervalliga. K väärtust nimetatakse antud aine elektrokeemiliseks ekvivalendiks, mis on arvuliselt võrdne aine massiga, mis vabaneb elektroodidele 1 C laengu ülekandmisel ioonide poolt. [k] = 1 kg/C. k = M/(neN a) = 1/F*M/n , kus F on Faraday konstant. F \u003d en a = 9,65 * 10 4 C / mol. Tuletatud valem k=(1/F)*(M/n) on Faraday teine seadus.
Elektrolüüsi kasutatakse laialdaselt inseneritöös erinevatel eesmärkidel, näiteks kaetakse ühe metalli pind õhukese kihiga teise metalliga (nikeldamine, kroomimine, vasendamine jne). Kui on tagatud elektrolüütilise katte hea koorumine pinnalt, on võimalik saada pinna topograafia koopia. Seda protsessi nimetatakse galvaniseerimiseks. Samuti puhastatakse elektrolüüsi abil metallid lisanditest, näiteks asetatakse anoodina vanni maagist saadud paksud rafineerimata vase lehed. Elektrolüüsi käigus vask lahustub, lisandid langevad põhja ja puhas vask settib katoodile. Elektrolüüsi abil saadakse ka elektroonilised trükkplaadid. Dielektrikule liimitakse õhuke kompleksne ühendusjuhtmete muster, seejärel asetatakse plaat elektrolüüti, kus vasekihi katmata alad söövitatakse. Pärast seda pestakse värv maha ja tahvlile ilmuvad mikroskeemi detailid.
Vedelikud, nagu tahked ained, võivad olla juhid, pooljuhid ja dielektrikud. Selles õppetükis keskendume vedelatele juhtidele. Ja mitte elektroonilise juhtivusega vedelike (sulametallid), vaid teist tüüpi vedelate juhtide kohta (soolade, hapete, aluste lahused ja sulamid). Selliste juhtide juhtivuse tüüp on ioonne.
Definitsioon. Teist tüüpi juhid on need juhid, milles voolu voolamisel toimuvad keemilised protsessid.
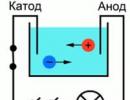
Vedelikes voolujuhtimise protsessi paremaks mõistmiseks võib esitada järgmise katse: Kaks vooluallikaga ühendatud elektroodi asetati veevanni, vooluindikaatoriks võib ahelas võtta lambipirni. Kui sulgete sellise vooluringi, siis lamp ei põle, mis tähendab, et voolu pole, mis tähendab, et vooluringis on katkestus ja vesi ise ei juhi voolu. Aga kui paned vannituppa teatud koguse soola ja kordad vooluringi, süttib tuli. See tähendab, et katoodi ja anoodi vahelises vannis hakkasid liikuma vabad laengukandjad, antud juhul ioonid (joonis 1).

Riis. 1. Kogemuste skeem
Elektrolüütide juhtivus
Kust tulevad teisel juhul tasuta tasud? Nagu ühes eelmises õppetükis mainitud, on mõned dielektrikud polaarsed. Vees on täpselt samad polaarsed molekulid (joonis 2).

Riis. 2. Veemolekuli polaarsus
Soola lisamisel veele on veemolekulid orienteeritud nii, et nende negatiivsed poolused on naatriumi lähedal, positiivsed - kloori lähedal. Laengutevahelise interaktsiooni tulemusena lõhustavad veemolekulid soolamolekulid vastandlike ioonide paarideks. Naatriumiioonil on positiivne laeng, klooriioonil on negatiivne laeng (joonis 3). Just need ioonid liiguvad elektrivälja toimel elektroodide vahel.

Riis. 3. Vabade ioonide moodustumise skeem
Kui naatriumioonid lähenevad katoodile, võtab see vastu oma puuduvad elektronid, kloriidioonid aga loobuvad anoodile jõudes omadest.
Elektrolüüs
Kuna voolu vool vedelikes on seotud aine ülekandega, siis sellise vooluga toimub elektrolüüsi protsess.
Definitsioon. Elektrolüüs on redoksreaktsioonidega seotud protsess, mille käigus elektroodidel vabaneb aine.
Aineid, mis sellise lõhenemise tulemusena tagavad ioonjuhtivuse, nimetatakse elektrolüütideks. Selle nime pakkus välja inglise füüsik Michael Faraday (joonis 4).
Elektrolüüs võimaldab saada lahustest aineid piisavalt puhtal kujul, seetõttu kasutatakse seda haruldaste materjalide, näiteks naatriumi, kaltsiumi ... puhtal kujul saamiseks. Seda nimetatakse elektrolüütiliseks metallurgiaks.
Faraday seadused
Esimeses elektrolüüsi töös 1833. aastal esitas Faraday oma kaks elektrolüüsi seadust. Esimeses oli tegemist elektroodidele vabanenud aine massiga:
Faraday esimene seadus ütleb, et see mass on võrdeline elektrolüüdi läbinud laenguga:
Siin mängib proportsionaalsuskoefitsiendi rolli kogus - elektrokeemiline ekvivalent. See on tabeliväärtus, mis on iga elektrolüüdi jaoks kordumatu ja on selle peamine omadus. Elektrokeemilise ekvivalendi mõõde:
![]()
Elektrokeemilise ekvivalendi füüsikaline tähendus on mass, mis vabaneb elektroodile, kui 1 C-s olev elektrienergia läbib elektrolüüdi.
Kui meenutada valemeid alalisvoolu teemast:
Seejärel saame Faraday esimest seadust esitada kujul:
Faraday teine seadus puudutab otseselt elektrokeemilise ekvivalendi mõõtmist konkreetse elektrolüüdi muude konstantide kaudu:
Siin: on elektrolüüdi molaarmass; - elementaarlaeng; - elektrolüütide valents; on Avogadro number.
Seda väärtust nimetatakse elektrolüüdi keemiliseks ekvivalendiks. See tähendab, et elektrokeemilise ekvivalendi teadasaamiseks piisab keemilise ekvivalendi teadmisest, ülejäänud valemi komponendid on maailmakonstandid.
Faraday teise seaduse alusel võib esimest seadust esitada järgmiselt:
![]()
Faraday pakkus välja nende ioonide terminoloogia selle elektroodi põhjal, kuhu nad liiguvad. Positiivseid ioone nimetatakse katioonideks, kuna need liiguvad negatiivselt laetud katoodi poole, negatiivseid laenguid nimetatakse anioonideks, kui nad liiguvad anoodi poole.
Ülaltoodud vee toimet molekuli kaheks iooniks purustamiseks nimetatakse elektrolüütiliseks dissotsiatsiooniks.
Lisaks lahustele võivad sulandid olla ka teist tüüpi juhid. Sel juhul saavutatakse vabade ioonide olemasolu sellega, et kõrgel temperatuuril algavad väga aktiivsed molekulaarsed liikumised ja vibratsioonid, mille tulemusena molekulid lagunevad ioonideks.
Elektrolüüsi praktiline rakendamine
Elektrolüüsi esimene praktiline rakendus leidis 1838. aastal vene teadlane Jacobi. Elektrolüüsi abil sai ta mulje Iisaku katedraali figuuridest. Seda elektrolüüsi rakendust nimetatakse galvaniseerimiseks. Teine kasutusvaldkond on galvaniseerimine – ühe metalli katmine teisega (kroomimine, nikeldamine, kullamine jne, joonis 5)
- Fatyf.narod.ru ().
- ChemiK ().
- Ens.tpu.ru ().
Kodutöö
- Mis on elektrolüüdid?
- Millised on kaks põhimõtteliselt erinevat tüüpi vedelikku, milles võib voolata elektrivool?
- Millised on võimalikud mehhanismid vabade laengukandjate tekkeks?
- *Miks on elektroodile vabanev mass võrdeline laenguga?
« Füüsika – 10. klass
Millised on elektrivoolu kandjad vaakumis?
Milline on nende liikumise olemus?
Vedelikud, nagu ka tahked ained, võivad olla dielektrikud, juhid ja pooljuhid. Dielektrikute hulka kuuluvad destilleeritud vesi, juhid - elektrolüütide lahused ja sulatused: happed, leelised ja soolad. Vedelad pooljuhid on sula seleen, sulfiidsulamid jne.
elektrolüütiline dissotsiatsioon.
Kui elektrolüüdid lahustuvad polaarsete veemolekulide elektrivälja mõjul, lagunevad elektrolüüdi molekulid ioonideks.
Molekulide lagunemist ioonideks polaarsete veemolekulide elektrivälja mõjul nimetatakse nn. elektrolüütiline dissotsiatsioon.
Dissotsiatsiooni aste– ioonideks lagunenud molekulide osakaal lahustunud aines.
Dissotsiatsiooniaste sõltub temperatuurist, lahuse kontsentratsioonist ja lahusti elektrilistest omadustest.
Temperatuuri tõustes suureneb dissotsiatsiooniaste ja sellest tulenevalt suureneb positiivselt ja negatiivselt laetud ioonide kontsentratsioon.
Erineva märgiga ioonid võivad kohtumisel taas ühineda neutraalseteks molekulideks.
Konstantsetes tingimustes tekib lahuses dünaamiline tasakaal, mille juures ioonideks lagunevate molekulide arv sekundis on võrdne ioonipaaride arvuga, mis rekombineeruvad sama aja jooksul neutraalseteks molekulideks.
Iooniline juhtivus.
Laengukandjad vesilahustes või elektrolüütide sulamites on positiivse ja negatiivse laenguga ioonid.
Kui elektrolüüdilahusega anum on kaasatud elektriahelasse, hakkavad negatiivsed ioonid liikuma positiivse elektroodi - anoodi suunas ja positiivsed - negatiivse katoodi suunas. Selle tulemusena liigub vooluringi kaudu elektrivool.
Vesilahuste ehk elektrolüütide sulamite juhtivust, mida teostavad ioonid, nimetatakse ioonjuhtivus.
Elektrolüüs. Ioonjuhtivuse korral on voolu läbimine seotud aine ülekandega. Elektroodidel eralduvad elektrolüüte moodustavad ained. Anoodil loovutavad negatiivsed ioonid oma lisaelektronid (keemias nimetatakse seda oksüdatiivseks reaktsiooniks) ja katoodil võtavad positiivsed ioonid vastu puuduvad elektronid (redutseerimisreaktsioon).
Vedelikel võib olla ka elektrooniline juhtivus. Selline juhtivus on näiteks vedelatel metallidel.
Aine vabanemise protsessi elektroodil, mis on seotud redoksreaktsioonidega, nimetatakse elektrolüüs.
Mis määrab teatud aja jooksul vabaneva aine massi? Ilmselt on eraldunud aine mass m võrdne ühe iooni massi m 0i korrutisega aja Δt elektroodi jõudnud ioonide arvuga N i:
m = m 0i N i. (16.3)
Ioonide mass m 0i on:
kus M on aine molaar- (või aatom-) mass ja N A on Avogadro konstant, st ioonide arv ühes moolis.
Elektroodi jõudvate ioonide arv on
kus Δq = IΔt on aja Δt jooksul elektrolüüdi läbinud laeng; q 0i on iooni laeng, mille määrab aatomi valents n: q 0i \u003d ne (e on elementaarlaeng). Molekulide dissotsiatsiooni käigus tekivad näiteks KBr, mis koosneb monovalentsetest aatomitest (n = 1), K + ja Br - ioonid. Vasksulfaadi molekulide dissotsiatsioon toob kaasa kahekordse laenguga Cu 2+ ja SO 2-4 ioonide (n = 2) ilmumise. Asendades avaldised (16.4) ja (16.5) valemis (16.3) ning võttes arvesse, et Δq = IΔt, a q 0i = ne, saame
Faraday seadus.
Tähistame k-ga aine massi m ja elektrolüüti läbiva laengu Δq = IΔt proportsionaalsuskoefitsienti:
kus F \u003d en A = 9,65 10 4 C / mol - Faraday konstant.
Koefitsient k sõltub aine olemusest (M ja n väärtused). Valemi (16.6) järgi on meil
m = kIΔt. (16,8)
Faraday elektrolüüsi seadus:
Aja jooksul Δt elektroodile vabanenud aine mass. elektrivoolu läbimise ajal on võrdeline voolu tugevuse ja ajaga.
Selle teoreetiliselt saadud väite kehtestas esmakordselt eksperimentaalselt Faraday.
Väärtust k valemis (16.8) kutsutakse elektrokeemiline ekvivalent antud aine ja väljendatud kilogrammi ripatsi kohta(kg/C).
Valemist (16.8) on näha, et koefitsient k on arvuliselt võrdne aine massiga, mis eraldub elektroodidele ioonide 1 C laengu ülekandmisel.

Elektrokeemilisel ekvivalendil on lihtne füüsikaline tähendus. Kuna M / N A \u003d m 0i ja en \u003d q 0i, siis vastavalt valemile (16.7) k \u003d rn 0i / q 0i, st k on iooni massi ja selle laengu suhe.
M ja Δq väärtusi mõõtes saab määrata erinevate ainete elektrokeemilisi ekvivalente.
Faraday seaduse kehtivust saate kontrollida kogemuste põhjal. Paneme kokku joonisel (16.25) näidatud paigalduse. Kõik kolm elektrolüütivanni on täidetud sama elektrolüüdilahusega, kuid neid läbivad voolud on erinevad. Tähistame voolude tugevust läbi I1, I2, I3. Siis I 1 = I 2 + I 3 . Mõõtes erinevates vannides elektroodidele eralduvate ainete massid m 1, m 2, m 3, saab veenduda, et need on võrdelised vastavate vooludega I 1, I 2, I 3.
Elektroni laengu määramine.
Elektroni laengu määramiseks saab kasutada valemit (16.6) elektroodile eralduva aine massi kohta. Sellest valemist järeldub, et elektronide laengu moodul on võrdne:
Teades eralduva aine massi m laengu IΔt läbimisel, molaarmassi M, n aatomi valentsi ja Avogadro konstanti N A, saab leida elektroni laengu mooduli väärtuse. Selgub, et see on võrdne e = 1,6 10 -19 C.
Nii saadi 1874. aastal esimest korda elementaarelektrilaengu väärtus.
Elektrolüüsi rakendamine. Elektrolüüsi kasutatakse inseneritöös laialdaselt erinevatel eesmärkidel. Elektrolüütiliselt katke ühe metalli pind õhukese kihiga teise metalliga ( nikeldamine, kroomimine, kullamine jne.). See vastupidav kate kaitseb pinda korrosiooni eest. Kui on tagatud elektrolüütilise katte hea koorumine pinnalt, millele metall on ladestunud (see saavutatakse näiteks grafiidi pinnale kandmisega), siis saab reljeefpinnalt koopia.
Kooritavate katete saamise protsess - elektrotüüp- töötas välja vene teadlane B. S. Jacobi (1801-1874), kes 1836. aastal kasutas seda meetodit Peterburi Iisaku katedraali õõnsate kujundite valmistamisel.
Varem saadi trükitööstuses maatriksitest (komplekti jäljend plastmaterjalile) koopiaid reljeefselt pinnalt (stereotüübid), mille jaoks kanti maatriksitele paks kiht rauda või muud ainet. See võimaldas reprodutseerida komplekti vajalikus arvus eksemplare.
Elektrolüüs eemaldab metallidest lisandid. Nii valatakse maagist saadud toorvask paksude lehtedena, mis seejärel asetatakse anoodidena vanni. Elektrolüüsi käigus anoodi vask lahustub, väärtuslikke ja haruldasi metalle sisaldavad lisandid langevad põhja ning puhas vask settib katoodile.
Alumiinium saadakse sulaboksiidist elektrolüüsi teel. Just see alumiiniumi saamise meetod muutis selle odavaks ja koos rauaga tehnikas ja igapäevaelus kõige levinumaks.
Elektrolüüsi abil saadakse elektroonilised trükkplaadid, mis on kõigi elektroonikatoodete aluseks. Dielektrikule liimitakse õhuke vaskplaat, millele kantakse spetsiaalse värviga keeruline ühendusjuhtmete muster. Seejärel asetatakse plaat elektrolüüti, kuhu söövitatakse värviga katmata vasekihi kohad. Pärast seda pestakse värv maha ja tahvlile ilmuvad mikroskeemi detailid.
Elektrivool vedelikes on põhjustatud positiivsete ja negatiivsete ioonide liikumisest. Erinevalt voolust juhtides, kus elektronid liiguvad. Seega, kui vedelikus ei ole ioone, siis on tegemist dielektrikuga, näiteks destilleeritud veega. Kuna laengukandjad on ioonid ehk aine molekulid ja aatomid, siis kui sellist vedelikku läbib elektrivool, toob see paratamatult kaasa aine keemiliste omaduste muutumise.
Kust tulevad vedelikus positiivsed ja negatiivsed ioonid? Ütleme kohe, et laengukandjad ei ole võimelised tekkima kõigis vedelikes. Neid, milles need esinevad, nimetatakse elektrolüütideks. Nende hulka kuuluvad hapete ja leeliste soolade lahused. Näiteks soola vees lahustamisel võtke lauasool NaCl, laguneb see lahusti ehk vee toimel positiivseks iooniks Na nimetatakse katiooniks ja negatiivseks iooniks Cl nimetatakse aniooniks. Ioonide moodustumise protsessi nimetatakse elektrolüütiliseks dissotsiatsiooniks.
Teeme katse, selleks vajame klaaspirni, kahte metallelektroodi, ampermeetrit ja alalisvooluallikat. Täidame kolbi keedusoola lahusega vees. Seejärel panime sellesse lahusesse kaks ristkülikukujulist elektroodi. Me ühendame elektroodid alalisvooluallikaga läbi ampermeetri.
Joonis 1 – Kolb soolalahusega
Kui voolutugevus on plaatide vahel sisse lülitatud, tekib elektriväli, mille toimel hakkavad soolaioonid liikuma. Positiivsed ioonid tormavad katoodile ja negatiivsed ioonid anoodile. Samal ajal teevad nad kaootilist liikumist. Aga samas lisandub väljaku toimel sinna ka tellitu.
Erinevalt juhtidest, milles liiguvad ainult elektronid, see tähendab ühte tüüpi laenguid, liiguvad elektrolüütides kahte tüüpi laenguid. Need on positiivsed ja negatiivsed ioonid. Nad liiguvad üksteise poole.
Kui positiivne naatriumioon jõuab katoodini, omandab see puuduva elektroni ja muutub naatriumi aatomiks. Sarnane protsess toimub ka klooriiooniga. Alles anoodile jõudes loobub klooriioon elektronist ja muutub klooriaatomiks. Seega säilib välisahelas elektronide liikumise tõttu vool. Ja elektrolüüdis näivad ioonid elektrone ühest poolusest teise kandvat.
Elektrolüütide elektritakistus sõltub moodustunud ioonide hulgast. Tugevates elektrolüütides on dissotsiatsiooni tase lahustumisel väga kõrge. Nõrgad on madalad. Samuti mõjutab temperatuur elektrolüüdi elektritakistust. Selle suurenemisega vedeliku viskoossus väheneb ning rasked ja kohmakad ioonid hakkavad kiiremini liikuma. Vastavalt sellele väheneb takistus.
Kui soolalahus asendatakse vasksulfaadi lahusega. Siis, kui seda läbib vool, siis kui vaskatioon jõuab katoodini ja võtab seal vastu puuduvad elektronid, taastatakse see vase aatomiks. Ja kui pärast seda elektroodi eemaldate, leiate sellelt vase ladestusi. Seda protsessi nimetatakse elektrolüüsiks.