Katalüüs. Katalüsaator. Katalüüsi tüübid: homogeenne, heterogeenne, autokatalüsaator. Katalüütiliste reaktsioonide mehhanism. Katalüüs ja katalüsaatorid Katalüsaatori tööpõhimõte keemilises reaktsioonis
Keemiliste reaktsioonide kiirus võib järsult suureneda mitmesuguste ainete juuresolekul, mis ei ole reagendid ega kuulu reaktsioonisaaduste hulka. Seda tähelepanuväärset nähtust nimetatakse katalüüs(kreeka keelest "katalysis" - hävitamine). Ainet, mis suurendab reaktsiooni kiirust segus, nimetatakse katalüsaator. Selle kogus enne ja pärast reaktsiooni jääb muutumatuks. Katalüsaatorid ei esinda mingit erilist aineklassi. Erinevates reaktsioonides võivad metallid, oksiidid, happed, soolad ja kompleksühendid avaldada katalüütilist toimet. Keemilised reaktsioonid elusrakkudes kulgevad katalüütiliste valkude, nn ensüümid. Katalüüsi tuleks pidada tõeliseks keemiliseks teguriks keemiliste reaktsioonide kiiruse suurendamisel, kuna katalüsaator on reaktsioonis otseselt seotud. Katalüüs on reaktsiooni kiirendamisel sageli võimsam ja vähem riskantne kui temperatuuri tõstmine. See ilmneb selgelt elusorganismide keemiliste reaktsioonide näitel. Reaktsioonid, nagu valkude hüdrolüüs, mis laborites tuleb läbi viia pikaajalisel kuumutamisel keemistemperatuurini, kulgevad seedimise protsessis ilma kehatemperatuuril kuumutamata.
Esimest korda täheldas katalüüsi fenomeni prantsuse keemik L. J. Tenard (1777-1857) aastal 1818. Ta avastas, et teatud metallide oksiidid põhjustavad lahusele vesinikperoksiidi lisamisel selle lagunemist. Sellist kogemust on lihtne reprodutseerida, lisades 3% vesinikperoksiidi lahusele kaaliumpermanganaadi kristalle. Sool KMp0 4 muutub Mn0 2-ks ja hapnik vabaneb lahusest kiiresti oksiidi toimel:
Katalüsaatori otsene mõju reaktsioonikiirusele on seotud aktiveerimisenergia vähenemisega. Normaalse temperatuuri languse korral? ja 20 kJ/mol suurendab kiiruskonstanti ligikaudu 3000 korda. alandada E L võib olla palju tugevam. Aktiveerimisenergia vähenemine on aga katalüsaatori toime väline ilming. Reaktsiooni iseloomustab teatud väärtus E. v mis saab muutuda ainult siis, kui reaktsioon ise muutub. Samade toodete andmine, reaktsioon lisanduva aine osalusega kaasas erineva tee kaudu erinevate etappide ja erineva aktiveerimisega. Kui sellel uuel teel on aktiveerimisenergia väiksem ja reaktsioon vastavalt kiirem, siis me ütleme, et see aine on katalüsaator.
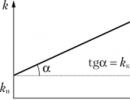
Katalüsaator interakteerub ühe reagendiga, moodustades mõne vaheühendi. Reaktsiooni ühes järgmistest etappidest katalüsaator regenereeritakse - see jätab reaktsiooni algsel kujul. Katalüütilises reaktsioonis osalevad reaktiivid jätkavad üksteisega ja aeglasel teel suhtlemist ilma katalüsaatori osaluseta. Seetõttu kuuluvad katalüütilised reaktsioonid mitmete komplekssete reaktsioonide hulka, mida nimetatakse jada-paralleelseks. Joonisel fig. 11.8 näitab kiiruskonstandi sõltuvust katalüsaatori kontsentratsioonist. Sõltuvusgraafik ei läbi nulli, kuna katalüsaatori puudumisel reaktsioon ei peatu.

Riis. 11.8.
vaadeldav konstant k väljendatud summana k u+ & k c(k)
Näide 11.5. Temperatuuril -500 °C toimub vääveloksiidi (IV) oksüdatsioonireaktsioon
mis on väävelhappe tööstusliku tootmise üks etappe, on väga aeglane. Temperatuuri edasine tõus on vastuvõetamatu, kuna tasakaal nihkub vasakule (eksotermiline reaktsioon) ja toote saagis langeb liiga palju. Kuid seda reaktsiooni kiirendavad erinevad katalüsaatorid, millest üks võib olla lämmastikoksiid (II). Esiteks reageerib katalüsaator hapnikuga: ![]()
ja seejärel kannab hapnikuaatomi üle vääveloksiidiks (IV):
Seega moodustub reaktsiooni lõppprodukt ja katalüsaator regenereeritakse. Reaktsiooni jaoks avanes võimalus voolata mööda uut rada, kus kiiruskonstandid suurenesid märkimisväärselt:

Allolev diagramm näitab S0 2 oksüdatsiooniprotsessi mõlemat rada. Katalüsaatori puudumisel kulgeb reaktsioon ainult mööda aeglast rada ja katalüsaatori juuresolekul mööda mõlemat.
Katalüüsi on kahte tüüpi - homogeenne ja heterogeenne. Esimesel juhul moodustavad katalüsaator ja reaktiivid gaasisegu või lahuse kujul homogeense süsteemi. Vääveloksiidi oksüdatsiooni näiteks on homogeenne katalüüs. Homogeense katalüütilise reaktsiooni kiirus sõltub nii reagentide kontsentratsioonist kui ka katalüsaatori kontsentratsioonist.
Heterogeense katalüüsi korral on katalüsaator puhtal kujul või kandjal tahke aine vedaja. Näiteks plaatinat kui katalüsaatorit saab kinnitada asbestile, alumiiniumoksiidile jne. Reaktiivi molekulid adsorbeeritakse (absorbeeritakse) gaasist või lahusest katalüsaatori pinna kindlates punktides – aktiivsetes tsentrites ja aktiveeruvad samal ajal. Pärast keemilist muundamist desorbeeritakse saadud produktimolekulid katalüsaatori pinnalt. Aktiivsetes keskustes korduvad osakeste muundamise aktid. Muude tegurite hulgas sõltub heterogeense katalüütilise reaktsiooni kiirus katalüütilise materjali pindalast.
Heterogeenset katalüüsi kasutatakse eriti laialdaselt tööstuses. Selle põhjuseks on pideva katalüütilise protsessi lihtsus, mille käigus reagentide segu juhitakse läbi katalüsaatoriga kontaktseadme.
Katalüsaatorid toimivad selektiivselt, kiirendades väga spetsiifilist tüüpi reaktsiooni või isegi üksikut reaktsiooni teisi mõjutamata. See võimaldab kasutada katalüsaatoreid mitte ainult reaktsioonide kiirendamiseks, vaid ka lähteainete sihipäraseks muutmiseks soovitud toodeteks. Metaan ja vesi 450 ° C juures Fe 2 0 3 katalüsaatoril muundatakse süsinikdioksiidiks ja vesinikuks:
Samad ained reageerivad 850 °C juures nikli pinnal, moodustades süsinikmonooksiidi (II) ja vesinikku:

Katalüüs kuulub nendesse keemiavaldkondadesse, mille puhul pole veel võimalik täpseid teoreetilisi ennustusi teha. Kõik tööstuslikud katalüsaatorid naftatoodete, maagaasi, ammoniaagi tootmise ja paljude teiste töötlemiseks on töötatud töömahuka ja pika eksperimentaalsete uuringute põhjal.
Võimalus kontrollida keemiliste protsesside kiirust on inimese majandustegevuses hindamatu tähtsusega. Keemiatoodete tööstustoodangus on tavaliselt vaja suurendada tehnoloogiliste keemiliste protsesside määrasid ja toodete ladustamist, on vaja vähendada hapniku, vee jne lagunemise määra või kokkupuudet. Tuntud ained, mis võivad aeglustada keemilisi reaktsioone. Neid kutsutakse inhibiitorid, või negatiivsed katalüsaatorid. Inhibiitorid erinevad põhimõtteliselt reaalsetest katalüsaatoritest, kuna nad reageerivad aktiivsete liikidega (vabad radikaalid), mis ühel põhjusel või teisel põhjusel tekivad aine või selle keskkonnas ning põhjustavad väärtuslikke lagunemis- ja oksüdeerimisreaktsioone. Inhibiitorid tarbitakse järk-järgult, lõpetades nende kaitsva toime. Kõige olulisemad inhibiitorite tüübid on antioksüdandid, mis kaitsevad erinevaid materjale hapniku mõju eest.
Tuleks meelde tuletada ka seda, mida katalüsaatorite abil saavutada ei saa. Nad on võimelised kiirendama ainult spontaanseid reaktsioone. Kui reaktsioon ei kulge spontaanselt, ei saa katalüsaator seda kiirendada. Näiteks ei saa ükski katalüsaator põhjustada vee lagunemist vesinikuks ja hapnikuks. Seda protsessi saab läbi viia ainult elektrolüüsi teel, kulutades elektritööd.
Katalüsaatorid võivad aktiveerida ka soovimatuid protsesse. Viimastel aastakümnetel on 20-25 km kõrgusel toimunud atmosfääri osoonikihi järkjärguline hävimine. Eeldatakse, et osooni lagunemisel osalevad mõned ained, näiteks halogeenitud süsivesinikud, mida paiskavad atmosfääri tööstusettevõtted, aga ka kasutatakse koduseks otstarbeks.
Entsüklopeediline YouTube
1 / 5
✪ Füüsikaline keemia. Loeng 3. Keemiline kineetika ja katalüüs
✪ Keemia. Keemiliste reaktsioonide kineetika. Keemilise reaktsiooni kiirus. Foxfordi veebiõppekeskus
✪ Videotund "Katalüsaatorid ja katalüüs" - KEEMIA - 9 rakku.
✪ Loeng 2. "Katalüüs kui keemiline ja kineetiline nähtus"
✪ Sissejuhatus kineetikasse
Subtiitrid
Katalüüsi põhiprintsiibid
Katalüsaator muudab reaktsioonimehhanismi energeetiliselt soodsamaks, st vähendab aktiveerimisenergiat. Katalüsaator moodustab ühe reagendi molekuliga vaheühendi, milles keemilised sidemed on nõrgenenud. See hõlbustab selle reaktsiooni teise reagendiga. Oluline on märkida, et katalüsaatorid kiirendavad pöörduvaid reaktsioone nii edasi- kui ka tagasisuunas. Seetõttu ei nihuta nad keemilist tasakaalu.
Katalüüsi tüübid
Vastavalt mõjule reaktsioonikiirusele jaguneb katalüüs positiivseks (reaktsioonikiirus suureneb) ja negatiivseks (reaktsioonikiirus väheneb). Viimasel juhul toimub inhibeerimisprotsess, mida ei saa pidada "negatiivseks katalüüsiks", kuna inhibiitor kulub reaktsiooni käigus ära.
Katalüüs toimub homogeenne ja heterogeenne(kontakt). Homogeenses katalüüsis on katalüsaator reaktiividega samas faasis, heterogeensed katalüsaatorid erinevad faasi poolest.
homogeenne katalüüs
Homogeense katalüüsi näide on vesinikperoksiidi lagunemine joodiioonide juuresolekul. Reaktsioon toimub kahes etapis:
H 2 O 2 + I → H 2 O + IO H 2 O 2 + IO → H 2 O + O 2 + I
Homogeenses katalüüsis on katalüsaatori toime tingitud sellest, et see interakteerub reagentidega, moodustades vaheühendeid, mis viib aktiveerimisenergia vähenemiseni.
heterogeenne katalüüs
Heterogeense katalüüsi korral esineb protsessi kiirendus tavaliselt tahke korpuse pinnal - katalüsaator, nii et katalüsaatori aktiivsus sõltub selle pinna suurusest ja omadustest. Praktikas kantakse katalüsaator tavaliselt tahkele poorsele kandjale.
Heterogeense katalüüsi mehhanism on keerulisem kui homogeense katalüüsi mehhanism. Heterogeense katalüüsi mehhanism sisaldab viit etappi, mis kõik on pöörduvad.
- Reagentide difusioon tahke aine pinnale
- Füüsiline adsorptsioon reageerivate molekulide tahke pinna aktiivsetel kohtadel ja seejärel nende kemisorptsioon
- Reageerivate molekulide vaheline keemiline reaktsioon
- Toodete desorptsioon katalüsaatori pinnalt
- Toote difusioon katalüsaatori pinnalt üldvoolu
Heterogeense katalüüsi näiteks on SO 2 oksüdeerimine SO 3-ks V 2 O 5 katalüsaatoril väävelhappe tootmisel (kontaktmeetod).
Reaktsiooni kulgu katalüsaatori pinnale saab demonstreerida eksperimendis, kus plaatina plaat kuumutatakse gaasipõleti leekis, siis leek on kustutatud ja põleti joak plaat, samal ajal kui plaat muutub taas kuumaks - metalli pinnal toimub metaani oksüdatsioon.
Katalüsaatori kandja
katalüsaatori kandja, muidu substraat (katalüsaator) (inglise keeles kandja või tugi) - inertne või madala aktiivsusega materjal, mis stabiliseerib aktiivse katalüütilise faasi osakesi selle pinnal.
Heterogeense katalüüsitoetuse roll on aktiivse komponendi aglomeerumise või paagutamise vältimine, mis võimaldab säilitada kõrge kontaktpind toimeaine (vt aktiivset katalüütilist faasi) ja reaktiivide vahel. Kandja kogus on üldiselt palju suurem kui sellele kantud toimeaine kogus. Peamised nõuded kandjatele on suur pindala ja poorsus, termiline stabiilsus, keemiline inertsus, kõrge mehaaniline tugevus. Mõnel juhul mõjutab kandja aktiivse faasi omadusi ("tugeva metalli-kandja interaktsiooni" mõju). Nagu kandjatena, nii looduslike (savid, pimsskivi, diatomiit, asbesti jne) ja sünteetilised materjalid (aktiivsed süsinikud, silikageel, alumiiniumoksiidid, alumiiniumi, magneesiumi, tsirkooniumi jne).
Katalüüsi keemia
Katalüüsi keemia uurib aineid, mis muudavad keemiliste reaktsioonide kiirust. Reaktsioone aeglustavaid aineid nimetatakse inhibiitorid. Ensüümid on bioloogilised katalüsaatorid. Katalüsaator ei ole toodetega stöhhiomeetrilises seoses ja regenereeritakse pärast iga reagentide produktideks muundamise tsüklit. Vaatamata uute molekulide aktiveerimise viiside tekkimisele (plasmakeemia, kiirguse ja laser toime ja laser-efektid ja teised), katalüüs on keemilise tootmise aluseks (katalüütiliste protsesside suhteline osakaal on 80-90%).
Reaktsioon, mis toitis inimkonda (seotud lämmastiku probleemi lahendus), on Haber-Boschi tsükkel. Ammoniaaki toodetakse poorse raudkatalüsaatoriga. Esineb P = 30 juures MPa ja Т = 420-500 °C
3H2 + N2 \u003d 2NH3
NH3 sünteesiks saadakse vesinik kahe järjestikuse katalüütilise protsessi abil: CH4 (CH4 + H20 → CO + 3H2) konversioon NI-katalüsaatoridel ja saadud süsinikmonooksiidi konversiooniks (CO + H2) O → CO 2 + H 2) . Kõrge konversioonikraadide saavutamiseks viiakse viimane reaktsioon läbi kahes etapis: kõrge temperatuur (315-480 ° C) - FE - CR-oksiidi katalüsaatorite ja madala temperatuuriga (200-350 ° C) - CU-s - Zn - oksiidkatalüsaatorid. Ammoniaagist saadakse lämmastikhapet ja muid lämmastikuühendeid – ravimitest ja väetistest lõhkeaineteni.
Erista katalüüsi "" homogeenne, heterogeenne, liidese, mitsellaarne, ensümaatiline.
Aktiveerimisenergia E katalüütilised reaktsioonid on palju väiksemad kui sama reaktsiooni korral katalüsaatori puudumisel. Näiteks NH 3 mittekatalüütiliseks lagundamiseks N 2 + H 2-ks E~ 320 kJ/mol, sama lagunemise korral plaatina juuresolekul E~ 150 kJ/mol. Tänu vähendamisele E katalüütilised reaktsioonid on kiirendatud võrreldes mittekatalüütiliste reaktsioonidega.
Katalüüsi kasutamine tööstuses
hüdrogeenimine
Suur hulk katalüütilisi reaktsioone on seotud vesinikuaatomi ja mõne muu molekuli aktiveerimisega, mis viib nende keemilise vastasmõjuni. Seda protsessi nimetatakse hüdrogeenimiseks ja see on paljude nafta rafineerimise ja kivisöest vedelkütuste tootmise etappide aluseks (Bergiuse protsess). Lennukibensiini ja mootorikütuse tootmine kivisöest töötati välja Saksamaal Teise maailmasõja ajal, kuna selles riigis puuduvad naftaväljad. Bergiuse protsess on vesiniku otsene lisamine süsinikule. Kivisüsi kuumutatakse rõhu all vesiniku juuresolekul ja saadakse vedel toode, mis seejärel töödeldakse lennukibensiiniks ja mootorikütuseks. Katalüsaatorina kasutatakse raudoksiidi, aga ka tina ja molübdeeni baasil katalüsaatoreid. Sõja ajal saadi 12 Saksamaa tehases Bergiuse protsessi abil ligikaudu 1400 tonni vedelkütust päevas. Teine protsess, Fischer – Tropsch, koosneb kahest etapist. Esiteks gaasistatakse kivisüsi, see tähendab, et see reageerib veeauru ja hapnikuga ning saadakse vesiniku ja süsinikoksiidide segu. See segu muundatakse vedelaks kütuseks, kasutades rauda või koobaltit sisaldavaid katalüsaatoreid. Sõja lõppedes lõpetati Saksamaal sünteetilise kütuse tootmine söest. Naftaembargole 1973-1974 järgnenud naftahinna tõusu tulemusena tehti jõulisi jõupingutusi majanduslikult tasuva meetodi väljatöötamiseks kivisöest bensiini tootmiseks. Seega saab kivisöe otsest veeldamist tõhusamalt läbi viia kaheetapilise protsessi abil, mille käigus kivisüsi viiakse esmalt kontakti alumiiniumoksiidi-koobalt-molübdeeni katalüsaatoriga suhteliselt madalal ja seejärel kõrgemal temperatuuril. Sellise sünteetilise bensiini maksumus on kõrgem kui naftast saadav bensiin.
happeline katalüüs
Suure klassi katalüsaatorite katalüütiline aktiivsus tuleneb nende happelistest omadustest. J. Bronstedi ja T. Lowry järgi on hape ühend, mis on võimeline prootonit loovutama. Tugevad happed loovutavad oma prootonid kergesti alustele. Happesuse kontseptsiooni arendas edasi G. Lewise töödes, kes defineeris hapet kui ainet, mis on võimeline vastu võtma doonoraine elektronpaari, moodustades selle elektronipaari sotsialiseerumise tõttu kovalentse sideme. Need ideed koos ideedega karbeniumioone moodustavate reaktsioonide kohta aitasid mõista erinevate katalüütiliste reaktsioonide, eriti süsivesinike reaktsioonide mehhanismi.
Happe tugevust saab määrata aluste komplekti abil, mis muudavad prootoni lisamisel värvi. Selgub, et mõned tööstuslikult olulised katalüsaatorid käituvad nagu väga tugevad happed. Nende hulka kuuluvad Friedel-Craftsi katalüsaator, nagu HCl-AlCl2O3 (või HAlCl4) ja alumiiniumsilikaadid. Happe tugevus on väga oluline omadus, kuna see määrab protoneerimise kiiruse, mis on happekatalüüsi protsessi võtmeetapp.
Õli krakkimisel kasutatavate katalüsaatorite, näiteks alumiiniumsilikaatide aktiivsuse määrab Bronstedi ja Lewise hapete olemasolu nende pinnal. Nende struktuur sarnaneb ränidioksiidi (ränidioksiidi) struktuuriga, milles osa Si 4+ aatomitest on asendatud Al 3+ aatomitega. Sel juhul tekkiva liigse negatiivse laengu saab neutraliseerida vastavate katioonidega.
Happekatalüsaatorite aktiivsuse määrab nende võime reageerida süsivesinikega, moodustades vaheproduktina karbeeniumiiooni. Alküülkarbeeniumioonid sisaldavad positiivselt laetud süsinikuaatomit, mis on seotud kolme alküülrühma ja/või vesinikuaatomiga. Nad mängivad olulist rolli vaheühenditena, mis moodustuvad paljudes reaktsioonides, milles osalevad orgaanilised ühendid. Happekatalüsaatorite toimemehhanismi saab illustreerida isomeerimisreaktsiooni näitega n-butaan isobutaaniks HCl-AlCl3 või Pt-Cl-Al2O3 juuresolekul. Esiteks seob väike kogus C 4 H 8 olefiini happekatalüsaatori positiivselt laetud vesiniku iooni, moodustades tertsiaarse karbeeniumi iooni. Seejärel eraldub negatiivselt laetud hüdriidioon H - n-butaan isobutaani ja sekundaarse butüülkarbeniumiooni moodustamiseks. Viimane muutub ümberkorraldamise tulemusena tertsiaarseks karbeeniumiooniks. See ahel võib jätkuda hüdriidiooni eemaldamisega järgmisest molekulist n- butaan jne.
Tähelepanuväärne on see, et tertsiaarsed karbeniumioonid on stabiilsemad kui primaarsed või sekundaarsed. Seetõttu esinevad need peamiselt katalüsaatori pinnal ja seetõttu on butaani isomerisatsiooni põhiproduktiks isobutaan.
Happekatalüsaatoreid kasutatakse laialdaselt nafta rafineerimisel – krakkimisel, alküülimisel, polümerisatsioonil ja süsivesinike isomerisatsioonil. Nendes protsessides katalüsaatori rolli mängivate karbeeniumioonide toimemehhanism on kindlaks tehtud. Samal ajal osalevad nad paljudes reaktsioonides, sealhulgas väikeste molekulide moodustumine suurte molekulide lõhestamisel, molekulide kombineerimine (olefiin olefiiniga või olefiin isoparafiiniga), struktuurne ümberkorraldamine isomerisatsiooni teel, parafiinide ja aromaatsete süsivesinike moodustumine. vesiniku ülekande teel.
Üks uusimaid happekatalüüsi tööstuslikke rakendusi on pliikütuste tootmine isobutüleenile või isoamüleenile alkoholide lisamise teel. Hapnikuga rikastatud ühendite lisamine bensiinile vähendab süsinikmonooksiidi kontsentratsiooni heitgaasides. metüül- tert-butüüleeter (MTBE) segamisoktaanarvuga 109 võimaldab saada ka kõrge oktaanarvuga kütust, mis on vajalik suure surveastmega automootori tööks, ilma tetraetüülpliid bensiini lisamata. Samuti korraldatakse oktaanarvuga 102 ja 111 kütuste tootmist.
Taimeõli hüdrogeenimine
Üks olulisemaid hüdrogeenimisreaktsioone praktikas on taimeõlide mittetäielik hüdrogeenimine margariiniks, toiduõliks ja muudeks toiduaineteks. Taimeõlisid saadakse sojaubadest, puuvillaseemnetest ja muudest põllukultuuridest. Nende hulka kuuluvad estrid, nimelt erineva küllastamatuse astmega rasvhapete triglütseriidid. Oleiinhappel CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH on üks kaksikside C \u003d C, linoolhappel - kaks ja linoleenhappel - kolm. Vesiniku lisamine selle sideme katkestamiseks takistab õlide oksüdeerumist (rääsumist). See tõstab nende sulamistemperatuuri. Enamiku saadud toodete kõvadus sõltub hüdrogeenimise astmest. Hüdrogeenimine viiakse läbi substraadile sadestunud peene niklipulbri või Raney nikli katalüsaatori juuresolekul kõrgelt puhastatud vesiniku atmosfääris.
Dehüdrogeenimine
Dehüdrogeenimine on ka tööstuslikult oluline katalüütiline reaktsioon, kuigi selle rakenduse ulatus on võrreldamatult väiksem. Selle abiga saadakse näiteks stüreen, mis on oluline monomeer. Selleks dehüdrogeneeritakse etüülbenseen raudoksiidi sisaldava katalüsaatori juuresolekul; kaalium ja mõni struktuurne stabilisaator aitavad samuti reaktsioonile kaasa. Tööstuslikus mastaabis propaan, butaan ja muud alkaanid dehüdrogeenitakse. Butaani dehüdrogeenimine alumiiniumoksiid-kroomkatalüsaatori juuresolekul annab buteenid ja butadieeni.
Ammoniaak
Üks keemilisest seisukohast lihtsamaid hüdrogeenimisprotsesse on ammoniaagi süntees vesinikust ja lämmastikust. Lämmastik on väga inertne aine. N-N sideme purustamiseks selle molekulis on vaja energiat suurusjärgus 200 kcal / mol. Lämmastik seondub aga raudkatalüsaatori pinnale aatomi olekus ja selleks on vaja vaid 20 kcal/mol. Vesinik seob rauaga veelgi kergemini.
põhiline katalüüs
Katalüsaatorite aktiivsuse määravad ära nende põhiomadused. Selliste katalüsaatorite vana ja tuntud näide on naatriumhüdroksiid, mida kasutatakse hüdrolüüsimiseks või rasvade hüdrolüüsimiseks ning seebi valmistamisel ja hiljutine näide on polüuretaanplastide ja vahtude tootmisel kasutatud katalüsaatorid. Uretaan tekib alkoholi interaktsioonil isotsüanaadiga ja see reaktsioon kiireneb aluseliste amiinide juuresolekul. Reaktsiooni ajal on aluse kinnitatud isotsüanaadi molekuli süsinikuaatomile, mille tulemusena ilmub lämmastikuaatomile negatiivne tasu ja selle aktiivsus alkoholi suhtes suureneb. Eriti tõhus katalüsaator on trietüleendiamiin. Polüuretaanplastid saadakse diisotsüanaatide reageerimisel polüoolidega (polüalkoholidega). Kui isotsüanaat reageerib veega, laguneb eelnevalt moodustunud uretaan, vabastades CO2. Kui polüalkoholide ja vee segu reageerib diisotsüanaatidega, vahustub tekkiv polüuretaanvaht gaasilise CO 2 -ga.
Kahe toimega katalüsaatorid
Need katalüsaatorid kiirendavad kahte tüüpi reaktsioone ja annavad paremaid tulemusi kui reagentide järjestikuse suunamine läbi kahe reaktori, millest igaüks sisaldab ainult ühte tüüpi katalüsaatorit. See on tingitud asjaolust, et kahetoimelise katalüsaatori aktiivsed saidid on üksteisele väga lähedal ja ühel neist moodustuv vaheprodukt muutub teisel koheselt lõppsaaduseks. Hea tulemuse annab vesinikku aktiveeriva katalüsaatori kombineerimine süsivesinike isomerisatsiooni soodustava katalüsaatoriga. Vesiniku aktiveerimise teostavad mõned metallid ja süsivesinike isomerisatsiooni hapetega. Tõhus kahetoimeline katalüsaator, mida kasutatakse nafta rafineerimisel nafta muundamiseks bensiiniks, on happelisele alumiiniumoksiidile sadestatud peendispersne plaatina. Tööstusbensiini komponentide, näiteks metüültsüklopentaani metüültsüklopentaani (MCP) muundamine benseeniks suurendab bensiini oktaanarvu. Esiteks dehüdrogeenitakse MCP katalüsaatori plaatinaosal sama süsiniku põhiahelaga olefiiniks; seejärel läheb olefiin katalüsaatori happeossa, kus see isomeriseerub tsüklohekseeniks. Viimane läheb üle plaatinaosale ja dehüdrogeneerub benseeniks ja vesinikuks. Kahe toimega katalüsaatorid kiirendavad oluliselt õli reformimist. Neid kasutatakse normaalsete parafiinide isomeerimiseks isoparafiinideks. Viimased, mis keevad bensiinifraktsioonidega samadel temperatuuridel, on väärtuslikud, kuna neil on suurem oktaanarv võrreldes tavaliste süsivesinikega. Lisaks kaasneb n-butaani muundamisega isobutaaniks dehüdrogeenimine, mis aitab kaasa MTBE tootmisele.
Stereospetsiifiline polümerisatsioon
Oluliseks verstapostiks katalüüsi ajaloos oli olefiinide katalüütilise polümerisatsiooni avastamine stereoregulaarsete polümeeride moodustumisega. Stereospetsiifilised polümerisatsioonikatalüsaatorid avastas K. Ziegler, kui ta püüdis selgitada saadud polümeeride ebatavalisi omadusi. Teine keemik J. Natta väitis, et Ziegleri polümeeride ainulaadsuse määrab nende stereoregulaarsus. Röntgendifraktsioonikatsed on näidanud, et propüleenist Ziegleri katalüsaatorite juuresolekul valmistatud polümeerid on väga kristalsed ja neil on tõepoolest stereoregulaarne struktuur. Natta võttis selliste järjestatud struktuuride kirjeldamiseks kasutusele terminid "isotaktiline" ja "sündiotaktiline". Kui korraldust pole, kasutatakse terminit "taktika".
Stereospetsiifiline reaktsioon toimub tahkete katalüsaatorite pinnal, mis sisaldavad mittetäielikult oksüdeerunud rühmade IVA-VIII siirdemetalle (nagu Ti, V, Cr, Zr) ja mis tahes süsinikku või vesinikku sisaldavat ühendit, mis on seotud metalliga. I-III rühmad. Sellise katalüsaatori klassikaline näide on TiCl 4 ja Al(C 2 H 5) 3 interaktsiooni käigus heptaanis tekkiv sade, kus titaan redutseeritakse kolmevalentsesse olekusse. See äärmiselt aktiivne süsteem katalüüsib propüleeni polümerisatsiooni normaalsel temperatuuril ja rõhul.
katalüütiline oksüdatsioon
Katalüsaatorite kasutamine oksüdatsiooniprotsesside keemia kontrollimiseks on suure teadusliku ja praktilise tähtsusega. Mõnel juhul peab oksüdatsioon olema täielik, näiteks CO ja süsivesinike saasteainete neutraliseerimisel autode heitgaasides. Enamasti on siiski soovitav, et oksüdatsioon oleks mittetäielik, näiteks paljudes tööstuses laialdaselt kasutatavates protsessides süsivesinike muundamiseks väärtuslikeks vaheühenditeks, mis sisaldavad funktsionaalseid rühmi nagu -CHO, -COOH, -C-CO, - CN. Sel juhul kasutatakse nii homogeenseid kui ka heterogeenseid katalüsaatoreid. Homogeense katalüsaatori näiteks on siirdemetallide kompleks, mida kasutatakse paraksüleeni oksüdeerimiseks tereftaalhappeks, mille estrid on polüesterkiudude tootmise aluseks.
Etüleeni tootmine metaani dehüdrodimerisatsiooni teel
Etüleeni süntees dehüdrodimerisatsiooni teel võimaldab maagaasi muundada kergemini transporditavateks süsivesinikeks. Reaktsioon 2CH4 + 2O2 → C2H4 + 2H2O viiakse läbi 850 °C juures, kasutades erinevaid katalüsaatoreid; parimad tulemused saadakse Li-MgO katalüsaatoriga. Arvatavasti kulgeb reaktsioon metüülradikaali moodustumisega, eraldades metaani molekulist vesinikuaatomi. Lõhustamine toimub mittetäielikult redutseeritud hapnikuga, näiteks O2−
2. Gaasifaasis olevad metüülradikaalid rekombineeruvad, moodustades etaanimolekuli ja järgneva dehüdrogeenimise käigus muudetakse etüleeniks. Teine näide mittetäielikust oksüdatsioonist on metanooli muundamine formaldehüüdiks hõbeda või raud-molübdeeni katalüsaatori juuresolekul.
Heterogeensed oksüdatsioonikatalüsaatorid
Need katalüsaatorid on tavaliselt keerulised tahked oksiidid. Katalüütiline oksüdatsioon toimub kahes etapis. Esiteks on oksiidi hapnik tabanud oksiidi pinnale adsorbeerunud süsivesiniku molekuli. Süsivesinik oksüdeeritakse ja oksiid redutseeritakse. Vähendatud oksiidi reageerib hapnikuga ja naaseb algse olekusse. Kasutades vanadiini katalüsaatorit, saadakse ftaalanhüdriid naftaleeni või butaani osalise oksüdeerimise teel.
Katalüüsi definitsioon. Katalüüsi tüübid. Kemisorptsioon ja vahepealse aktiveeritud kompleksi moodustumine. Katalüütilise reaktsiooni aktiveerimisenergia. Katalüüs ja tasakaal. katalüüsi rakendamine.
Katalüüs- keemiliste reaktsioonide ergutamise nähtus eriainete järgi - katalüsaatorid. Katalüsaator astub korduvalt vahepealsesse keemilise interaktsiooni reaktsioonis osalevate ainetega ja taastab oma koostise pärast iga vahepealsete interaktsioonide tsüklit.
homogeenne katalüüs– reagendid ja katalüsaator moodustavad ühe faasi.
heterogeenne katalüüs- ained ja katalüsaator on erinevates faasides.
Mikroheterogeenne katalüüs Homogeense ja heterogeense katalüüsi vahel on vahepealne asend. Katalüsaatoriks on suur polümeeri molekul. Väikeste molekulide puhul nende suheldes on need sarnased heterogeensete osakestega, kuid need moodustavad ühe faasi reagentidega. See rühm hõlmab ensümaatilisi reaktsioone, milles katalüsaator (ensüüm) on suur valgumolekulide kompleksse kompositsiooni ja struktuuri. Seetõttu nimetatakse seda ensümaatiline katalüüs.
Keemiline ümberkujundamine toimub aktiivse kompleksi moodustamise kaudu liigse energiaga. Uute ainete ümberkorraldamise piisav on piisav. Muutus süsteemi energias keemilisel suhtlusel piki reaktsiooniliini (1).
A - aktiveeritud kompleks
K - vaheühendus katalüsaatoriga
E 0, E k - lähteainete ja saaduste energiad
E 1, E 2 - ümberkujundamise aktiveerimise energia edasi ja vastupidine suundades
Δh on energia muutus ümberkujundamise tulemusena (termiline toime).
Kuid kõigil molekulidel ei ole piisavat energiat aktiivse kompleksi moodustamiseks - ainult need, kelle energia ületab aktiveerimise energia E 1. Kui nõutav energia E 1 on suur, siis reaktsioon praktiliselt ei jätkata.
Katalüsaator avab uue reaktsioonitee, reageerides keemiliselt, moodustades aktiveeritud kompleksi, millel on vähem energiat, kui on vaja aktiveeritud kompleksi moodustamiseks ilma katalüsaatorita. Vaheühend, mis sisaldab katalüsaatorit, muundatakse edasi produktideks läbi teise aktiveeritud kompleksi, kuid ka väiksema energiaga. Pärast reaktsiooni teist etappi taastab katalüsaator oma keemilise koostise ja selle komponendid ei sisaldu toodete koostises. Ja kuigi reaktsioonitee pikeneb ja muutub etapiks, viib aktiveeritud kompleksi energia vähenemine reaktsioonikiiruse suurenemiseni (2).
Allikas teadmata
Eriline huvi katalüüsi vastu avaldus tööstusliku keemia arengu käigus, kuna võime kiirendada keemilisi reaktsioone õiges suunas ilma energiat kulutamata ja sisuliselt katalüsaatorit ennast tarbimata andis katalüüsile suure praktilise tähenduse. Katalüüsi abil lahendatakse seotud lämmastiku tehnoloogia ees seisvad probleemid, enam kui 80% õlist töödeldakse katalüütiliste protsessidega, enamikku orgaanilise sünteesi protsessidest on võimatu läbi viia.
Katalüsaatorid- ained, mis reaktsioonis osalejatega korduvalt vahepealsesse suhtlusse astudes muudavad selle mehhanismi ja suurendavad reaktsiooni kiirust; samal ajal taastavad nad oma keemilise koostise pärast iga vahepealse kokkupuute tsüklit.
Katalüsaatori mõju keemilise reaktsiooni mehhanismile on seletatav tavapärase näitega. Üheastmeline reaktsioon kulgeb aktiveerimisenergiaga E 0:
Reaktsiooni kulgu katalüütiliste ja mittekatalüütiliste reaktsioonide energiadiagrammil näitab kõver 1. Katalüsaatori juuresolekul reaktsioonimehhanism muutub, see kulgeb läbi mitme järjestikuse etapi (kõver 2). Näiteks võib esimene etapp olla vahepealse aktiveeritud Akt kompleksi moodustamine:
A + Kt → AKt
Aktiveeritud kompleks reageerib seejärel teise reagendiga, moodustades katalüsaator-produkti kompleksi:
ACT + V → RKt
Viimane etapp on RKt kompleksi lagunemine koos toote K moodustumisega ja katalüsaatori vabastamisega uue katalüütilise tsükli jaoks:
Rkt → R + Kt
Kõiki neid järjestikuseid etappe iseloomustavad selle aktiveerimisenergiad E 1 , E 2 , E 3 , kuid reeglina on iga potentsiaalse barjääri kõrgus väiksem kui aktiveerimisenergia E 0 . Seega kulgeb reaktsioon katalüsaatori juuresolekul mööda energeetiliselt soodsamat rada, mis võimaldab protsessi läbi viia suurema kiirusega.
Reaktsioonisüsteemi algne (I) ja lõpp (II) energiaseisund katalüsaatori juuresolekul ja ilma selleta jäävad samaks; seega: katalüsaator ei saa muuta keemilise tasakaalu olekut, mis ei sõltu reaktsiooniteest.
Katalüsaatori roll on ainult tasakaaluseisundi saavutamise kiiruse muutmine. Katalüsaator võib suurendada ainult nende protsesside kiirust, mis on termodünaamiliselt lubatud, kuid ei saa algatada termodünaamiliselt võimatuid reaktsioone.
Mõned keemilised reaktsioonid ilma katalüsaatorita on liiga suure aktiveerimisenergia tõttu praktiliselt võimatud. Näib, et kõrge energiabarjääri ületamiseks on võimalik suurendada molekulide kineetilist energiat ehk tõsta temperatuuri. Kuid paljude pöörduvate eksotermiliste reaktsioonide puhul põhjustab temperatuuri tõus tasakaalu nihkumist vastupidises suunas ja muudab reaktsiooni termodünaamiliselt lahendamata. Sellistel juhtudel pole katalüsaatorite kasutamine mitte ainult õigustatud, vaid ka vajalik. Katalüsaator vähendab aktiveerimise energia ja seega võimaldab seda läbi viia oluliselt madalamatel temperatuuridel.
Reaktiivi molekulid adsorbeeritakse katalüsaatori pinnale. Adsorptsioon on nähtus, mis on seotud gaasi koguse vähenemisega, kui gaas (adsorbaat) puutub kokku tahke ainega (adsorbendiga), ja seisneb gaasi teatud tihenemises tahke aine pinnal. Füüsilist adsorptsiooni ja kemisorptsiooni eristatakse sõltuvalt jõudude olemusest, mis põhjustavad adsorbaadi molekulide sellist kontsentratsiooni tahke aine pinnal. Kui need jõud on oma olemuselt samasugused kui gaaside, vedelike ja tahkete ainete molekulaarne toime, siis räägitakse füüsikalisest adsorptsioonist. Kell kemisorptsioon avalduvad keemilise iseloomuga vastasmõjujõud - adsorbaadi molekulid kaotavad oma individuaalsuse, moodustades adsorbendiga pinnaühendeid.
Katalüütiliste protsesside käigus on põhiroll kemisorptsioonil ehk aktiveeritud adsorptsioonil, mille tulemusena moodustub aktiveeritud adsorptsioonikompleks- ebastabiilne vaheühend reagendi ja katalüsaatori vahel. Aktiveeritud adsorptsiooni etapp määrab katalüsaatorite toime eripära erinevate reaktsioonide suhtes. Kui reaktiivi keemiline side adsorbentiga on liiga tugev, on toodete moodustumise keerulise kujunemise hävitamine raskem. Kui adsorbendi ja adsorbaadi vaheline side on liiga nõrk, looduse lähedal füüsilisele adsorptsioonile, siis ei ole adsorbaadi molekuli võlakirjade lahtiühendamist, mis toob kaasa katalüütilise protsessi aktiveerimise energia vähenemise võrreldes mitte - katalüütiline.
Üldine keemiline tehnoloogia, Kutepov A.M., Moskva, Kõrgkool, 1990, lk 206-207, 214, 205
Katalüüs(Kreeka κατάλυσις läheb tagasi καταλύειν - hävitamine) - valikuline kiirendus ühe võimaliku termodünaamiliselt lubatud keemilise reaktsiooni abil katalüsaatori (te) toimimise all, mis korduvalt siseneb vahepealse keemilise suhtlusega reaktsioonis osalejatega ja Taastab selle keemilise koostise pärast iga vahepealsete keemiliste interaktsioonide tsüklit. Termin "katalüüs" võeti kasutusele 1835. aastal Rootsi teadlane Jöns Jakob Berzelius. Lämmastikhape jne). Enamik kõigist tööstuslikest reaktsioonidest on katalüütiline. Juhtum, kui katalüsaator on üks reaktsioonialaseid tooteid või selle lähteaineid nimetatakse autokatalüüsiks. Katalüsaator muudab reaktsioonimehhanismi energiliselt soodsamaks, st vähendab aktiveerimise energiat. Katalüsaator moodustab ühe reagendi molekuliga vaheühendi, milles keemilised sidemed on nõrgenenud. See hõlbustab selle reaktsiooni teise reagendiga. Oluline on märkida, et katalüsaatorid kiirendavad pöörduvaid reaktsioone nii edasi- kui ka tagasisuunas. Seetõttu ei nihuta need keemilist tasakaalu [
Katalüüsi kasutamine tööstuses
hüdrogeenimine[redigeeri | muuda wiki teksti]
Suur hulk katalüütilisi reaktsioone on seotud vesinikuaatomi ja mõne muu molekuli aktiveerimisega, mis viib nende keemilise vastasmõjuni. Seda protsessi nimetatakse hüdrogeenimiseks ja see on paljude nafta rafineerimise ja kivisöest vedelkütuste tootmise etappide aluseks (Bergiuse protsess). Lennukibensiini ja mootorikütuse tootmine kivisöest töötati välja Saksamaal Teise maailmasõja ajal, kuna selles riigis puuduvad naftaväljad. Bergiuse protsess on vesiniku otsene lisamine süsinikule. Kivisüsi kuumutatakse rõhu all vesiniku juuresolekul ja saadakse vedel toode, mis seejärel töödeldakse lennukibensiiniks ja mootorikütuseks. Katalüsaatorina kasutatakse raudoksiidi, aga ka tina ja molübdeeni baasil katalüsaatoreid. Sõja ajal saadi 12 Saksamaa tehases Bergiuse protsessi abil ligikaudu 1400 tonni vedelkütust päevas. Teine protsess, Fischer – Tropsch, koosneb kahest etapist. Esiteks gaasistatakse kivisüsi, see tähendab, et see reageerib veeauru ja hapnikuga ning saadakse vesiniku ja süsinikoksiidide segu. See segu muundatakse vedelaks kütuseks, kasutades rauda või koobaltit sisaldavaid katalüsaatoreid. Sõja lõppedes lõpetati Saksamaal sünteetilise kütuse tootmine söest. Naftaembargole 1973-1974 järgnenud naftahinna tõusu tulemusena tehti jõulisi jõupingutusi majanduslikult tasuva meetodi väljatöötamiseks kivisöest bensiini tootmiseks. Seega saab kivisöe otsest veeldamist tõhusamalt läbi viia kaheetapilise protsessi abil, mille käigus kivisüsi viiakse esmalt kontakti alumiiniumoksiidi-koobalt-molübdeeni katalüsaatoriga suhteliselt madalal ja seejärel kõrgemal temperatuuril. Sellise sünteetilise bensiini maksumus on kõrgem kui naftast saadav bensiin.
happeline katalüüs[redigeeri | muuda wiki teksti]
Suure klassi katalüsaatorite katalüütiline aktiivsus tuleneb nende happelistest omadustest. J. Bronstedi ja T. Lowry järgi on hape ühend, mis on võimeline prootonit loovutama. Tugevad happed loovutavad oma prootonid kergesti alustele. Happesuse kontseptsiooni arendas edasi G. Lewise töödes, kes defineeris hapet kui ainet, mis on võimeline vastu võtma doonoraine elektronpaari, moodustades selle elektronipaari sotsialiseerumise tõttu kovalentse sideme. Need ideed koos ideedega karbeniumioone moodustavate reaktsioonide kohta aitasid mõista erinevate katalüütiliste reaktsioonide, eriti süsivesinike reaktsioonide mehhanismi.
Vastavalt mõjule reaktsioonikiirusele jaguneb katalüüs positiivseks (reaktsioonikiirus suureneb) ja negatiivseks (reaktsioonikiirus väheneb). Viimasel juhul toimub inhibeerimisprotsess, mida ei saa pidada "negatiivseks katalüüsiks", kuna inhibiitor kulub reaktsiooni käigus ära.
Katalüüs toimub homogeenne ja heterogeenne(kontakt). Homogeenses katalüüsis on katalüsaator reaktiividega samas faasis, heterogeensed katalüsaatorid erinevad faasi poolest.
homogeenne katalüüs[redigeeri | muuda wiki teksti]
Homogeense katalüüsi näide on vesinikperoksiidi lagunemine joodiioonide juuresolekul. Reaktsioon toimub kahes etapis:
H 2 O 2 + I → H 2 O + IO
H 2 O 2 + IO → H 2 O + O 2 + I
Homogeenses katalüüsis on katalüsaatori toime tingitud sellest, et see interakteerub reagentidega, moodustades vaheühendeid, mis viib aktiveerimisenergia vähenemiseni.
heterogeenne katalüüs[redigeeri | muuda wiki teksti]
Heterogeenses katalüüsis toimub protsessi kiirendus tavaliselt tahke keha – katalüsaatori – pinnal, seega oleneb katalüsaatori aktiivsus selle pinna suurusest ja omadustest. Praktikas kantakse katalüsaator tavaliselt tahkele poorsele kandjale.
Heterogeense katalüüsi mehhanism on keerulisem kui homogeense katalüüsi mehhanism. Heterogeense katalüüsi mehhanism sisaldab viit etappi, mis kõik on pöörduvad.
1. Reaktiivide difusioon tahke aine pinnale
2. Reageerivate molekulide füüsiline adsorptsioon tahke aine pinna aktiivsetele kohtadele ja seejärel nende kemisorptsioon
3. Reageerivate molekulide vaheline keemiline reaktsioon
4. Toodete desorptsioon katalüsaatori pinnalt
5. Toote difusioon katalüsaatori pinnalt üldvoolu
Heterogeense katalüüsi näiteks on SO 2 oksüdeerimine SO 3-ks V 2 O 5 katalüsaatoril väävelhappe tootmisel (kontaktmeetod).
Reaktsiooni kulgu katalüsaatori pinnale saab demonstreerida eksperimendis, kus plaatina plaat kuumutatakse gaasipõleti leekis, siis leek on kustutatud ja põleti joak plaat, samal ajal kui plaat muutub taas kuumaks - metalli pinnal toimub metaani oksüdatsioon.
Katalüüs on keemias üks levinumaid meetodeid keemiliste reaktsioonide kiirendamiseks.
katalüüs nimetatakse keemiliste reaktsioonide kiiruse selektiivseks muutuseks ainete (katalüsaatorite) juuresolekul, mis vaheprotsessides osaledes regenereeruvad reaktsiooni käigus ja ei kuulu lõppsaaduste hulka.
positiivne katalüüs, või lihtsalt katalüüs, - see on reaktsiooni kiiruse märkimisväärne suurenemine, näiteks väävelhappe tootmine või ammoniaagi oksüdatsioon plaatina juuresolekul. negatiivne katalüüs, või inhibeerimine, - see on reaktsiooni aeglustumine, näiteks naatriumsulfiti lahuse interaktsioon atmosfäärihapnikuga etüülalkoholi juuresolekul või vesinikperoksiidi lagunemine väävelhappe madalal kontsentratsioonil (inhibiitorid vastavalt etüülalkohol ja väävelhape) .
Katalüsaatorite toimel toimuvaid reaktsioone nimetatakse katalüütilisteks.
Katalüsaatori toime keemilise süsteemi muutmise protsessis võib olla mitte ainult kiirendades, aga ka suunav: kui esialgne keemiline süsteem saab antud tingimustes areneda mitmes termodünaamiliselt võimalikus suunas, kiirendab katalüsaator valdavalt ühte neist.
Katalüüs muudab reaktsioonimehhanismi. Moodustub katalüsaator ja üks lähteainetest aktiveeritud kompleks- vaheühend, mis reageerib teise lähteainega, moodustades reaktsioonisaadusi ja regenereerides katalüsaatormolekule.
Olgu mõnel reaktsioonil A + B = AB väga kõrge aktivatsioonienergia E a ja seetõttu jätkake aeglaselt. Selle energiadiagramm on näidatud joonisel fig. 4.4, a.
Riis. 4.4. Entalpia muutus reaktsiooni ajal: a - ilma katalüsaatorita: b- katalüsaatoriga
Kui see reaktsioon viiakse läbi katalüsaatori K juuresolekul (joonis 4.4, b), siis tekib keemiline interaktsioon ühe lähteainega (näiteks A), mille tulemusena aktiveeritud aku kaudu kompleks *, tekib reaktsioonil A + K = AK ebastabiilne keemiline ühend AK. Selle protsessi aktiveerimisenergia E" vähem kui katalüsaatori puudumisel (E a "seetõttu kulgeb reaktsioon kiiresti. Lisaks interakteerub vaheühend AK läbi teise aktiveeritud kompleksi AVK * teise lähteainega B: AK + B \u003d AB + K; sel juhul naaseb katalüsaator oma algolekus.Selle protsessi aktivatsioonienergia on samuti väike (E "mis paneb selle kulgema suurel kiirusel. Mõlema järjestikku toimuva protsessi summeerimisel saadakse kiire reaktsiooni lõppvõrrand: A + B (+ K) \u003d AB (+ K). Katalüsaator on näidatud selles võrrandis ainult selle taastekke fakti rõhutamiseks.
Kõigile katalüsaatoritele on omane see, et nad muudavad alati aktiveerimisenergiat, vähendades seda positiivse katalüüsiga, st. energiabarjääri kõrguse langetamine. Katalüsaatori juuresolekul moodustub aktiveeritud kompleks, mille energiatase on madalam kui ilma selleta, mille tulemusena suureneb reaktsioonikiirus oluliselt.
Faasitunnuse järgi eristatakse homogeenset (homogeenset) ja heterogeenset (ebaühtlast) katalüüsi; ensümaatilist katalüüsi vaadeldakse eraldi.
Kell homogeenne katalüüs katalüsaator ja reagendid moodustavad ühe faasi (gaas või lahus), milles puuduvad liidesed (faasipiirid). Gaas- ja vedelfaasilised katalüütilised protsessid on väga arvukad. Homogeense katalüüsi näide gaasifaasis on vääveloksiidi (IV) katalüütiline oksüdeerimine väävelhappe tootmise kambrimeetodis. Vääveldioksiidi oksüdeerimine trioksiidiks vastavalt reaktsioonile:
voolab aeglaselt. NO katalüsaatori kasutuselevõtt muudab reaktsioonimehhanismi: 
ja vähendab aktiveerimisenergiat ning suurendab seetõttu reaktsiooni kiirust.
Homogeense katalüüsi korral on keemilise reaktsiooni kiirus võrdeline katalüsaatori kontsentratsiooniga. Homogeense katalüüsi puudusteks lahustes on piiratud temperatuurivahemik ja mõnel juhul ka raskused katalüsaatori eraldamisel reaktsioonisaadustest.
Kell heterogeenne katalüüs katalüsaator (tavaliselt tahke aine) on süsteemis iseseisva faasina, st. katalüsaatori ja reaktiivide (gaaside või vedelike) vahel on liides. Seega toimub ammoniaagi (gaasiline faas) oksüdatsioon plaatina (tahke faas) juuresolekul ja vesinikperoksiidi (vedel faas) lagunemist kiirendab kivisöe või mangaan (IV) oksiid, mis esineb tahke faas:
Heterogeenses katalüüsis kulgevad kõik reaktsioonid faasipiiril, st. katalüsaatori pinnal, mille aktiivsus sõltub selle pinna omadustest - pindala suurusest, keemilisest koostisest, struktuuri ja oleku defektidest. Protsesside kineetika tunnused määratakse difusiooni ja adsorptsiooni abil.
Katalüsaatori (adsorbendi) pind on füüsikaliselt ebahomogeenne ja sellel on nn aktiivsed keskused, millel katalüütilised reaktsioonid toimuvad peamiselt reagentide (adsorbaatide) adsorptsiooni tõttu nendel tsentritel ja nende kontsentratsiooni suurenemise tõttu katalüsaatori pinnal. See kiirendab osaliselt reaktsiooni. Reaktsioonikiiruse suurenemise peamiseks põhjuseks on aga adsorbeerunud molekulide keemilise aktiivsuse märkimisväärne tõus, mille puhul aatomitevahelised sidemed nõrgenevad katalüsaatori toimel, mis muudab need molekulid reaktiivsemaks. Reaktsiooni kiirenemine toimub sel juhul ka aktivatsioonienergia vähenemise tulemusena, millele annab oma osa ka pindmiste vaheühendite teke.
Tahket katalüsaatorit mürgitavad ained, st. selle tegevuse vähendamist või täielikku hävitamist nimetatakse katalüütilised mürgid. Näiteks arseeni, elavhõbeda, plii, tsüaniidide ühendid mürgitavad plaatinakatalüsaatoreid, mis tuleb sel juhul tootmistingimustes regenereerida.
Ained, mis võimendavad antud reaktsiooni katalüsaatorite toimet, kuid ei ole ise katalüsaatorid, nimetatakse promootorid. Näiteks on teada plaatina katalüsaatorite propageerimine raua, alumiiniumi jne lisanditega.
Tegevuse selektiivsus (selektiivsus). Katalüsaatorite kasutamine väljendub eelkõige selles, et erinevate katalüsaatorite abil on võimalik saada samast ainest erinevaid tooteid. Niisiis, katalüsaatori Al 2 O e juuresolekul 300 ° C juures saadakse etüülalkoholist vesi ja etüleen:

Kui aga samal temperatuuril kasutatakse katalüsaatorina vasepulbrit, laguneb etüülalkohol vesinikuks ja atseetaldehüüdiks:
Seega on iga reaktsiooni jaoks katalüsaator.
Bioloogiliste katalüsaatorite osalusel ensüümid taime- ja loomaorganismides toimuvad keerulised keemilised protsessid. Näiteks sisaldab sülg ensüümi ptüaliini, mis katalüüsib tärklise muutumist suhkruks, ja maomahlas sisalduv pepsiin soodustab valkude lagunemist. Inimese kehas on umbes 3000 erinevat ensüümi, millest igaüks on vastava reaktsiooni tõhus katalüsaator.
Paljud katalüsaatorid, eriti ensüümid, on puhtalt individuaalne katalüütiline toime, mistõttu neid nimetatakse individuaalselt spetsiifiline.