Aplikácia prúdu v kvapalinách. Elektrický prúd v kvapalinách: jeho pôvod, kvantitatívne a kvalitatívne charakteristiky. elektrický prúd v roztoku. elektrolytov
Každý pozná definíciu elektrického prúdu. Je reprezentovaný ako riadený pohyb nabitých častíc. Takýto pohyb v rôznych prostrediach má zásadné rozdiely. Ako základný príklad tohto javu si možno predstaviť prúdenie a šírenie elektrického prúdu v kvapalinách. Takéto javy sa vyznačujú rôznymi vlastnosťami a výrazne sa líšia od usporiadaného pohybu nabitých častíc, ku ktorému dochádza za normálnych podmienok, nie pod vplyvom rôznych kvapalín.
Obrázok 1. Elektrický prúd v kvapalinách. Author24 - online výmena študentských prác
Vznik elektrického prúdu v kvapalinách
Napriek tomu, že proces vedenia elektrického prúdu sa uskutočňuje pomocou kovových zariadení (vodičov), prúd v kvapalinách závisí od pohybu nabitých iónov, ktoré z nejakého konkrétneho dôvodu získali alebo stratili takéto atómy a molekuly. Indikátorom takéhoto pohybu je zmena vlastností určitej látky, kadiaľ prechádzajú ióny. Preto je potrebné vychádzať zo základnej definície elektrického prúdu, aby sa vytvoril špecifický koncept vzniku prúdu v rôznych kvapalinách. Zistilo sa, že rozklad záporne nabitých iónov prispieva k pohybu do oblasti zdroja prúdu s kladnými hodnotami. Pozitívne nabité ióny sa v takýchto procesoch budú pohybovať opačným smerom - k zdroju záporného prúdu.
Kvapalné vodiče sú rozdelené do troch hlavných typov:
- polovodiče;
- dielektrika;
- vodičov.
Definícia 1
Elektrolytická disociácia je proces rozkladu molekúl určitého roztoku na záporne a kladne nabité ióny.
Je možné konštatovať, že elektrický prúd v kvapalinách môže nastať po zmene zloženia a chemických vlastností použitých kvapalín. To úplne odporuje teórii šírenia elektrického prúdu inými spôsobmi pri použití klasického kovového vodiča.
Faradayove experimenty a elektrolýza
Tok elektrického prúdu v kvapalinách je výsledkom pohybu nabitých iónov. Problémy spojené so vznikom a šírením elektrického prúdu v kvapalinách viedli k štúdiu známeho vedca Michaela Faradaya. S pomocou mnohých praktických štúdií sa mu podarilo nájsť dôkazy, že hmotnosť látky uvoľnenej počas elektrolýzy závisí od množstva času a elektriny. V tomto prípade je dôležitý čas, počas ktorého sa experimenty vykonávali.
Vedcovi sa tiež podarilo zistiť, že v procese elektrolýzy, keď sa uvoľní určité množstvo látky, je potrebné rovnaké množstvo elektrických nábojov. Toto množstvo bolo presne stanovené a zafixované v konštantnej hodnote, ktorá sa nazývala Faradayovo číslo.
V kvapalinách má elektrický prúd rôzne podmienky šírenia. Interaguje s molekulami vody. Výrazne bránia všetkým pohybom iónov, čo nebolo pozorované pri experimentoch s konvenčným kovovým vodičom. Z toho vyplýva, že tvorba prúdu pri elektrolytických reakciách nebude taká veľká. So zvyšujúcou sa teplotou roztoku sa však vodivosť postupne zvyšuje. To znamená, že napätie elektrického prúdu sa zvyšuje. Tiež v procese elektrolýzy bolo pozorované, že pravdepodobnosť rozkladu určitej molekuly na záporné alebo kladné iónové náboje sa zvyšuje v dôsledku veľkého počtu molekúl použitej látky alebo rozpúšťadla. Keď je roztok nasýtený iónmi nad určitú normu, dochádza k opačnému procesu. Vodivosť roztoku začne opäť klesať.
V súčasnosti proces elektrolýzy našiel svoje uplatnenie v mnohých oblastiach a oblastiach vedy a vo výrobe. Priemyselné podniky ho využívajú pri výrobe alebo spracovaní kovu. Elektrochemické reakcie sa podieľajú na:
- elektrolýza soli;
- galvanické pokovovanie;
- leštenie povrchu;
- iné redoxné procesy.
Elektrický prúd vo vákuu a kvapalinách
Šírenie elektrického prúdu v kvapalinách a iných médiách je pomerne zložitý proces, ktorý má svoje vlastné charakteristiky, vlastnosti a vlastnosti. Faktom je, že v takýchto médiách nie sú v telách úplne žiadne náboje, preto sa zvyčajne nazývajú dielektriká. Hlavným cieľom výskumu bolo vytvoriť také podmienky, za ktorých by sa atómy a molekuly mohli začať pohybovať a začať proces generovania elektrického prúdu. Na tento účel je obvyklé používať špeciálne mechanizmy alebo zariadenia. Hlavným prvkom takýchto modulárnych zariadení sú vodiče vo forme kovových dosiek.
Na určenie hlavných parametrov prúdu je potrebné použiť známe teórie a vzorce. Najbežnejší je Ohmov zákon. Pôsobí ako univerzálna ampérová charakteristika, kde je implementovaný princíp závislosti prúdu a napätia. Pripomeňme, že napätie sa meria v ampéroch.
Na pokusy s vodou a soľou je potrebné pripraviť nádobu so slanou vodou. To poskytne praktické a vizuálne znázornenie procesov, ktoré sa vyskytujú, keď sa v kvapalinách vytvára elektrický prúd. Inštalácia by tiež mala obsahovať obdĺžnikové elektródy a napájacie zdroje. Pre plnohodnotnú prípravu na experimenty musíte mať ampérovú inštaláciu. Pomôže to viesť energiu z napájacieho zdroja do elektród.
Kovové dosky budú pôsobiť ako vodiče. Ponoria sa do použitej kvapaliny a potom sa pripojí napätie. Pohyb častíc začína okamžite. Beží náhodne. Keď medzi vodičmi vznikne magnetické pole, celý proces pohybu častíc je usporiadaný.
Ióny začnú meniť náboje a zlučovať sa. Katódy sa tak stávajú anódami a anódy katódami. V tomto procese je potrebné zvážiť aj niekoľko ďalších dôležitých faktorov:
- úroveň disociácie;
- teplota;
- elektrický odpor;
- použitie striedavého alebo jednosmerného prúdu.
Na konci experimentu sa na tanieroch vytvorí vrstva soli.
Medzi kvapaliny, ktoré sú vodičmi, patria taveniny a roztoky elektrolytov, t.j. soli, kyseliny a zásady.
Keď sa elektrolyty rozpustia vo vode, ich molekuly sa rozložia na ióny – elektrolytická disociácia. Stupeň disociácie, t.j. frakcia molekúl v rozpustenej látke, ktoré sa rozložili na ióny, závisí od teploty, koncentrácie roztoku a elektrických vlastností rozpúšťadla. So zvyšujúcou sa teplotou sa zvyšuje stupeň disociácie a následne sa zvyšuje koncentrácia kladne a záporne nabitých iónov. Ióny rôznych znakov sa pri stretnutí môžu opäť spojiť do neutrálnych molekúl. Tento proces sa nazýva rekombinácia. Za konštantných podmienok sa v roztoku vytvorí dynamická rovnováha, pri ktorej sa počet molekúl, ktoré sa rozpadajú na ióny za sekundu, rovná počtu párov iónov, ktoré sa za rovnaký čas rekombinujú na neutrálne molekuly.
Voľnými nosičmi náboja vo vodivých kvapalinách sú teda kladné a záporné ióny. Ak sú elektródy pripojené k zdroju prúdu umiestnené v kvapaline, tieto ióny sa začnú pohybovať. Jedna z elektród je pripojená k zápornému pólu zdroja prúdu - nazýva sa katóda - druhá je pripojená k kladnému pólu - anóde. Po pripojení k zdroju prúdu sa ióny v roztoku elektrolytu, záporné ióny začnú pohybovať smerom ku kladnej elektróde (anóda) a kladné ióny smerom k zápornej (katóde). To znamená, že sa vytvorí elektrický prúd. Takáto vodivosť v kvapalinách sa nazýva iónová, pretože ióny sú nosičmi náboja.
Keď prúd prechádza cez roztok elektrolytu na elektródach, uvoľňuje sa látka spojená s redoxnými reakciami. Na anóde záporne nabité ióny darujú svoje elektróny navyše (oxidačná reakcia) a na katóde kladné ióny prijímajú chýbajúce elektróny (redukčná reakcia). Tento proces sa nazýva elektrolýza.
Pri elektrolýze sa na elektródach uvoľňuje látka. Závislosť hmotnosti uvoľnenej látky m od sily prúdu, času prechodu prúdu a samotnej látky stanovil M. Faraday. Tento zákon možno získať teoreticky. Hmotnosť uvoľnenej látky sa teda rovná súčinu hmotnosti jedného iónu m i počtu iónov N i, ktoré dosiahli elektródu za čas Dt. Hmotnosť iónu sa podľa vzorca pre množstvo látky rovná m i \u003d M / N a, kde M je molárna hmotnosť látky, Na je Avogadrova konštanta. Počet iónov, ktoré dosiahli elektródu je N i =Dq/qi, kde Dq je náboj, ktorý prešiel elektrolytom za čas Dt (Dq=I*Dt), qi je náboj iónu, ktorý je určený valenciou atómu (qi = n*e, kde n je valencia atómu, e je elementárny náboj). Dosadením týchto vzorcov dostaneme, že m=M/(neN a)*IDt. Ak označíme k (faktor proporcionality) =M/(neN a), potom máme m=kIDt. Toto je matematický zápis prvého Faradayovho zákona, jedného zo zákonov elektrolýzy. Hmotnosť látky uvoľnenej na elektróde za čas Dt pri prechode elektrického prúdu je úmerná sile prúdu a tomuto časovému intervalu. Hodnota k sa nazýva elektrochemický ekvivalent danej látky, ktorý sa číselne rovná hmotnosti látky uvoľnenej na elektródach pri prenose náboja 1 C iónmi. [k] = 1 kg/C. k = M/(neN a) = 1/F*M/n, kde F je Faradayova konštanta. F \u003d eN a \u003d 9,65 * 104 C / mol. Odvodený vzorec k=(1/F)*(M/n) je druhý Faradayov zákon.
Elektrolýza je široko používaná v strojárstve na rôzne účely, napríklad povrch jedného kovu je pokrytý tenkou vrstvou iného kovu (niklovanie, chrómovanie, pokovovanie medi atď.). Ak je zabezpečené dobré odlupovanie elektrolytického povlaku z povrchu, je možné získať kópiu topografie povrchu. Tento proces sa nazýva galvanické pokovovanie. Tiež pomocou elektrolýzy sa kovy čistia od nečistôt, napríklad hrubé pláty nerafinovanej medi získanej z rudy sa umiestnia do kúpeľa ako anóda. Pri elektrolýze sa meď rozpúšťa, nečistoty padajú na dno a na katóde sa usadzuje čistá meď. Pomocou elektrolýzy sa získavajú aj dosky elektronických obvodov. Na dielektrikum sa nalepí tenký zložitý vzor spojovacích drôtov, potom sa doštička vloží do elektrolytu, kde sa odleptajú nepokryté miesta medenej vrstvy. Potom sa farba umyje a na doske sa objavia detaily mikroobvodu.
Kvapaliny, podobne ako pevné látky, môžu byť vodičmi, polovodičmi a dielektrikami. V tejto lekcii sa zameriame na kvapalné vodiče. A nie o kvapalinách s elektronickou vodivosťou (roztavené kovy), ale o kvapalných vodičoch druhého druhu (roztoky a taveniny solí, kyselín, zásad). Typ vodivosti takýchto vodičov je iónový.
Definícia. Vodiče druhého druhu sú vodiče, v ktorých dochádza k chemickým procesom, keď preteká prúd.
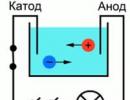
Pre lepšie pochopenie procesu vedenia prúdu v kvapalinách možno uviesť nasledujúci experiment: Dve elektródy pripojené k zdroju prúdu boli umiestnené vo vani s vodou, ako indikátor prúdu v obvode možno použiť žiarovku. Ak takýto okruh zatvoríte, lampa nebude horieť, čo znamená, že nie je žiadny prúd, čo znamená, že okruh je prerušený a samotná voda nevedie prúd. Ale ak dáte do kúpeľne určité množstvo soli a zopakujete okruh, svetlo sa rozsvieti. To znamená, že v kúpeli medzi katódou a anódou sa začali pohybovať voľné nosiče náboja, v tomto prípade ióny (obr. 1).

Ryža. 1. Schéma skúseností
Vodivosť elektrolytov
Odkiaľ pochádzajú bezplatné poplatky v druhom prípade? Ako bolo uvedené v jednej z predchádzajúcich lekcií, niektoré dielektrika sú polárne. Voda má rovnaké polárne molekuly (obr. 2).

Ryža. 2. Polarita molekuly vody
Keď sa do vody pridá soľ, molekuly vody sú orientované tak, že ich záporné póly sú blízko sodíka, kladné - blízko chlóru. V dôsledku interakcií medzi nábojmi molekuly vody rozbijú molekuly soli na páry opačných iónov. Sodíkový ión má kladný náboj, chlórový ión záporný náboj (obr. 3). Práve tieto ióny sa budú pohybovať medzi elektródami pôsobením elektrického poľa.

Ryža. 3. Schéma vzniku voľných iónov
Keď sa sodné ióny priblížia ku katóde, dostane svoje chýbajúce elektróny, zatiaľ čo chloridové ióny sa vzdajú svojich, keď dosiahnu anódu.
Elektrolýza
Keďže tok prúdu v kvapalinách je spojený s prenosom hmoty, pri takomto prúde prebieha proces elektrolýzy.
Definícia. Elektrolýza je proces spojený s redoxnými reakciami, pri ktorých sa na elektródach uvoľňuje látka.
Látky, ktoré v dôsledku takéhoto štiepenia poskytujú iónovú vodivosť, sa nazývajú elektrolyty. Tento názov navrhol anglický fyzik Michael Faraday (obr. 4).
Elektrolýza umožňuje získavať látky v dostatočne čistej forme z roztokov, preto sa využíva na získavanie vzácnych materiálov, ako je sodík, vápnik ... v čistej forme. Toto je to, čo je známe ako elektrolytická metalurgia.
Faradayove zákony
V prvej práci o elektrolýze v roku 1833 predstavil Faraday svoje dva zákony elektrolýzy. V prvom išlo o hmotnosť látky uvoľnenej na elektródach:
Prvý Faradayov zákon hovorí, že táto hmotnosť je úmerná náboju, ktorý prešiel elektrolytom:
Tu zohráva úlohu koeficientu úmernosti množstvo - elektrochemický ekvivalent. Ide o tabuľkovú hodnotu, ktorá je jedinečná pre každý elektrolyt a je jeho hlavnou charakteristikou. Rozmer elektrochemického ekvivalentu:
![]()
Fyzikálny význam elektrochemického ekvivalentu je hmotnosť uvoľnená na elektróde, keď množstvo elektriny v 1 C prejde elektrolytom.
Ak si spomínate na vzorce z témy jednosmerný prúd:
Potom môžeme znázorniť prvý Faradayov zákon vo forme:
Druhý Faradayov zákon sa priamo týka merania elektrochemického ekvivalentu prostredníctvom iných konštánt pre konkrétny elektrolyt:
Tu: je molárna hmotnosť elektrolytu; - elementárny náboj; - valencia elektrolytu; je Avogadrove číslo.
Hodnota sa nazýva chemický ekvivalent elektrolytu. To znamená, že na to, aby sme poznali elektrochemický ekvivalent, stačí poznať chemický ekvivalent, zvyšné zložky vzorca sú svetové konštanty.
Na základe druhého Faradayovho zákona môže byť prvý zákon reprezentovaný ako:
![]()
Faraday navrhol terminológiu týchto iónov na základe elektródy, ku ktorej sa pohybujú. Pozitívne ióny sa nazývajú katióny, pretože sa pohybujú smerom k záporne nabitej katóde, záporné náboje sa nazývajú anióny, keď sa pohybujú smerom k anóde.
Vyššie uvedené pôsobenie vody na rozbitie molekuly na dva ióny sa nazýva elektrolytická disociácia.
Okrem roztokov môžu byť taveniny aj vodičmi druhého druhu. V tomto prípade je prítomnosť voľných iónov dosiahnutá tým, že veľmi aktívne molekulárne pohyby a vibrácie začínajú pri vysokej teplote, v dôsledku čoho sa molekuly rozpadajú na ióny.
Praktická aplikácia elektrolýzy
Prvá praktická aplikácia elektrolýzy sa objavila v roku 1838 ruským vedcom Jacobim. Pomocou elektrolýzy získal dojem postáv pre Katedrálu svätého Izáka. Táto aplikácia elektrolýzy sa nazýva galvanické pokovovanie. Ďalšou oblasťou použitia je galvanické pokovovanie - pokrývanie jedného kovu druhým (chrómovanie, niklovanie, pozlátenie atď., Obr. 5)
- Fatyf.narod.ru ().
- ChemiK ().
- Ens.tpu.ru ().
Domáca úloha
- Čo sú elektrolyty?
- Aké sú dva zásadne odlišné typy kvapalín, v ktorých môže prúdiť elektrický prúd?
- Aké sú možné mechanizmy tvorby voľných nosičov náboja?
- *Prečo je hmotnosť uvoľnená na elektróde úmerná náboju?
« Fyzika - 10. ročník
Aké sú nosiče elektrického prúdu vo vákuu?
Aký je charakter ich pohybu?
Kvapaliny, podobne ako pevné látky, môžu byť dielektriká, vodiče a polovodiče. Dielektriká zahŕňajú destilovanú vodu, vodiče - roztoky a taveniny elektrolytov: kyseliny, zásady a soli. Kvapalné polovodiče sú roztavený selén, sulfidové taveniny atď.
elektrolytická disociácia.
Keď sa elektrolyty rozpustia pod vplyvom elektrického poľa molekúl polárnej vody, molekuly elektrolytu sa rozložia na ióny.
Rozpad molekúl na ióny vplyvom elektrického poľa molekúl polárnej vody sa nazýva tzv elektrolytická disociácia.
Stupeň disociácie- podiel molekúl v rozpustenej látke, ktoré sa rozpadli na ióny.
Stupeň disociácie závisí od teploty, koncentrácie roztoku a elektrických vlastností rozpúšťadla.
So zvyšujúcou sa teplotou sa zvyšuje stupeň disociácie a následne sa zvyšuje koncentrácia kladne a záporne nabitých iónov.
Ióny rôznych znakov sa pri stretnutí môžu opäť spojiť do neutrálnych molekúl.
Za konštantných podmienok sa v roztoku vytvorí dynamická rovnováha, pri ktorej sa počet molekúl, ktoré sa rozpadajú na ióny za sekundu, rovná počtu párov iónov, ktoré sa za rovnaký čas rekombinujú na neutrálne molekuly.
Iónové vedenie.
Nosiče náboja vo vodných roztokoch alebo taveninách elektrolytov sú kladne a záporne nabité ióny.
Ak je v elektrickom obvode zahrnutá nádoba s roztokom elektrolytu, negatívne ióny sa začnú pohybovať smerom k pozitívnej elektróde - anóde a pozitívne - smerom k negatívnej - katóde. V dôsledku toho bude obvodom pretekať elektrický prúd.
Vodivosť vodných roztokov alebo tavenín elektrolytov, ktorú vykonávajú ióny, sa nazýva iónová vodivosť.
Elektrolýza. Pri iónovej vodivosti je prechod prúdu spojený s prenosom hmoty. Na elektródach sa uvoľňujú látky, ktoré tvoria elektrolyty. Na anóde záporné ióny darujú svoje elektróny navyše (v chémii sa to nazýva oxidačná reakcia) a na katóde kladné ióny dostávajú chýbajúce elektróny (redukčná reakcia).
Kvapaliny môžu mať aj elektronickú vodivosť. Takúto vodivosť majú napríklad tekuté kovy.
Proces uvoľňovania látky na elektróde, spojený s redoxnými reakciami, sa nazýva elektrolýza.
Čo určuje hmotnosť látky uvoľnenej za daný čas? Je zrejmé, že hmotnosť m uvoľnenej látky sa rovná súčinu hmotnosti m 0i jedného iónu počtom N i iónov, ktoré dosiahli elektródu za čas Δt:
m = m0i Ni. (16.3)
Hmotnosť iónu m 0i je:
kde M je molárna (alebo atómová) hmotnosť látky a N A je Avogadrova konštanta, t.j. počet iónov v jednom mole.
Počet iónov dosahujúcich elektródu je
kde Δq = IΔt je náboj, ktorý prešiel cez elektrolyt počas času Δt; q 0i je náboj iónu, ktorý je určený valenciou n atómu: q 0i \u003d ne (e je elementárny náboj). Pri disociácii molekúl, napríklad KBr, pozostávajúceho z jednomocných atómov (n = 1), vznikajú ióny K + a Br -. Disociácia molekúl síranu meďnatého vedie k vzniku dvakrát nabitých iónov Cu 2+ a SO 2- 4 (n = 2). Dosadením výrazov (16.4) a (16.5) do vzorca (16.3) a berúc do úvahy, že Δq = IΔt, a q 0i = ne, dostaneme
Faradayov zákon.
Označme k súčiniteľ úmernosti medzi hmotnosťou m látky a nábojom Δq = IΔt prechádzajúcim elektrolytom:
kde F \u003d eN A \u003d 9,65 10 4 C / mol - Faradayova konštanta.
Koeficient k závisí od povahy látky (hodnoty M a n). Podľa vzorca (16.6) máme
m = kIΔt. (16.8)
Faradayov zákon elektrolýzy:
Hmotnosť látky uvoľnenej na elektróde za čas Δt. pri prechode elektrického prúdu, je úmerná sile prúdu a času.
Toto tvrdenie získané teoreticky prvýkrát experimentálne stanovil Faraday.
Hodnota k vo vzorci (16.8) sa nazýva elektrochemický ekvivalent danú látku a vyjadrenú v kilogramov na prívesok(kg/C).
Zo vzorca (16.8) je vidieť, že koeficient k sa číselne rovná hmotnosti látky uvoľnenej na elektródach pri prenose náboja 1 C iónmi.

Elektrochemický ekvivalent má jednoduchý fyzikálny význam. Pretože M / N A \u003d m 0i a en \u003d q 0i, potom podľa vzorca (16.7) k \u003d rn 0i / q 0i, t.j. k je pomer hmotnosti iónu k jeho náboju.
Meraním hodnôt m a Δq je možné určiť elektrochemické ekvivalenty rôznych látok.
Platnosť Faradayovho zákona si overíte skúsenosťou. Zostavme inštaláciu znázornenú na obrázku (16.25). Všetky tri elektrolytické kúpele sú naplnené rovnakým roztokom elektrolytu, ale prúdy prechádzajúce cez ne sú odlišné. Označme silu prúdov cez I1, I2, I3. Potom I 1 = I 2 + I 3 . Meraním hmotností m 1 , m 2 , m 3 látok uvoľnených na elektródach v rôznych kúpeľoch sa môžeme uistiť, že sú úmerné zodpovedajúcim prúdom I 1 , I 2, I 3 .
Stanovenie náboja elektrónu.
Na určenie náboja elektrónu možno použiť vzorec (16.6) pre hmotnosť látky uvoľnenej na elektróde. Z tohto vzorca vyplýva, že modul náboja elektrónov sa rovná:
Pri znalosti hmotnosti m uvoľnenej látky pri prechode náboja IΔt, molárnej hmotnosti M, valencii n atómov a Avogadrovej konštante N A je možné zistiť hodnotu modulu náboja elektrónu. Ukazuje sa, že sa rovná e = 1,6 10 -19 C.
Týmto spôsobom bola v roku 1874 prvýkrát získaná hodnota elementárneho elektrického náboja.
Aplikácia elektrolýzy. Elektrolýza je široko používaná v strojárstve na rôzne účely. Elektrolyticky pokryť povrch jedného kovu tenkou vrstvou iného ( niklovanie, chrómovanie, zlatenie atď.). Tento odolný náter chráni povrch pred koróziou. Ak je zabezpečené dobré odlupovanie elektrolytického povlaku z povrchu, na ktorom je nanesený kov (to sa dosiahne napríklad nanesením grafitu na povrch), potom je možné získať kópiu z povrchu reliéfu.
Proces získavania odlupovateľných povlakov - elektrotyp- vyvinul ruský vedec B. S. Jacobi (1801-1874), ktorý v roku 1836 použil túto metódu na výrobu dutých figúrok pre Katedrálu svätého Izáka v Petrohrade.
Predtým sa v polygrafickom priemysle získavali kópie z reliéfneho povrchu (stereotypy) z matríc (odtlačok súpravy na plastovom materiáli), na čo sa na matrice nanášala hrubá vrstva železa alebo inej látky. To umožnilo rozmnožiť súpravu v požadovanom počte kópií.
Elektrolýza odstraňuje nečistoty z kovov. Surová meď získaná z rudy sa teda odlieva vo forme hrubých plechov, ktoré sa potom vkladajú do kúpeľa ako anódy. Pri elektrolýze sa anódová meď rozpúšťa, na dno padajú nečistoty obsahujúce cenné a vzácne kovy a na katóde sa usadzuje čistá meď.
Hliník sa získava z roztaveného bauxitu elektrolýzou. Práve tento spôsob získavania hliníka ho urobil lacným a spolu so železom najrozšírenejším v technike a každodennom živote.
Pomocou elektrolýzy sa získavajú dosky elektronických obvodov, ktoré slúžia ako základ všetkých elektronických produktov. Na dielektrikum je nalepená tenká medená doska, na ktorú je nanesený zložitý vzor spojovacích drôtov so špeciálnou farbou. Potom sa platňa vloží do elektrolytu, kde sa oblasti medenej vrstvy, ktoré nie sú pokryté farbou, vyleptajú. Potom sa farba umyje a na doske sa objavia detaily mikroobvodu.
Elektrický prúd v kvapalinách je spôsobený pohybom kladných a záporných iónov. Na rozdiel od prúdu vo vodičoch, kde sa pohybujú elektróny. Ak teda v kvapaline nie sú žiadne ióny, potom ide o dielektrikum, napríklad destilovanú vodu. Keďže nosičmi náboja sú ióny, teda molekuly a atómy látky, pri prechode elektrického prúdu cez takúto kvapalinu to nevyhnutne povedie k zmene chemických vlastností látky.
Odkiaľ pochádzajú kladné a záporné ióny v kvapaline? Povedzme hneď, že nosiče náboja nie sú schopné tvoriť vo všetkých kvapalinách. Tie, v ktorých sa objavujú, sa nazývajú elektrolyty. Patria sem roztoky solí kyselín a zásad. Pri rozpúšťaní soli vo vode si vezmite napríklad kuchynskú soľ NaCl, pôsobením rozpúšťadla, teda vody, sa rozkladá na kladný ión Na nazývaný katión a záporný ión Cl nazývaný anión. Proces tvorby iónov sa nazýva elektrolytická disociácia.
Urobme experiment, na to potrebujeme sklenenú žiarovku, dve kovové elektródy, ampérmeter a zdroj jednosmerného prúdu. Banku naplníme roztokom kuchynskej soli vo vode. Potom do tohto roztoku vložíme dve obdĺžnikové elektródy. Elektródy pripájame k zdroju jednosmerného prúdu cez ampérmeter.
Obrázok 1 - Banka so soľným roztokom
Keď sa medzi platňami zapne prúd, objaví sa elektrické pole, pri ktorom sa ióny soli začnú pohybovať. Kladné ióny sa ponáhľajú na katódu a záporné ióny na anódu. Zároveň budú robiť chaotický pohyb. No zároveň pod pôsobením poľa k nemu pribudne aj objednané.
Na rozdiel od vodičov, v ktorých sa pohybujú iba elektróny, teda jeden typ náboja, sa v elektrolytoch pohybujú dva typy nábojov. Sú to kladné a záporné ióny. Pohybujú sa smerom k sebe.
Keď kladný sodíkový ión dosiahne katódu, získa chýbajúci elektrón a stane sa atómom sodíka. Podobný proces nastane s iónom chlóru. Až po dosiahnutí anódy sa ión chlóru vzdá elektrónu a zmení sa na atóm chlóru. Vo vonkajšom obvode sa teda udržiava prúd v dôsledku pohybu elektrónov. A zdá sa, že ióny v elektrolyte prenášajú elektróny z jedného pólu na druhý.
Elektrický odpor elektrolytov závisí od množstva vytvorených iónov. V silných elektrolytoch je úroveň disociácie pri rozpustení veľmi vysoká. Slabé sú nízke. Elektrický odpor elektrolytu je tiež ovplyvnený teplotou. S jeho nárastom klesá viskozita kvapaliny a ťažké a nemotorné ióny sa začínajú pohybovať rýchlejšie. V súlade s tým sa odpor znižuje.
Ak sa soľný roztok nahradí roztokom síranu meďnatého. Potom, keď ním prechádza prúd, keď katión medi dosiahne katódu a tam prijme chýbajúce elektróny, obnoví sa na atóm medi. A ak potom elektródu odstránite, nájdete na nej usadeniny medi. Tento proces sa nazýva elektrolýza.