Application du courant dans les liquides. Courant électrique dans les liquides : son origine, ses caractéristiques quantitatives et qualitatives. courant électrique en solution. électrolytes
Tout le monde connaît la définition du courant électrique. Il est représenté comme un mouvement dirigé de particules chargées. Un tel mouvement dans différents environnements présente des différences fondamentales. Comme exemple de base de ce phénomène, on peut imaginer la circulation et la propagation du courant électrique dans les liquides. De tels phénomènes sont caractérisés par des propriétés différentes et sont très différents du mouvement ordonné des particules chargées, qui se produit dans des conditions normales non sous l'influence de divers liquides.
Figure 1. Courant électrique dans les liquides. Author24 - échange en ligne de travaux d'étudiants
Formation de courant électrique dans les liquides
Malgré le fait que le processus de conduction du courant électrique est effectué au moyen de dispositifs métalliques (conducteurs), le courant dans les liquides dépend du mouvement des ions chargés qui ont acquis ou perdu ces atomes et molécules pour une raison spécifique. Un indicateur d'un tel mouvement est un changement dans les propriétés d'une certaine substance, où les ions passent. Ainsi, il est nécessaire de s'appuyer sur la définition de base du courant électrique afin de former un concept spécifique de la formation de courant dans divers liquides. Il est déterminé que la décomposition des ions chargés négativement contribue au mouvement vers la région de la source de courant avec des valeurs positives. Les ions chargés positivement dans de tels processus se déplaceront dans la direction opposée - vers une source de courant négative.
Les conducteurs liquides sont divisés en trois types principaux :
- semi-conducteurs;
- diélectriques;
- conducteurs.
Définition 1
La dissociation électrolytique est le processus de décomposition des molécules d'une certaine solution en ions chargés négatifs et positifs.
On peut établir qu'un courant électrique dans les liquides peut se produire après une modification de la composition et des propriétés chimiques des liquides utilisés. Cela contredit complètement la théorie de la propagation du courant électrique par d'autres moyens lors de l'utilisation d'un conducteur métallique conventionnel.
Les expériences de Faraday et l'électrolyse
Le flux de courant électrique dans les liquides est un produit du mouvement des ions chargés. Les problèmes liés à l'émergence et à la propagation du courant électrique dans les liquides ont conduit à l'étude du célèbre scientifique Michael Faraday. À l'aide de nombreuses études pratiques, il a pu trouver des preuves que la masse d'une substance libérée lors de l'électrolyse dépend de la quantité de temps et d'électricité. Dans ce cas, le temps pendant lequel les expériences ont été réalisées est important.
Le scientifique a également pu découvrir que dans le processus d'électrolyse, lorsqu'une certaine quantité d'une substance est libérée, la même quantité de charges électriques est nécessaire. Cette quantité a été établie avec précision et fixée dans une valeur constante, qui s'appelait le nombre de Faraday.
Dans les liquides, le courant électrique a des conditions de propagation différentes. Il interagit avec les molécules d'eau. Ils entravent de manière significative tout mouvement des ions, ce qui n'a pas été observé dans les expériences utilisant un conducteur métallique classique. Il s'ensuit que la génération de courant lors des réactions électrolytiques ne sera pas si importante. Cependant, à mesure que la température de la solution augmente, la conductivité augmente progressivement. Cela signifie que la tension du courant électrique augmente. Toujours dans le processus d'électrolyse, il a été observé que la probabilité qu'une molécule particulière se décompose en charges ioniques négatives ou positives augmente en raison du grand nombre de molécules de la substance ou du solvant utilisé. Lorsque la solution est saturée d'ions dépassant une certaine norme, le processus inverse se produit. La conductivité de la solution recommence à diminuer.
Actuellement, le procédé d'électrolyse a trouvé son application dans de nombreux domaines et domaines de la science et de la production. Les entreprises industrielles l'utilisent dans la production ou la transformation du métal. Les réactions électrochimiques sont impliquées dans :
- électrolyse du sel;
- galvanoplastie;
- polissage de surface;
- autres processus redox.
Courant électrique dans le vide et les liquides
La propagation du courant électrique dans les liquides et autres milieux est un processus assez complexe qui a ses propres caractéristiques, caractéristiques et propriétés. Le fait est que dans de tels milieux, il n'y a absolument aucune charge dans les corps, ils sont donc généralement appelés diélectriques. L'objectif principal de la recherche était de créer des conditions dans lesquelles les atomes et les molécules pourraient commencer à se déplacer et le processus de génération d'un courant électrique a commencé. Pour cela, il est d'usage d'utiliser des mécanismes ou dispositifs spéciaux. L'élément principal de ces dispositifs modulaires sont des conducteurs sous la forme de plaques métalliques.
Pour déterminer les principaux paramètres du courant, il est nécessaire d'utiliser des théories et des formules connues. La plus courante est la loi d'Ohm. Il agit comme une caractéristique d'ampère universelle, où le principe de dépendance courant-tension est mis en œuvre. Rappelez-vous que la tension est mesurée en unités d'ampères.
Pour les expériences avec de l'eau et du sel, il est nécessaire de préparer un récipient avec de l'eau salée. Cela donnera une représentation pratique et visuelle des processus qui se produisent lorsqu'un courant électrique est généré dans des liquides. De plus, l'installation doit contenir des électrodes rectangulaires et des alimentations électriques. Pour une préparation à grande échelle pour des expériences, vous devez disposer d'une installation d'ampères. Cela aidera à conduire l'énergie de l'alimentation électrique aux électrodes.
Des plaques de métal serviront de conducteurs. Ils sont plongés dans le liquide utilisé, puis la tension est connectée. Le mouvement des particules commence immédiatement. Il tourne au hasard. Lorsqu'un champ magnétique apparaît entre les conducteurs, l'ensemble du processus de mouvement des particules est ordonné.
Les ions commencent à changer de charge et à se combiner. Ainsi les cathodes deviennent des anodes et les anodes deviennent des cathodes. Dans ce processus, il y a aussi plusieurs autres facteurs importants à considérer :
- niveau de dissociation ;
- Température;
- résistance électrique;
- utilisation de courant alternatif ou continu.
A la fin de l'expérience, une couche de sel se forme sur les plaques.
Les liquides conducteurs comprennent les produits fondus et les solutions électrolytiques, c'est-à-dire sels, acides et alcalis.
Lorsque les électrolytes se dissolvent dans l'eau, leurs molécules se décomposent en ions - dissociation électrolytique. Le degré de dissociation, c'est-à-dire la proportion de molécules dans le soluté qui se sont décomposées en ions dépend de la température, de la concentration de la solution et des propriétés électriques du solvant. Avec l'augmentation de la température, le degré de dissociation augmente et, par conséquent, la concentration d'ions chargés positivement et négativement augmente. Des ions de signes différents, lorsqu'ils se rencontrent, peuvent à nouveau s'unir en molécules neutres. Ce processus est appelé recombinaison. Dans des conditions constantes, un équilibre dynamique est établi dans la solution, auquel le nombre de molécules qui se désintègrent en ions par seconde est égal au nombre de paires d'ions qui se recombinent en molécules neutres en même temps.
Ainsi, les porteurs de charge libres dans les liquides conducteurs sont des ions positifs et négatifs. Si des électrodes connectées à une source de courant sont placées dans un liquide, ces ions commenceront à se déplacer. L'une des électrodes est reliée au pôle négatif de la source de courant - on l'appelle la cathode - l'autre est reliée au positif - l'anode. Lorsqu'ils sont connectés à une source de courant, les ions dans une solution d'électrolyte, les ions négatifs commencent à se déplacer vers l'électrode positive (anode) et les ions positifs, respectivement, vers le négatif (cathode). C'est-à-dire qu'un courant électrique est établi. Une telle conductivité dans les liquides est appelée ionique, car les ions sont des porteurs de charge.
Lorsque le courant traverse la solution d'électrolyte sur les électrodes, une substance est libérée associée à des réactions redox. A l'anode, les ions chargés négativement donnent leurs électrons supplémentaires (réaction d'oxydation), et à la cathode, les ions positifs acceptent les électrons manquants (réaction de réduction). Ce processus est appelé électrolyse.
Lors de l'électrolyse, une substance est libérée au niveau des électrodes. La dépendance de la masse de la substance libérée m de la force du courant, du temps de passage du courant et de la substance elle-même a été établie par M. Faraday. Cette loi peut être obtenue théoriquement. Ainsi, la masse de la substance libérée est égale au produit de la masse d'un ion m i par le nombre d'ions N i ayant atteint l'électrode pendant le temps Dt. La masse d'un ion, selon la formule de la quantité d'une substance, est égale à m i \u003d M / N a, où M est la masse molaire de la substance, N a est la constante d'Avogadro. Le nombre d'ions qui ont atteint l'électrode est N i =Dq/qi, où Dq est la charge qui a traversé l'électrolyte pendant le temps Dt (Dq=I*Dt), qi est la charge de l'ion, qui est déterminée par la valence de l'atome (qi = n*e, où n est la valence de l'atome, e est la charge élémentaire). En substituant ces formules, on obtient que m=M/(neN a)*IDt. Si on note k (facteur de proportionnalité) =M/(neN a), alors on a m=kIDt. Il s'agit d'une notation mathématique de la première loi de Faraday, l'une des lois de l'électrolyse. La masse de substance libérée sur l'électrode pendant le temps Dt lors du passage d'un courant électrique est proportionnelle à l'intensité du courant et à cet intervalle de temps. La valeur de k est appelée l'équivalent électrochimique d'une substance donnée, qui est numériquement égale à la masse de la substance libérée sur les électrodes lors du transfert d'une charge de 1 C par des ions. [k]= 1 kg/C. k = M/(neN a) = 1/F*M/n , où F est la constante de Faraday. F \u003d eN a \u003d 9,65 * 10 4 C / mol. La formule dérivée k=(1/F)*(M/n) est la deuxième loi de Faraday.
L'électrolyse est largement utilisée en ingénierie à diverses fins, par exemple, la surface d'un métal est recouverte d'une fine couche d'un autre (nickelage, chromage, cuivrage, etc.). Si un bon décollement du revêtement électrolytique de la surface est assuré, une copie de la topographie de surface peut être obtenue. Ce processus est appelé galvanoplastie. De plus, en utilisant l'électrolyse, les métaux sont purifiés des impuretés, par exemple, des feuilles épaisses de cuivre non raffiné obtenues à partir de minerai sont placées dans un bain comme anode. Pendant l'électrolyse, le cuivre se dissout, les impuretés tombent au fond et le cuivre pur se dépose sur la cathode. À l'aide de l'électrolyse, des cartes de circuits électroniques sont également obtenues. Un mince motif complexe de fils de connexion est collé sur le diélectrique, puis la plaque est placée dans l'électrolyte, où les zones non recouvertes de la couche de cuivre sont gravées. Après cela, la peinture est lavée et les détails du microcircuit apparaissent sur la carte.
Les liquides, comme les solides, peuvent être des conducteurs, des semi-conducteurs et des diélectriques. Dans cette leçon, nous nous concentrerons sur les conducteurs liquides. Et pas sur les liquides à conductivité électronique (métaux en fusion), mais sur les conducteurs liquides du second type (solutions et fondus de sels, acides, bases). Le type de conductivité de tels conducteurs est ionique.
Définition. Les conducteurs du deuxième type sont les conducteurs dans lesquels des processus chimiques se produisent lorsque le courant circule.
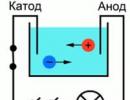
Pour une meilleure compréhension du processus de conduction du courant dans les liquides, l'expérience suivante peut être présentée : deux électrodes connectées à une source de courant ont été placées dans un bain d'eau, une ampoule peut être prise comme indicateur de courant dans le circuit. Si vous fermez un tel circuit, la lampe ne brûlera pas, ce qui signifie qu'il n'y a pas de courant, ce qui signifie qu'il y a une coupure dans le circuit et que l'eau elle-même ne conduit pas le courant. Mais si vous mettez une certaine quantité de sel de table dans la salle de bain et répétez le circuit, la lumière s'allumera. Cela signifie que des porteurs de charge libres, dans ce cas des ions, ont commencé à se déplacer dans le bain entre la cathode et l'anode (Fig. 1).

Riz. 1. Schéma d'expérience
Conductivité des électrolytes
D'où viennent les charges gratuites dans le second cas ? Comme mentionné dans l'une des leçons précédentes, certains diélectriques sont polaires. L'eau a juste les mêmes molécules polaires (Fig. 2).

Riz. 2. Polarité de la molécule d'eau
Lorsque du sel est ajouté à l'eau, les molécules d'eau sont orientées de telle sorte que leurs pôles négatifs soient proches du sodium, positifs - proches du chlore. À la suite d'interactions entre les charges, les molécules d'eau cassent les molécules de sel en paires d'ions opposés. L'ion sodium a une charge positive, l'ion chlore a une charge négative (Fig. 3). Ce sont ces ions qui vont se déplacer entre les électrodes sous l'action d'un champ électrique.

Riz. 3. Schéma de formation des ions libres
Lorsque les ions sodium s'approchent de la cathode, elle reçoit ses électrons manquants, tandis que les ions chlorure abandonnent les leurs lorsqu'ils atteignent l'anode.
Électrolyse
Étant donné que le flux de courant dans les liquides est associé au transfert de matière, avec un tel courant, le processus d'électrolyse a lieu.
Définition. L'électrolyse est un processus associé à des réactions redox dans lequel une substance est libérée au niveau des électrodes.
Les substances qui, à la suite d'une telle division, fournissent une conductivité ionique sont appelées électrolytes. Ce nom a été proposé par le physicien anglais Michael Faraday (Fig. 4).
L'électrolyse permet d'obtenir des substances sous une forme suffisamment pure à partir de solutions, elle est donc utilisée pour obtenir des matières rares, comme le sodium, le calcium... sous sa forme pure. C'est ce qu'on appelle la métallurgie électrolytique.
Les lois de Faraday
Dans le premier ouvrage sur l'électrolyse en 1833, Faraday présente ses deux lois de l'électrolyse. Dans le premier, il s'agissait de la masse de la substance libérée sur les électrodes :
La première loi de Faraday stipule que cette masse est proportionnelle à la charge passée à travers l'électrolyte :
Ici, le rôle du coefficient de proportionnalité est joué par la quantité - l'équivalent électrochimique. Il s'agit d'une valeur tabulaire unique pour chaque électrolyte et qui en est la principale caractéristique. Dimension de l'équivalent électrochimique :
![]()
La signification physique de l'équivalent électrochimique est la masse libérée sur l'électrode lorsque la quantité d'électricité en 1 C traverse l'électrolyte.
Si vous vous souvenez des formules du sujet du courant continu :
On peut alors représenter la première loi de Faraday sous la forme :
La deuxième loi de Faraday concerne directement la mesure de l'équivalent électrochimique à travers d'autres constantes pour un électrolyte particulier :
Ici : est la masse molaire de l'électrolyte ; - redevance élémentaire ; - valence électrolytique ; est le numéro d'Avogadro.
La valeur est appelée l'équivalent chimique de l'électrolyte. Autrement dit, pour connaître l'équivalent électrochimique, il suffit de connaître l'équivalent chimique, les composants restants de la formule sont des constantes mondiales.
Basée sur la deuxième loi de Faraday, la première loi peut être représentée comme suit :
![]()
Faraday a proposé la terminologie de ces ions sur la base de l'électrode vers laquelle ils se déplacent. Les ions positifs sont appelés cations car ils se déplacent vers la cathode chargée négativement, les charges négatives sont appelées anions lorsqu'ils se déplacent vers l'anode.
L'action ci-dessus de l'eau pour briser une molécule en deux ions est appelée dissociation électrolytique.
En plus des solutions, les masses fondues peuvent également être des conducteurs du second type. Dans ce cas, la présence d'ions libres est obtenue par le fait que des mouvements moléculaires très actifs et des vibrations commencent à haute température, à la suite de quoi les molécules se décomposent en ions.
Application pratique de l'électrolyse
La première application pratique de l'électrolyse a eu lieu en 1838 par le scientifique russe Jacobi. Avec l'aide de l'électrolyse, il a reçu une impression de personnages pour la cathédrale Saint-Isaac. Cette application de l'électrolyse est appelée galvanoplastie. Un autre domaine d'application est la galvanoplastie - recouvrant un métal avec un autre (chromage, nickelage, dorure, etc., Fig. 5)
- Fatyf.narod.ru ().
- ChemiK ().
- Ens.tpu.ru ().
Devoirs
- Que sont les électrolytes ?
- Quels sont les deux types de liquides fondamentalement différents dans lesquels un courant électrique peut circuler ?
- Quels sont les mécanismes possibles de formation de porteurs de charge gratuits ?
- *Pourquoi la masse libérée sur l'électrode est-elle proportionnelle à la charge ?
« Physique - 10e année "
Quels sont les porteurs de courant électrique dans le vide ?
Quelle est la nature de leur mouvement ?
Les liquides, comme les solides, peuvent être des diélectriques, des conducteurs et des semi-conducteurs. Les diélectriques comprennent l'eau distillée, les conducteurs - les solutions et les électrolytes fondus : acides, alcalis et sels. Les semi-conducteurs liquides sont le sélénium fondu, les sulfures fondus, etc.
dissociation électrolytique.
Lorsque les électrolytes sont dissous sous l'influence du champ électrique des molécules d'eau polaires, les molécules d'électrolyte se décomposent en ions.
La désintégration des molécules en ions sous l'influence du champ électrique des molécules d'eau polaires est appelée dissociation électrolytique.
Degré de dissociation- la proportion de molécules dans la substance dissoute qui se sont désintégrées en ions.
Le degré de dissociation dépend de la température, de la concentration de la solution et des propriétés électriques du solvant.
Avec l'augmentation de la température, le degré de dissociation augmente et, par conséquent, la concentration d'ions chargés positivement et négativement augmente.
Des ions de signes différents, lorsqu'ils se rencontrent, peuvent à nouveau s'unir en molécules neutres.
Dans des conditions constantes, un équilibre dynamique est établi dans la solution, auquel le nombre de molécules qui se désintègrent en ions par seconde est égal au nombre de paires d'ions qui se recombinent en molécules neutres en même temps.
Conduction ionique.
Les porteurs de charge dans les solutions aqueuses ou les électrolytes fondus sont des ions chargés positivement et négativement.
Si un récipient contenant une solution d'électrolyte est inclus dans un circuit électrique, les ions négatifs commenceront à se déplacer vers l'électrode positive - l'anode, et positifs - vers la cathode négative. En conséquence, un courant électrique circulera dans le circuit.
La conductivité des solutions aqueuses ou des électrolytes fondus, qui est réalisée par des ions, est appelée conductivité ionique.
Électrolyse. Avec la conductivité ionique, le passage du courant est associé au transfert de matière. Sur les électrodes, des substances qui composent les électrolytes sont libérées. A l'anode, les ions négatifs cèdent leurs électrons supplémentaires (en chimie, on appelle cela une réaction oxydative), et à la cathode, les ions positifs reçoivent les électrons manquants (réaction de réduction).
Les liquides peuvent également avoir une conductivité électronique. Une telle conductivité est possédée, par exemple, par les métaux liquides.
Le processus de libération d'une substance à l'électrode, associé à des réactions redox, est appelé électrolyse.
Qu'est-ce qui détermine la masse d'une substance rejetée dans un temps donné ? Évidemment, la masse m de la substance libérée est égale au produit de la masse m 0i d'un ion par le nombre N i d'ions ayant atteint l'électrode pendant le temps Δt :
m = m 0i N je . (16.3)
La masse ionique m 0i est :
où M est la masse molaire (ou atomique) de la substance, et N A est la constante d'Avogadro, c'est-à-dire le nombre d'ions dans une mole.
Le nombre d'ions atteignant l'électrode est
où Δq = IΔt est la charge passée à travers l'électrolyte pendant le temps Δt ; q 0i est la charge de l'ion, qui est déterminée par la valence n de l'atome: q 0i \u003d ne (e est la charge élémentaire). Lors de la dissociation de molécules, par exemple KBr, constituées d'atomes monovalents (n = 1), des ions K + et Br - apparaissent. La dissociation des molécules de sulfate de cuivre conduit à l'apparition d'ions Cu 2+ et SO 2- 4 doublement chargés (n = 2). En remplaçant les expressions (16.4) et (16.5) dans la formule (16.3) et en tenant compte du fait que Δq = IΔt, a q 0i = ne, on obtient
Loi de Faraday.
Notons k le coefficient de proportionnalité entre la masse m de la substance et la charge Δq = IΔt traversant l'électrolyte :
où F \u003d eN A \u003d 9,65 10 4 C / mol - Constante de Faraday.
Le coefficient k dépend de la nature de la substance (les valeurs de M et n). D'après la formule (16.6) on a
m = kIΔt. (16.8)
Loi de Faraday sur l'électrolyse :
La masse de la substance libérée sur l'électrode pendant le temps Δt. lors du passage du courant électrique, est proportionnelle à l'intensité du courant et au temps.
Cette affirmation, obtenue théoriquement, a d'abord été établie expérimentalement par Faraday.
La valeur k dans la formule (16.8) est appelée équivalent électrochimique substance donnée et exprimée en kilogrammes par pendentif(kg/C).
D'après la formule (16.8), on peut voir que le coefficient k est numériquement égal à la masse de la substance libérée sur les électrodes lors du transfert d'une charge de 1 C par des ions.

L'équivalent électrochimique a une signification physique simple. Puisque M / N A \u003d m 0i et en \u003d q 0i, alors selon la formule (16.7) k \u003d rn 0i / q 0i, c'est-à-dire k est le rapport de la masse de l'ion à sa charge.
En mesurant les valeurs de m et Δq, on peut déterminer les équivalents électrochimiques de diverses substances.
Vous pouvez vérifier la validité de la loi de Faraday par expérience. Assemblons l'installation illustrée à la figure (16.25). Les trois bains électrolytiques sont remplis de la même solution d'électrolyte, mais les courants qui les traversent sont différents. Désignons la force des courants à travers I1, I2, I3. Alors je 1 = je 2 + je 3 . En mesurant les masses m 1 , m 2 , m 3 des substances libérées sur les électrodes dans différents bains, on peut s'assurer qu'elles sont proportionnelles aux courants correspondants I 1 , I 2 , I 3 .
Détermination de la charge électronique.
La formule (16.6) pour la masse de la substance libérée sur l'électrode peut être utilisée pour déterminer la charge électronique. De cette formule, il résulte que le module de charge électronique est égal à :
Connaissant la masse m de la substance libérée lors du passage de la charge IΔt, la masse molaire M, la valence de n atomes et la constante d'Avogadro N A, on peut trouver la valeur du module de charge électronique. Il s'avère être égal à e = 1,6 10 -19 C.
C'est ainsi que la valeur de la charge électrique élémentaire fut obtenue pour la première fois en 1874.
Application de l'électrolyse. L'électrolyse est largement utilisée en ingénierie à diverses fins. Couvrir électrolytiquement la surface d'un métal avec une fine couche d'un autre ( nickelage, chromage, dorure etc.). Ce revêtement durable protège la surface de la corrosion. Si un bon pelage du revêtement électrolytique est assuré à partir de la surface sur laquelle le métal est déposé (ceci est obtenu, par exemple, en appliquant du graphite sur la surface), alors une copie peut être obtenue à partir de la surface en relief.
Le processus d'obtention de revêtements pelables - galvanotype- a été développé par le scientifique russe B. S. Jacobi (1801-1874), qui en 1836 a appliqué cette méthode pour fabriquer des figures creuses pour la cathédrale Saint-Isaac à Saint-Pétersbourg.
Auparavant, dans l'industrie de l'imprimerie, des copies à partir d'une surface en relief (stéréotypes) étaient obtenues à partir de matrices (empreinte d'un ensemble sur une matière plastique), pour lesquelles une couche épaisse de fer ou d'une autre substance était déposée sur les matrices. Cela a permis de reproduire l'ensemble dans le nombre d'exemplaires requis.
L'électrolyse élimine les impuretés des métaux. Ainsi, le cuivre brut obtenu à partir du minerai est coulé sous forme de tôles épaisses, qui sont ensuite placées dans un bain comme anodes. Au cours de l'électrolyse, le cuivre de l'anode se dissout, les impuretés contenant des métaux précieux et rares tombent au fond et le cuivre pur se dépose sur la cathode.
L'aluminium est obtenu à partir de bauxite fondue par électrolyse. C'est cette méthode d'obtention de l'aluminium qui le rendait bon marché et, avec le fer, le plus courant dans la technologie et la vie quotidienne.
À l'aide de l'électrolyse, des cartes de circuits électroniques sont obtenues, qui servent de base à tous les produits électroniques. Une fine plaque de cuivre est collée sur le diélectrique, sur laquelle un motif complexe de fils de connexion est appliqué avec une peinture spéciale. Ensuite, la plaque est placée dans un électrolyte, où les zones de la couche de cuivre qui ne sont pas recouvertes de peinture sont gravées. Après cela, la peinture est lavée et les détails du microcircuit apparaissent sur la carte.
Le courant électrique dans les liquides est causé par le mouvement des ions positifs et négatifs. Contrairement au courant dans les conducteurs où les électrons se déplacent. Ainsi, s'il n'y a pas d'ions dans un liquide, il s'agit alors d'un diélectrique, par exemple de l'eau distillée. Étant donné que les porteurs de charge sont des ions, c'est-à-dire des molécules et des atomes d'une substance, lorsqu'un courant électrique traverse un tel liquide, cela entraînera inévitablement une modification des propriétés chimiques de la substance.
D'où viennent les ions positifs et négatifs dans un liquide ? Disons tout de suite que les porteurs de charge ne sont pas capables de se former dans tous les liquides. Ceux dans lesquels ils apparaissent sont appelés électrolytes. Ceux-ci comprennent des solutions de sels d'acides et d'alcalis. Lorsque vous dissolvez du sel dans de l'eau, par exemple, prenez du sel de table NaCl, il se décompose sous l'action d'un solvant, c'est-à-dire l'eau en un ion positif N / A appelé un cation et un ion négatif CL appelé anion. Le processus de formation des ions est appelé dissociation électrolytique.
Menons une expérience, pour cela nous avons besoin d'une ampoule en verre, de deux électrodes métalliques, d'un ampèremètre et d'une source de courant continu. Nous remplissons le ballon avec une solution de sel commun dans l'eau. Ensuite, nous mettons deux électrodes rectangulaires dans cette solution. Nous connectons les électrodes à une source de courant continu via un ampèremètre.
Figure 1 - Flacon de solution saline
Lorsque le courant est allumé entre les plaques, un champ électrique apparaîtra sous l'action duquel les ions de sel commenceront à se déplacer. Les ions positifs se précipiteront vers la cathode et les ions négatifs vers l'anode. En même temps, ils feront un mouvement chaotique. Mais en même temps, sous l'action du champ, un ordonné s'y ajoutera également.
Contrairement aux conducteurs dans lesquels seuls les électrons se déplacent, c'est-à-dire un type de charge, deux types de charges se déplacent dans les électrolytes. Ce sont des ions positifs et négatifs. Ils avancent l'un vers l'autre.
Lorsque l'ion sodium positif atteint la cathode, il gagne l'électron manquant et devient un atome de sodium. Un processus similaire se produira avec l'ion chlore. Ce n'est qu'en atteignant l'anode que l'ion chlore cèdera un électron et se transformera en atome de chlore. Ainsi, le courant est maintenu dans le circuit externe en raison du mouvement des électrons. Et dans l'électrolyte, les ions semblent transporter des électrons d'un pôle à l'autre.
La résistance électrique des électrolytes dépend de la quantité d'ions formés. Dans les électrolytes forts, le niveau de dissociation est très élevé lorsqu'il est dissous. Les faibles sont faibles. De plus, la résistance électrique de l'électrolyte est affectée par la température. Avec son augmentation, la viscosité du liquide diminue et les ions lourds et maladroits commencent à se déplacer plus rapidement. En conséquence, la résistance diminue.
Si la solution saline est remplacée par une solution de sulfate de cuivre. Ensuite, lorsqu'un courant le traverse, lorsque le cation de cuivre atteint la cathode et y reçoit les électrons manquants, il sera restitué à un atome de cuivre. Et si après cela, vous retirez l'électrode, vous pouvez trouver des dépôts de cuivre dessus. Ce processus est appelé électrolyse.