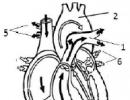
Μέθοδοι διαχωρισμού μειγμάτων. Παρασκευή μιγμάτων και μέθοδοι διαχωρισμού τους Η διαδικασία διαχωρισμού υγρών μιγμάτων
Στόχοι μαθήματος:
Εκπαιδευτικό - Δημιουργία συνθηκών για γνωριμία με την έννοια των ομοιογενών και ανομοιογενών μειγμάτων, μιας καθαρής ουσίας που έχει σταθερές ιδιότητες, δείχνουν τη διαφορά της από τα μείγματα. Δείξτε την ποικιλία των μεθόδων για τον διαχωρισμό των μειγμάτων.
Εκπαιδευτικό - Δημιουργία συνθηκών για τη διαμόρφωση ενδιαφέροντος για γνώσεις, δεξιότητες, επαρκή αξιολόγηση των δραστηριοτήτων τους. Να συνεχιστεί η περιβαλλοντική εκπαίδευση, ο σεβασμός στο περιβάλλον.
Ανάπτυξη - Δημιουργία συνθηκών για τη συνέχιση του σχηματισμού των δεξιοτήτων των μαθητών να συντάσσουν τύπους ανόργανων ουσιών με το όνομα και να ονομάζουν ουσίες με τύπους. Συνέχιση της ανάπτυξης των δεξιοτήτων των μαθητών να αναγνωρίζουν κατηγορίες ανόργανων ενώσεων με τύπους. ανάπτυξη της ικανότητας αναγνώρισης καθαρών ουσιών και μιγμάτων ουσιών· σχηματισμός της ικανότητας κατάρτισης σχεδίου δράσης για τον διαχωρισμό μειγμάτων ουσιών· σχηματισμός της ικανότητας διαχωρισμού μιγμάτων με καθίζηση, φιλτράρισμα, χρήση μαγνήτη, εξάτμιση.
Στόχοι για τον μαθητή:
- να γνωρίζουν την έννοια της καθαρής ουσίας
– να γνωρίζουν τις έννοιες των ετερογενών και ομοιογενών μειγμάτων
– γνωρίζει τις μεθόδους διαχωρισμού των μειγμάτων: καθίζηση, διήθηση, εξάτμιση, απόσταξη
Γνωρίστε τις σύγχρονες μεθόδους επεξεργασίας νερού
Να μπορεί να διαχωρίζει τα μείγματα με καθίζηση, φιλτράρισμα, χρήση μαγνήτη, εξάτμιση
Κατά τη διάρκεια των μαθημάτων
1. Οργανωτική στιγμή
(οργάνωση έναρξης μαθήματος)
Χαιρετισμός, δημιουργία ευνοϊκού συναισθηματικού υπόβαθρου, έλεγχος των παρόντων, έλεγχος ετοιμότητας για το μάθημα.
2. Έλεγχος της εργασίας (έλεγχος της εργασίας)
§ 1
Εργασίες 7–10
§ 4
3. Καθορισμός στόχων, κίνητρο (μήνυμα του θέματος, στόχοι μαθήματος)
Θέμα μαθήματος: Καθαρές ουσίες και μείγματα. Μέθοδοι διαχωρισμού μειγμάτων.
Τι πιστεύετε, τι στόχους μπορούμε να θέσουμε για το σημερινό μάθημα;
(Στόχοι για τον μαθητή)
Ξέρουμε πολύ καλά τι είναι αγνότητα. Καθαρό δωμάτιο, καθαρό σημειωματάριο, καθαρά ρούχα... Και τι σημαίνει η έννοια της καθαρής ουσίας; Ποια είναι η διαφορά μεταξύ μιας καθαρής ουσίας και ενός μείγματος ουσιών;
4. Πραγματοποίηση βασικών γνώσεων και δεξιοτήτων
Ας μάθουμε τις ερωτήσεις: Τι ονομάζεται ουσία; (Η ύλη είναι από τι αποτελούνται τα φυσικά σώματα)
5. Εκμάθηση νέου υλικού (απόκτηση νέων γνώσεων και μεθόδων δράσης)
καθαρή ουσία.
Το απεσταγμένο και το θαλασσινό νερό θερμάνθηκαν μέχρι βρασμού σε δύο δοχεία. Μετά από ορισμένο χρόνο, μετρήθηκαν τα σημεία βρασμού σε αυτά τα δοχεία). Οι μαθητές συζητούν τα αποτελέσματα του πειράματος. Από μόνο του, προκύπτει το ερώτημα-πρόβλημα, το οποίο εκφράζεται από τον δάσκαλο, «Γιατί t μπάλες θαλασσινού νερού δεν είναι σταθερό σε διαφορετικά διαστήματα, σε σύγκριση με t μπάλες απεσταγμένου νερού». Οι μαθητές καταλήγουν στο συμπέρασμα ότι η αλατότητα του θαλασσινού νερού επηρεάζει το δέμα Με τη βοήθεια ενός δασκάλου διατυπώνεται ένας ορισμός «Καθαρή ουσία είναι μια ουσία που έχει σταθερές φυσικές ιδιότητες (σημεία βρασμού, σημεία τήξης, πυκνότητα).
Μείγματα και ταξινόμηση τους
Ο δάσκαλος καλεί τους μαθητές να εξετάσουν τα μείγματα στον πίνακα επίδειξης. Στη συνέχεια, τα παιδιά ορίζουν ένα μείγμα ως συνδυασμό πολλών από τις ουσίες τους που βρίσκονται σε άμεση επαφή μεταξύ τους. Ο δάσκαλος προσθέτει ότι δεν υπάρχουν απολύτως καθαρές ουσίες στη φύση. Οι ουσίες εμφανίζονται κυρίως με τη μορφή μειγμάτων. Μιλάει για τον αέρα ως μείγμα που αποτελείται από αέρια - άζωτο, οξυγόνο, αργό κ.λπ. Ατμοσφαιρική ρύπανση: Οι αλλαγές στην περιεκτικότητα του αέρα σε θείο και διοξείδιο του θείου οδηγούν σε κιτρίνισμα ή αποχρωματισμό των φύλλων των δέντρων και σε νανισμό. Στους ανθρώπους, αυτό το αέριο ερεθίζει την ανώτερη αναπνευστική οδό. Η αύξηση της περιεκτικότητας σε μονοξείδιο του άνθρακα στον αέρα οδηγεί σε μείωση της ικανότητας της αιμοσφαιρίνης των ερυθροκυττάρων να μεταφέρει οξυγόνο, λόγω της οποίας οι αντιδράσεις επιβραδύνονται σε ένα άτομο, η αντίληψη εξασθενεί, εμφανίζεται πονοκέφαλος, υπνηλία και ναυτία. Η έκθεση σε μεγάλες ποσότητες μονοξειδίου του άνθρακα μπορεί να προκαλέσει λιποθυμία, κώμα, ακόμη και θάνατο.
Αυτό το θολό υγρό είναι ένα μείγμα νερού και κιμωλίας. Τα σωματίδια κιμωλίας στο μείγμα είναι ορατά με γυμνό μάτι. Ωστόσο, εμφανισιακά δεν είναι πάντα δυνατό να μαντέψεις ότι έχεις ένα μείγμα μπροστά σου. Για παράδειγμα, το γάλα μας φαίνεται ομοιογενές, αλλά στο μικροσκόπιο παρατηρείται ότι αποτελείται από σταγονίδια λίπους, μόρια πρωτεΐνης που επιπλέουν στο διάλυμα. Πιστεύετε ότι το νερό της βροχής είναι καθαρή ουσία; Και ο αέρας; Μπροστά σας είναι δύο ποτήρια με ένα διαυγές υγρό στο ένα - νερό, και στο άλλο - ένα διάλυμα ζάχαρης σε νερό. Τα σωματίδια ζάχαρης δεν μπορούν να φανούν όχι μόνο με γυμνό μάτι, αλλά ακόμη και με το πιο ισχυρό μικροσκόπιο. Έτσι, τα μείγματα είναι διαφορετικά. Σε ποιες δύο ομάδες μπορούν να χωριστούν τα μείγματα ανάλογα με την εμφάνισή τους; (ομογενής και ετερογενής). Συμπληρώστε το διάγραμμα στις κάρτες εργασίας. Ποια μείγματα ονομάζονται ετερογενή; (Ετερογενή μείγματα είναι εκείνα στα οποία τα σωματίδια των ουσιών που αποτελούν το μείγμα φαίνονται με γυμνό μάτι ή με μικροσκόπιο.) Ποια μείγματα μπορούν να ονομαστούν ομοιογενή; (Ομογενή μείγματα είναι εκείνα στα οποία, ακόμη και με μικροσκόπιο, είναι αδύνατο να ανιχνευθούν σωματίδια ουσιών που περιλαμβάνονται στο μείγμα.)
Ομογενή - Διαλύματα ζάχαρης σε νερό, NaCl, αέρα
Ετερογενές - Μείγμα Fe +S, NaCl και ζάχαρη, άργιλος με νερό
Πρωτοβάθμιο τεστ κατανόησης της νέας γνώσης
Παιδιά, συναντάμε συχνά καθαρές ουσίες στη φύση; (Όχι, τα μείγματα ουσιών είναι πιο συνηθισμένα).
Ο γρανίτης είναι μπροστά σας. Τι είναι ένα μείγμα ή μια καθαρή ουσία; (Μίγμα).
Πώς το μαντεψες? (Ο γρανίτης έχει κοκκώδη δομή, σωματίδια χαλαζία, μαρμαρυγία, άστριος είναι αισθητά σε αυτόν.).
Οι κύριες μέθοδοι διαχωρισμού ενός μείγματος.
Πείραμα επίδειξης "Διαχωρισμός μείγματος φυτικού ελαίου και νερού."
Εδώ είναι ένα μείγμα φυτικού ελαίου και νερού. Προσδιορίστε τον τύπο του μείγματος. (Ετερογενής). Συγκρίνετε τις φυσικές ιδιότητες του λαδιού και του νερού. (Πρόκειται για υγρές ουσίες αδιάλυτες μεταξύ τους, με διαφορετικές πυκνότητες). Προτείνετε μια μέθοδο διαχωρισμού αυτού του μείγματος. (Παιδικές προτάσεις). Αυτή η μέθοδος ονομάζεται καθίζηση. Πραγματοποιείται με τη χρήση διαχωριστικής χοάνης. Ας συμπληρώσουμε τον πίνακα στις κάρτες εργασίας «Μέθοδοι διαχωρισμού ετερογενών μιγμάτων».
Πείραμα επίδειξης «Διαχωρισμός μειγμάτων».
ετερογενές μείγμα σιδήρου και θείου. Αυτό το μείγμα μπορεί να διαχωριστεί με καθίζηση, όπως Το θείο και ο σίδηρος είναι στερεές ουσίες αδιάλυτες στο νερό. Εάν ρίξετε αυτό το μείγμα σε νερό, το θείο θα επιπλεύσει στην επιφάνεια και ο σίδηρος θα βυθιστεί. Επίσης, αυτό το μείγμα μπορεί να διαχωριστεί χρησιμοποιώντας μαγνήτη, γιατί. Ο σίδηρος έλκεται από έναν μαγνήτη, αλλά το θείο όχι.
Ένα μείγμα άμμου και νερού. Αυτό είναι ένα ανομοιογενές μείγμα. Το διαχωρίσαμε με φιλτράρισμα.
Διαφορετικοί τρόποι φιλτραρίσματος μειγμάτων
Το φιλτράρισμα μπορεί να γίνει όχι μόνο με χάρτινο φίλτρο. Άλλα χαλαρά ή πορώδη υλικά μπορούν επίσης να χρησιμοποιηθούν για φιλτράρισμα. Τα χύδην υλικά που χρησιμοποιούνται σε αυτή τη μέθοδο περιλαμβάνουν, για παράδειγμα, χαλαζιακή άμμο. Και στο πορώδες - καμένο πηλό και υαλοβάμβακα. Υπάρχει επίσης η έννοια της μεθόδου «θερμής διήθησης». Με αυτή τη μέθοδο μπορούν να διαχωριστούν μίγματα στερεών με διαφορετικά σημεία τήξης.
Διάλυμα αλατιού σε νερό. Αυτό είναι ένα ομοιογενές μείγμα. Το χωρίσαμε με εξάτμιση.
Υπάρχουν όμως ακόμα τρόποι διαχωρισμού ομοιογενών μειγμάτων. Ένα από αυτά είναι η χρωματογραφία.
Ιστορία της ανακάλυψης της χρωματογραφίας
Η χρωματογραφία ως μέθοδος διαχωρισμού ουσιών το 1903 προτάθηκε από τον Ρώσο βοτανολόγο M.S. Έγχρωμο (1872–1919). Τον ενδιέφερε το πρόβλημα αν η φυσική πράσινη βαφή χλωροφύλλη, που αποτελεί μέρος των φύλλων των φυτών, είναι μεμονωμένη ουσία ή μείγμα ουσιών; Για να το μάθει, γέμισε έναν γυάλινο σωλήνα με κιμωλία, έριξε από τη μία άκρη του διάλυμα χλωροφύλλης και τον έπλυνε με διαλύτη. Προχωρώντας κατά μήκος του σωλήνα, η χλωροφύλλη σχημάτισε πολλές ζώνες που διαφέρουν ως προς το χρώμα. Ως αποτέλεσμα, ο επιστήμονας διαπίστωσε ότι η χλωροφύλλη είναι ένα μείγμα ουσιών. Ονόμασε την προτεινόμενη μέθοδο διαχωρισμού μιγμάτων χρωματογραφία. Κυριολεκτικά σημαίνει "έγχρωμη ζωγραφική".
Ένας άλλος τρόπος διαχωρισμού ενός ομοιογενούς μείγματος είναι η απόσταξη ή η απόσταξη.
Ιστορία της απόσταξης
Απόσταξη στα λατινικά σημαίνει «στάζει». Οι παλαιότερες περιγραφές του κυκλώματος του αποστακτήρα δίνονται στο έργο για την αλχημεία της Μαρίας (πρόκειται για τον 1ο αιώνα μ.Χ.). Ο αποστακτήρας είχε ένα δοχείο, έναν σωλήνα εξόδου και έναν δέκτη που ψύχονταν με ένα υγρό σφουγγάρι. Έτσι η απόσταξη υγρών χαμηλού βρασμού σε αυτό ήταν αδύνατη. Ακόμη και αρκετοί δέκτες με σωλήνες θα μπορούσαν να συνδεθούν στο δοχείο.
7. Εμπέδωση γνώσεων, διαμόρφωση πρωταρχικών δεξιοτήτων και ικανοτήτων (επέδωση γνώσεων και μέθοδοι δράσης)
ΕΡΓΑΣΙΑ Νο 1
Δώστε παραδείγματα μιγμάτων που μπορούν να διαχωριστούν με διήθηση, καθίζηση. Καταγράψτε την απάντησή σας στον πίνακα.
ΕΡΓΑΣΙΑ #2
Ένας θρυμματισμένος φελλός μπήκε κατά λάθος στη ζάχαρη. Πώς να καθαρίσετε τη ζάχαρη από αυτό;
ΕΡΓΑΣΙΑ Νο 3
Δώστε ένα παράδειγμα μείγματος τριών ουσιών και αναφέρετε τη σειρά των ενεργειών που απαιτούνται για τον διαχωρισμό τους.
8. Γενίκευση και συστηματοποίηση της γνώσης
Έτσι, παιδιά, γνωριστήκαμε με τις κύριες μεθόδους καθαρισμού ουσιών (παραθέστε τις). Βγάλε ένα γενικό συμπέρασμα, σε τι βασίζεται πάντα ο διαχωρισμός των μειγμάτων; Διατηρούν οι ουσίες στα μείγματα τις ιδιότητές τους; Καταγράψτε στο σημειωματάριο εξόδου: στα μείγματα, οι ουσίες διατηρούν τις ατομικές τους ιδιότητες. Ο διαχωρισμός των μειγμάτων βασίζεται σε διαφορές στις φυσικές ιδιότητες των ουσιών στο μείγμα.
9. Έλεγχος και αυτοεξέταση της γνώσης
Προσδιορίστε από τον πίνακα τον εξοπλισμό που είναι απαραίτητος για τον διαχωρισμό των μειγμάτων που αναφέρονται σε αυτόν. Από τα γράμματα που αντιστοιχούν στις σωστές απαντήσεις, θα δημιουργήσετε το όνομα μιας άλλης μεθόδου για τη λήψη καθαρών ουσιών.
|
Ονομα εξοπλισμού |
Σύνθεση του μείγματος |
|||
|
ηλιέλαιο και νερό |
πηλό και νερό |
Θαλασσινό νερό |
σίδηρος και χαλκός |
|
|
χημική χοάνη |
||||
|
Διαχωριστικό χωνί |
||||
|
Ποτηρι ζεσεως |
||||
|
πνευματικός λαμπτήρας |
||||
|
Φίλτρο |
||||
|
φλιτζάνι πορσελάνης |
||||
|
Μαγνήτης |
||||
10. Συνοψίζοντας το μάθημα
Έλεγχος του γρίφου, Βαθμοί για εργασία στο μάθημα.
Δεν υπάρχουν λευκές κηλίδες στον χάρτη,
Ολόκληρη η γη είναι από καιρό ανοιχτή,
Αναμένονται όμως οι πιο γενναίοι
Πραγματικές ανακαλύψεις!
11. Αντανάκλαση
Τι καινούργιο μάθατε στο μάθημα σήμερα;
Τι θυμάσαι?
Τι σας άρεσε και τι δεν λειτούργησε κατά τη γνώμη σας;
12. Πληροφορίες σχετικά με την εργασία για το σπίτι και οδηγίες για την υλοποίησή της (κατ' οίκον εργασία, διαβούλευση με εργασίες για το σπίτι)
§ 2
Εργασίες 2, 4–6
Να γνωρίζετε τον ορισμό των εννοιών: καθαρές ουσίες, ομοιογενή και ετερογενή μείγματα. την ουσία κάθε μεθόδου διαχωρισμού μειγμάτων. Απαντήστε στις ερωτήσεις 2, 4-6. Προαιρετικά: ετοιμάστε ένα μήνυμα με θέμα «Εφαρμογή μεθόδων χημικής ανάλυσης στο έργο ιατροδικαστών, αρχαιολόγων, ιατρών, ιστορικών τέχνης» ή φτιάξτε ένα σταυρόλεξο χρησιμοποιώντας τις έννοιες του σημερινού μαθήματος και το όνομα του εξοπλισμού που απαιτείται για τον διαχωρισμό μειγμάτων.
θεωρητικό μπλοκ.
Η έννοια του «μίγματος» ορίστηκε τον 17ο αιώνα. Ο Άγγλος επιστήμονας Ρόμπερτ Μπόιλ: "Ένα μείγμα είναι ένα ολοκληρωμένο σύστημα που αποτελείται από ετερογενή συστατικά."
Συγκριτικά χαρακτηριστικά μείγματος και καθαρής ουσίας
Σημάδια σύγκρισης | καθαρή ουσία | Μίγμα |
Συνεχής | άστατος |
|
Ουσίες | Ιδιο | Διάφορος |
Φυσικές ιδιότητες | Μόνιμος | Αστατος |
Αλλαγή ενέργειας κατά τον σχηματισμό | σε εξέλιξη | Δεν συμβαίνει |
Διαχωρισμός | Μέσω χημικών αντιδράσεων | Φυσικές μέθοδοι |
Τα μείγματα διαφέρουν μεταξύ τους ως προς την εμφάνιση.
Η ταξινόμηση των μειγμάτων φαίνεται στον πίνακα:
Ακολουθούν παραδείγματα εναιωρημάτων (άμμος ποταμού + νερό), γαλακτωμάτων (φυτικό λάδι + νερό) και διαλυμάτων (αέρας σε φιάλη, αλάτι + νερό, μικρή αλλαγή: αλουμίνιο + χαλκός ή νικέλιο + χαλκός).
Μέθοδοι διαχωρισμού μειγμάτων
Στη φύση, οι ουσίες υπάρχουν με τη μορφή μειγμάτων. Για εργαστηριακή έρευνα, βιομηχανική παραγωγή, για ανάγκες φαρμακολογίας και ιατρικής χρειάζονται καθαρές ουσίες.
Για τον καθαρισμό ουσιών χρησιμοποιούνται διάφορες μέθοδοι διαχωρισμού μιγμάτων.
Εξάτμιση - ο διαχωρισμός των στερεών διαλυμένων σε ένα υγρό μετατρέποντάς το σε ατμό.

Απόσταξη-απόσταξη, διαχωρισμός ουσιών που περιέχονται σε υγρά μείγματα ανάλογα με τα σημεία βρασμού, ακολουθούμενος από ψύξη του ατμού.
Στη φύση, το νερό στην καθαρή του μορφή (χωρίς άλατα) δεν υπάρχει. Το ωκεάνιο, το θαλάσσιο, το ποτάμι, το πηγάδι και το νερό πηγής είναι ποικιλίες διαλυμάτων αλατιού στο νερό. Ωστόσο, συχνά οι άνθρωποι χρειάζονται καθαρό νερό που δεν περιέχει άλατα (χρησιμοποιείται σε κινητήρες αυτοκινήτων, στη χημική παραγωγή για τη λήψη διαφόρων διαλυμάτων και ουσιών, στην κατασκευή φωτογραφιών). Αυτό το νερό ονομάζεται αποσταγμένο και η μέθοδος λήψης του ονομάζεται απόσταξη.

Διήθηση είναι το φιλτράρισμα υγρών (αερίων) μέσω ενός φίλτρου προκειμένου να καθαριστούν από στερεές ακαθαρσίες.

Αυτές οι μέθοδοι βασίζονται σε διαφορές στις φυσικές ιδιότητες των συστατικών του μείγματος.
Εξετάστε τρόπους διαχωρισμού ετερογενήςκαι ομοιογενή μείγματα.
Παράδειγμα μείγματος | Μέθοδος διαχωρισμού |
Εναιώρηση - ένα μείγμα άμμου ποταμού με νερό | τακτοποίηση Διαχωρισμός υποστηρίζονταςμε βάση διαφορετικές πυκνότητες ουσιών. Πιο βαριά άμμος κατακάθεται στον πυθμένα. Μπορείτε επίσης να διαχωρίσετε το γαλάκτωμα: για να διαχωρίσετε το λάδι ή το φυτικό λάδι από το νερό. Στο εργαστήριο, αυτό μπορεί να γίνει χρησιμοποιώντας διαχωριστική χοάνη. Το λάδι ή το φυτικό έλαιο σχηματίζει το επάνω, ελαφρύτερο στρώμα. Ως αποτέλεσμα της καθίζησης, η δροσιά πέφτει από την ομίχλη, η αιθάλη εναποτίθεται από τον καπνό, η κρέμα εγκαθίσταται στο γάλα. Διαχωρισμός μίγματος νερού και φυτικού ελαίου με καθίζηση |
Μίγμα άμμου και επιτραπέζιου αλατιού σε νερό | Διήθηση Ποια είναι η βάση για τον διαχωρισμό ετερογενών μιγμάτων χρησιμοποιώντας φιλτράρισμα• Σε διάφορες διαλυτότητες ουσιών στο νερό και σε διάφορα μεγέθη σωματιδίων. Μόνο σωματίδια ουσιών ανάλογα με αυτά περνούν από τους πόρους του φίλτρου, ενώ μεγαλύτερα σωματίδια συγκρατούνται στο φίλτρο. Έτσι, μπορείτε να διαχωρίσετε ένα ετερογενές μείγμα επιτραπέζιου αλατιού και άμμου ποταμού. Διάφορες πορώδεις ουσίες μπορούν να χρησιμοποιηθούν ως φίλτρα: βαμβάκι, κάρβουνο, ψημένο άργιλο, συμπιεσμένο γυαλί και άλλα. Η μέθοδος φιλτραρίσματος είναι η βάση για τη λειτουργία οικιακών συσκευών, όπως οι ηλεκτρικές σκούπες. Χρησιμοποιείται από χειρουργούς - επίδεσμοι γάζας. γεωτρυπάνοι και εργάτες ανελκυστήρων - μάσκες αναπνοής. Με τη βοήθεια ενός φίλτρου τσαγιού για το φιλτράρισμα των φύλλων τσαγιού, ο Ostap Bender, ο ήρωας του έργου των Ilf και Petrov, κατάφερε να πάρει μια από τις καρέκλες από το Ellochka Ogre ("The Twelve Chairs"). Διαχωρισμός μίγματος αμύλου και νερού με διήθηση |
Ένα μείγμα σκόνης σιδήρου και θείου | Δράση με μαγνήτη ή νερό Η σκόνη σιδήρου έλκονταν από έναν μαγνήτη, αλλά η σκόνη θείου όχι. Η μη διαβρέξιμη σκόνη θείου επέπλεε στην επιφάνεια του νερού, ενώ η βαριά διαβρέξιμη σκόνη σιδήρου κατακάθισε στον πυθμένα. Διαχωρισμός μίγματος θείου και σιδήρου με χρήση μαγνήτη και νερού |
Ένα διάλυμα αλατιού σε νερό είναι ένα ομοιογενές μείγμα | Εξάτμιση ή κρυστάλλωση Το νερό εξατμίζεται και οι κρύσταλλοι αλατιού παραμένουν στο πορσελάνινο κύπελλο. Όταν το νερό εξατμίζεται από τις λίμνες Elton και Baskunchak, λαμβάνεται επιτραπέζιο αλάτι. Αυτή η μέθοδος διαχωρισμού βασίζεται στη διαφορά στα σημεία βρασμού του διαλύτη και της διαλυμένης ουσίας. Εάν μια ουσία, όπως η ζάχαρη, αποσυντίθεται όταν θερμαίνεται, τότε το νερό δεν εξατμίζεται πλήρως - το διάλυμα εξατμίζεται και στη συνέχεια οι κρύσταλλοι ζάχαρης καθιζάνουν από ένα κορεσμένο διάλυμα. Μερικές φορές απαιτείται η αφαίρεση ακαθαρσιών από διαλύτες με χαμηλότερο σημείο βρασμού, για παράδειγμα, νερό από αλάτι. Σε αυτή την περίπτωση, οι ατμοί της ουσίας πρέπει να συλλέγονται και στη συνέχεια να συμπυκνώνονται κατά την ψύξη. Αυτή η μέθοδος διαχωρισμού ενός ομοιογενούς μείγματος ονομάζεται απόσταξη ή απόσταξη. Σε ειδικές συσκευές - αποστακτήρες, λαμβάνεται απεσταγμένο νερό, το οποίο χρησιμοποιείται για τις ανάγκες της φαρμακολογίας, των εργαστηρίων, και των συστημάτων ψύξης αυτοκινήτων. Στο σπίτι, μπορείτε να σχεδιάσετε έναν τέτοιο αποστακτήρα: Εάν, ωστόσο, διαχωριστεί ένα μείγμα αλκοόλης και νερού, τότε το πρώτο που θα αποσταχθεί (που συλλέγεται σε δοκιμαστικό σωλήνα υποδοχής) είναι αλκοόλη με βρασμό = 78 °C και το νερό θα παραμείνει στον δοκιμαστικό σωλήνα. Η απόσταξη χρησιμοποιείται για τη λήψη βενζίνης, κηροζίνης, πετρελαίου εσωτερικής καύσης από πετρέλαιο. Διαχωρισμός ομοιογενών μιγμάτων |
Μια ειδική μέθοδος διαχωρισμού συστατικών, που βασίζεται στη διαφορετική απορρόφησή τους από μια συγκεκριμένη ουσία, είναι χρωματογραφία.
Χρησιμοποιώντας χρωματογραφία, ο Ρώσος βοτανολόγος ήταν ο πρώτος που απομόνωσε τη χλωροφύλλη από τα πράσινα μέρη των φυτών. Στη βιομηχανία και τα εργαστήρια, αντί για διηθητικό χαρτί για χρωματογραφία, χρησιμοποιείται άμυλο, άνθρακας, ασβεστόλιθος και οξείδιο του αργιλίου. Απαιτούνται πάντα οι ουσίες με τον ίδιο βαθμό καθαρισμού;
Για διαφορετικούς σκοπούς, χρειάζονται ουσίες με διαφορετικούς βαθμούς καθαρισμού. Το νερό μαγειρέματος καθιζάνει επαρκώς ώστε να αφαιρούνται οι ακαθαρσίες και το χλώριο που χρησιμοποιείται για την απολύμανσή του. Το πόσιμο νερό πρέπει πρώτα να βράσει. Και στα χημικά εργαστήρια για την παρασκευή διαλυμάτων και πειραμάτων, στην ιατρική, χρειάζεται απεσταγμένο νερό, όσο το δυνατόν πιο καθαρό από τις ουσίες που είναι διαλυμένες σε αυτό. Οι ουσίες υψηλής καθαρότητας, η περιεκτικότητα σε ακαθαρσίες στις οποίες δεν υπερβαίνει το ένα εκατομμυριοστό του τοις εκατό, χρησιμοποιούνται σε βιομηχανίες ηλεκτρονικών, ημιαγωγών, πυρηνικής τεχνολογίας και άλλων βιομηχανιών ακριβείας.
Μέθοδοι έκφρασης της σύνθεσης των μειγμάτων.
· Κλάσμα μάζας του συστατικού στο μείγμα- η αναλογία της μάζας του συστατικού προς τη μάζα ολόκληρου του μείγματος. Συνήθως το κλάσμα μάζας εκφράζεται σε %, αλλά όχι απαραίτητα.
ω ["ωμέγα"] = mcomponent / mm μείγμα
· Μοριακό κλάσμα ενός συστατικού σε ένα μείγμα- η αναλογία του αριθμού των γραμμομορίων (ποσότητα της ουσίας) του συστατικού προς τον συνολικό αριθμό γραμμομορίων όλων των ουσιών στο μείγμα. Για παράδειγμα, εάν το μείγμα περιλαμβάνει ουσίες Α, Β και Γ, τότε:
χ ["chi"] συστατικό A \u003d n συστατικό A / (n (A) + n (B) + n (C))
· Μοριακή αναλογία συστατικών.Μερικές φορές σε εργασίες για ένα μείγμα, υποδεικνύεται η μοριακή αναλογία των συστατικών του. Για παράδειγμα:
nσυστατικό Α: μη συστατικό Β = 2: 3
· Κλάσμα όγκου του συστατικού στο μείγμα (μόνο για αέρια)- η αναλογία του όγκου της ουσίας Α προς τον συνολικό όγκο ολόκληρου του μείγματος αερίων.
φ ["phi"] = Vcomponent / Vmixture
Μπλοκ εξάσκησης.
Εξετάστε τρία παραδείγματα προβλημάτων στα οποία αντιδρούν μίγματα μετάλλων υδροχλωρικόςοξύ:
Παράδειγμα 1Όταν ένα μίγμα χαλκού και σιδήρου βάρους 20 g εκτέθηκε σε περίσσεια υδροχλωρικού οξέος, απελευθερώθηκαν 5,6 λίτρα αερίου (n.a.). Προσδιορίστε τα κλάσματα μάζας των μετάλλων στο μείγμα.
Στο πρώτο παράδειγμα, ο χαλκός δεν αντιδρά με το υδροχλωρικό οξύ, δηλαδή το υδρογόνο απελευθερώνεται όταν το οξύ αντιδρά με τον σίδηρο. Έτσι, γνωρίζοντας τον όγκο του υδρογόνου, μπορούμε να βρούμε αμέσως την ποσότητα και τη μάζα του σιδήρου. Και, κατά συνέπεια, τα κλάσματα μάζας των ουσιών στο μείγμα.
Παράδειγμα 1 λύση.
n \u003d V / Vm \u003d 5,6 / 22,4 \u003d 0,25 mol.
2. Σύμφωνα με την εξίσωση αντίδρασης:
3. Η ποσότητα του σιδήρου είναι επίσης 0,25 mol. Μπορείτε να βρείτε τη μάζα του:
mFe = 0,25 56 = 14 g.
Απάντηση: 70% σίδηρος, 30% χαλκός.
Παράδειγμα 2Υπό τη δράση περίσσειας υδροχλωρικού οξέος σε μίγμα αλουμινίου και σιδήρου βάρους 11 g, απελευθερώθηκαν 8,96 λίτρα αερίου (n.a.). Προσδιορίστε τα κλάσματα μάζας των μετάλλων στο μείγμα.
Στο δεύτερο παράδειγμα, η αντίδραση είναι και τα δυομέταλλο. Εδώ, υδρογόνο απελευθερώνεται ήδη από το οξύ και στις δύο αντιδράσεις. Επομένως, ο άμεσος υπολογισμός δεν μπορεί να χρησιμοποιηθεί εδώ. Σε τέτοιες περιπτώσεις, είναι βολικό να λυθεί χρησιμοποιώντας ένα πολύ απλό σύστημα εξισώσεων, λαμβάνοντας για το x - τον αριθμό των γραμμομορίων ενός από τα μέταλλα και για το y - την ποσότητα της ουσίας του δεύτερου.
Παράδειγμα 2 λύση.
1. Βρείτε την ποσότητα του υδρογόνου:
n \u003d V / Vm \u003d 8,96 / 22,4 \u003d 0,4 mol.
2. Έστω η ποσότητα του αλουμινίου x mol, και του σιδήρου y mol. Τότε μπορούμε να εκφράσουμε με όρους x και y την ποσότητα του υδρογόνου που απελευθερώνεται:
2HCl = FeCl2 + |
4. Γνωρίζουμε τη συνολική ποσότητα υδρογόνου: 0,4 mol. Που σημαίνει,
1,5x + y = 0,4 (αυτή είναι η πρώτη εξίσωση στο σύστημα).
5. Για ένα μείγμα μετάλλων, πρέπει να εκφράσετε μάζεςμέσω ποσοτήτων ουσιών.
m = Mn
Άρα η μάζα του αλουμινίου
mAl = 27x,
μάζα σιδήρου
mFe = 56y,
και τη μάζα όλου του μείγματος
27x + 56y = 11 (αυτή είναι η δεύτερη εξίσωση στο σύστημα).
6. Άρα, έχουμε ένα σύστημα δύο εξισώσεων:
7. Η επίλυση τέτοιων συστημάτων είναι πολύ πιο βολική με την αφαίρεση πολλαπλασιάζοντας την πρώτη εξίσωση επί 18:
27x + 18y = 7,2
και αφαιρώντας την πρώτη εξίσωση από τη δεύτερη:
8. (56 - 18) ε \u003d 11 - 7.2
y \u003d 3,8 / 38 \u003d 0,1 mol (Fe)
x = 0,2 mol (Al)
mFe = n M = 0,1 56 = 5,6 g
mAl = 0,2 27 = 5,4 g
ωFe = mFe / mm μίγμα = 5,6 / 11 = 0,50,91%),
αντίστοιχα,
ωAl \u003d 100% - 50,91% \u003d 49,09%
Απάντηση: 50,91% σίδηρος, 49,09% αλουμίνιο.
Παράδειγμα 316 g μίγματος ψευδαργύρου, αλουμινίου και χαλκού κατεργάστηκαν με περίσσεια διαλύματος υδροχλωρικού οξέος. Στην περίπτωση αυτή απελευθερώθηκαν 5,6 λίτρα αερίου (n.a.) και 5 g της ουσίας δεν διαλύθηκαν. Προσδιορίστε τα κλάσματα μάζας των μετάλλων στο μείγμα.
Στο τρίτο παράδειγμα, δύο μέταλλα αντιδρούν, αλλά το τρίτο μέταλλο (χαλκός) δεν αντιδρά. Επομένως, το υπόλοιπο των 5 g είναι η μάζα του χαλκού. Οι ποσότητες των υπόλοιπων δύο μετάλλων - ψευδάργυρος και αλουμίνιο (σημειώστε ότι η συνολική τους μάζα είναι 16 - 5 = 11 g) μπορούν να βρεθούν χρησιμοποιώντας ένα σύστημα εξισώσεων, όπως στο παράδειγμα Νο. 2.
Απάντηση στο Παράδειγμα 3: 56,25% ψευδάργυρος, 12,5% αλουμίνιο, 31,25% χαλκός.
Παράδειγμα 4Ένα μίγμα από σίδηρο, αλουμίνιο και χαλκό κατεργάστηκε με περίσσεια ψυχρού συμπυκνωμένου θειικού οξέος. Ταυτόχρονα, μέρος του μείγματος διαλύθηκε και απελευθερώθηκαν 5,6 λίτρα αερίου (n.a.). Το υπόλοιπο μίγμα υποβλήθηκε σε επεξεργασία με περίσσεια διαλύματος υδροξειδίου του νατρίου. Εκλύθηκαν 3,36 λίτρα αερίου και παρέμειναν 3 g αδιάλυτου υπολείμματος. Προσδιορίστε τη μάζα και τη σύσταση του αρχικού μείγματος μετάλλων.
Σε αυτό το παράδειγμα, θυμηθείτε ότι ψυχρό συμπυκνωμένοΤο θειικό οξύ δεν αντιδρά με το σίδηρο και το αλουμίνιο (παθητικοποίηση), αλλά αντιδρά με τον χαλκό. Σε αυτή την περίπτωση, απελευθερώνεται οξείδιο του θείου (IV).
Με αλκάλιααντιδρά μόνο αλουμίνιο- αμφοτερικό μέταλλο (εκτός από το αλουμίνιο, ο ψευδάργυρος και ο κασσίτερος διαλύονται επίσης σε αλκάλια και το βηρύλλιο μπορεί ακόμα να διαλυθεί σε ζεστό συμπυκνωμένο αλκάλιο).
Παράδειγμα 4 λύση.
1. Μόνο ο χαλκός αντιδρά με το πυκνό θειικό οξύ, τον αριθμό των γραμμομορίων αερίου:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
2H2SO4 (συγ.) = CuSO4 + |
2. (μην ξεχνάτε ότι τέτοιες αντιδράσεις πρέπει να εξισορροπούνται χρησιμοποιώντας ηλεκτρονικό ισοζύγιο)
3. Εφόσον η μοριακή αναλογία χαλκού και διοξειδίου του θείου είναι 1:1, τότε και ο χαλκός είναι 0,25 mol. Μπορείτε να βρείτε τη μάζα του χαλκού:
mCu \u003d n M \u003d 0,25 64 \u003d 16 g.
4. Το αλουμίνιο αντιδρά με αλκαλικό διάλυμα και σχηματίζεται υδροξοσύμπλοκο αλουμινίου και υδρογόνο:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Αριθμός γραμμομορίων υδρογόνου:
nH2 = 3,36 / 22,4 = 0,15 mol,
η μοριακή αναλογία αλουμινίου και υδρογόνου είναι 2:3 και, επομένως,
nAl = 0,15 / 1,5 = 0,1 mol.
Βάρος αλουμινίου:
mAl \u003d n M \u003d 0,1 27 \u003d 2,7 g
6. Το υπόλοιπο είναι σίδηρος, βάρους 3 γρ. Μπορείτε να βρείτε τη μάζα του μείγματος:
mmix \u003d 16 + 2,7 + 3 \u003d 21,7 g.
7. Κλάσματα μάζας μετάλλων:
ωCu = mCu / mm μίγμα = 16 / 21,7 = 0,7,73%)
ωAl = 2,7 / 21,7 = 0,1,44%)
ωFe = 13,83%
Απάντηση: 73,73% χαλκός, 12,44% αλουμίνιο, 13,83% σίδηρος.
Παράδειγμα 521,1 g μίγματος ψευδαργύρου και αλουμινίου διαλύθηκαν σε 565 ml διαλύματος νιτρικού οξέος που περιείχε 20 wt. % ΗΝΟ3 και έχει πυκνότητα 1,115 g/ml. Ο όγκος του εκλυόμενου αερίου, που είναι μια απλή ουσία και το μοναδικό προϊόν της αναγωγής του νιτρικού οξέος, ανήλθε σε 2.912 l (n.a.). Προσδιορίστε τη σύνθεση του προκύπτοντος διαλύματος σε ποσοστό μάζας. (RCTU)
Το κείμενο αυτού του προβλήματος δείχνει ξεκάθαρα το προϊόν της αναγωγής του αζώτου - "απλή ουσία". Δεδομένου ότι το νιτρικό οξύ δεν παράγει υδρογόνο με μέταλλα, είναι άζωτο. Και τα δύο μέταλλα διαλυμένα σε οξύ.
Το πρόβλημα δεν ρωτά τη σύνθεση του αρχικού μείγματος μετάλλων, αλλά τη σύνθεση του διαλύματος που λαμβάνεται μετά τις αντιδράσεις. Αυτό κάνει το έργο πιο δύσκολο.
Παράδειγμα 5 λύση.
1. Προσδιορίστε την ποσότητα της αέριας ουσίας:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
2. Προσδιορίστε τη μάζα του διαλύματος νιτρικού οξέος, τη μάζα και την ποσότητα της διαλυμένης ουσίας HNO3:
msolution \u003d ρ V \u003d 1,115 565 \u003d 630,3 g
mHNO3 = ω msolution = 0,2 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mol
Σημειώστε ότι εφόσον τα μέταλλα έχουν διαλυθεί πλήρως, σημαίνει - μόνο αρκετό οξύ(αυτά τα μέταλλα δεν αντιδρούν με το νερό). Αντίστοιχα, θα χρειαστεί να γίνει έλεγχος Υπάρχει πολύ οξύ;, και πόσο από αυτό παραμένει μετά την αντίδραση στο διάλυμα που προκύπτει.
3. Συνθέστε εξισώσεις αντίδρασης ( μην ξεχνάτε το ηλεκτρονικό υπόλοιπο) και, για ευκολία των υπολογισμών, παίρνουμε για 5x - την ποσότητα ψευδαργύρου, και για 10y - την ποσότητα αλουμινίου. Στη συνέχεια, σύμφωνα με τους συντελεστές στις εξισώσεις, το άζωτο στην πρώτη αντίδραση θα είναι x mol και στη δεύτερη - 3y mol:
12HNO3 = 5Zn(NO3)2 + |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3 + |
Al0 − 3e = Al3+ | ||
5. Στη συνέχεια, δεδομένου ότι η μάζα του μείγματος των μετάλλων είναι 21,1 g, οι μοριακές τους μάζες είναι 65 g/mol για τον ψευδάργυρο και 27 g/mol για το αλουμίνιο, προκύπτει το ακόλουθο σύστημα εξισώσεων:
6. Είναι βολικό να λύσετε αυτό το σύστημα πολλαπλασιάζοντας την πρώτη εξίσωση επί 90 και αφαιρώντας την πρώτη εξίσωση από τη δεύτερη.
7. x \u003d 0,04, που σημαίνει nZn \u003d 0,04 5 \u003d 0,2 mol
y \u003d 0,03, που σημαίνει ότι nAl \u003d 0,03 10 \u003d 0,3 mol
8. Ελέγξτε τη μάζα του μείγματος:
0,2 65 + 0,3 27 \u003d 21,1 g.
9. Τώρα ας προχωρήσουμε στη σύνθεση του διαλύματος. Θα είναι βολικό να ξαναγράψετε τις αντιδράσεις ξανά και να σημειώσετε πάνω από τις αντιδράσεις τις ποσότητες όλων των ουσιών που αντέδρασαν και σχηματίστηκαν (εκτός από το νερό):
10. Το επόμενο ερώτημα είναι: παρέμεινε νιτρικό οξύ στο διάλυμα και πόσο μένει;
Σύμφωνα με τις εξισώσεις αντίδρασης, η ποσότητα του οξέος που αντέδρασε:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
δηλαδή το οξύ ήταν σε περίσσεια και μπορείτε να υπολογίσετε το υπόλοιπο του στο διάλυμα:
nHNO3res. \u003d 2 - 1,56 \u003d 0,44 mol.
11. Έτσι, μέσα ΤΕΛΙΚΗ λυσηπεριέχει:
νιτρικός ψευδάργυρος σε ποσότητα 0,2 mol:
mZn(NO3)2 = n M = 0,2 189 = 37,8 g
νιτρικό αλουμίνιο σε ποσότητα 0,3 mol:
mAl(NO3)3 = n M = 0,3 213 = 63,9 g
περίσσεια νιτρικού οξέος σε ποσότητα 0,44 mol:
mHNO3res. = n M = 0,44 63 = 27,72 g
12. Ποια είναι η μάζα του τελικού διαλύματος;
Θυμηθείτε ότι η μάζα του τελικού διαλύματος αποτελείται από εκείνα τα συστατικά που αναμίξαμε (διαλύματα και ουσίες) μείον εκείνα τα προϊόντα αντίδρασης που έφυγαν από το διάλυμα (ιζήματα και αέρια):
13.
Τότε για το έργο μας:
14. νέος διάλυμα \u003d μάζα διαλύματος οξέος + μάζα κράματος μετάλλων - μάζα αζώτου
mN2 = n M = 28 (0,03 + 0,09) = 3,36 g
νέος διάλυμα \u003d 630,3 + 21,1 - 3,36 \u003d 648,04 g
ωZn(NO3)2 \u003d mv-va / mr-ra \u003d 37,8 / 648,04 \u003d 0,0583
ωAl(NO3)3 \u003d mv-va / mr-ra \u003d 63,9 / 648,04 \u003d 0,0986
ωHNO3res. \u003d mv-va / mr-ra \u003d 27,72 / 648,04 \u003d 0,0428
Απάντηση: 5,83% νιτρικός ψευδάργυρος, 9,86% νιτρικό αργίλιο, 4,28% νιτρικό οξύ.
Παράδειγμα 6Κατά την επεξεργασία 17,4 g μίγματος χαλκού, σιδήρου και αλουμινίου με περίσσεια πυκνού νιτρικού οξέος, απελευθερώθηκαν 4,48 λίτρα αερίου (n.a.) και όταν αυτό το μείγμα εκτέθηκε στην ίδια μάζα περίσσειας υδροχλωρικού οξέος, 8,96 λίτρα αερίου (ν.α.). υ.). Προσδιορίστε τη σύνθεση του αρχικού μείγματος. (RCTU)
Κατά την επίλυση αυτού του προβλήματος, πρέπει να θυμόμαστε, πρώτον, ότι το συμπυκνωμένο νιτρικό οξύ με ένα ανενεργό μέταλλο (χαλκός) δίνει ΝΟ2, ενώ ο σίδηρος και το αλουμίνιο δεν αντιδρούν με αυτό. Το υδροχλωρικό οξύ, από την άλλη, δεν αντιδρά με τον χαλκό.
Απαντήστε για παράδειγμα 6: 36,8% χαλκός, 32,2% σίδηρος, 31% αλουμίνιο.
Εργασίες για ανεξάρτητη λύση.
1. Απλά προβλήματα με δύο συστατικά μείγματος.
1-1. Μίγμα χαλκού και αλουμινίου βάρους 20 g υποβλήθηκε σε επεξεργασία με διάλυμα νιτρικού οξέος 96% και απελευθερώθηκαν 8,96 λίτρα αερίου (n.a.). Προσδιορίστε το κλάσμα μάζας του αλουμινίου στο μείγμα.
1-2. Μίγμα χαλκού και ψευδαργύρου βάρους 10 g υποβλήθηκε σε επεξεργασία με πυκνό διάλυμα αλκαλίου. Στην περίπτωση αυτή απελευθερώθηκαν 2,24 λίτρα αερίου (ν. ε.). Υπολογίστε το κλάσμα μάζας του ψευδαργύρου στο αρχικό μείγμα.
1-3. Μίγμα μαγνησίου και οξειδίου μαγνησίου βάρους 6,4 g υποβλήθηκε σε επεξεργασία με επαρκή ποσότητα αραιού θειικού οξέος. Παράλληλα, απελευθερώθηκαν 2,24 λίτρα αερίου (α.α.). Βρείτε το κλάσμα μάζας του μαγνησίου στο μείγμα.
1-4. Ένα μίγμα ψευδαργύρου και οξειδίου του ψευδαργύρου βάρους 3,08 g διαλύθηκε σε αραιό θειικό οξύ. Ελήφθη θειικός ψευδάργυρος βάρους 6,44 g Υπολογίστε το κλάσμα μάζας του ψευδαργύρου στο αρχικό μίγμα.
1-5. Κάτω από τη δράση ενός μίγματος σκονών σιδήρου και ψευδαργύρου βάρους 9,3 g σε περίσσεια διαλύματος χλωριούχου χαλκού (II), σχηματίστηκαν 9,6 g χαλκού. Προσδιορίστε τη σύνθεση του αρχικού μείγματος.
1-6. Ποια μάζα διαλύματος υδροχλωρικού οξέος 20% θα χρειαστεί για να διαλυθούν πλήρως 20 g μείγματος ψευδαργύρου με οξείδιο του ψευδαργύρου, εάν απελευθερωθεί υδρογόνο σε ποσότητα 4,48 λίτρων (n.a.);
1-7. Όταν διαλύονται σε αραιό νιτρικό οξύ, 3,04 g μείγματος σιδήρου και χαλκού απελευθερώνουν μονοξείδιο του αζώτου (II) με όγκο 0,896 l (n.a.). Προσδιορίστε τη σύνθεση του αρχικού μείγματος.
1-8. Κατά τη διάλυση 1,11 g ενός μίγματος ρινισμάτων σιδήρου και αλουμινίου σε διάλυμα υδροχλωρικού οξέος 16% (ρ = 1,09 g/ml), απελευθερώθηκαν 0,672 λίτρα υδρογόνου (n.a.). Βρείτε τα κλάσματα μάζας των μετάλλων στο μείγμα και προσδιορίστε τον όγκο του υδροχλωρικού οξέος που καταναλώθηκε.
2. Οι εργασίες είναι πιο σύνθετες.
2-1. Μίγμα ασβεστίου και αλουμινίου βάρους 18,8 g φρύχθηκε χωρίς πρόσβαση στον αέρα με περίσσεια σκόνης γραφίτη. Το προϊόν της αντίδρασης κατεργάστηκε με αραιό υδροχλωρικό οξύ και απελευθερώθηκαν 11,2 λίτρα αερίου (n.a.). Προσδιορίστε τα κλάσματα μάζας των μετάλλων στο μείγμα.
2-2. Για τη διάλυση 1,26 g ενός κράματος μαγνησίου με αλουμίνιο, χρησιμοποιήθηκαν 35 ml ενός διαλύματος θειικού οξέος 19,6% (ρ = 1,1 g/ml). Η περίσσεια οξέος αντέδρασε με 28,6 ml διαλύματος όξινου ανθρακικού καλίου 1,4 mol/L. Προσδιορίστε τα κλάσματα μάζας των μετάλλων στο κράμα και τον όγκο του αερίου (n.a.) που απελευθερώνεται κατά τη διάλυση του κράματος.
Εάν τα διασκορπισμένα σωματίδια απελευθερώνονται αργά από το μέσο ή είναι απαραίτητο να προκαθαριστεί ένα ανομοιογενές σύστημα, χρησιμοποιούνται μέθοδοι όπως κροκίδωση, επίπλευση, ταξινόμηση, πήξη κ.λπ.
Η πήξη είναι η διαδικασία συγκόλλησης σωματιδίων σε κολλοειδή συστήματα (γαλακτώματα ή εναιωρήματα) με το σχηματισμό συσσωματωμάτων. Το κόλλημα συμβαίνει λόγω της σύγκρουσης σωματιδίων κατά την κίνηση Brown. Η πήξη αναφέρεται σε μια αυθόρμητη διαδικασία που τείνει να μετακινηθεί σε μια κατάσταση που έχει χαμηλότερη ελεύθερη ενέργεια. Το κατώφλι πήξης είναι η ελάχιστη συγκέντρωση μιας εγχυόμενης ουσίας που προκαλεί πήξη. Η τεχνητή πήξη μπορεί να επιταχυνθεί με την προσθήκη ειδικών ουσιών - πηκτικών στο κολλοειδές σύστημα, καθώς και με την εφαρμογή ηλεκτρικού πεδίου στο σύστημα (ηλεκτροπηξία), μηχανική δράση (δόνηση, ανάμειξη) κ.λπ.
Κατά τη διάρκεια της πήξης, συχνά προστίθενται πηκτικές χημικές ουσίες στο ετερογενές μείγμα που πρόκειται να διαχωριστεί, που καταστρέφουν τα διαλυτωμένα κελύφη, ενώ μειώνουν το τμήμα διάχυσης του ηλεκτρικού διπλού στρώματος που βρίσκεται κοντά στην επιφάνεια των σωματιδίων. Αυτό διευκολύνει τη συσσωμάτωση σωματιδίων και το σχηματισμό συσσωματωμάτων. Έτσι, λόγω του σχηματισμού μεγαλύτερων κλασμάτων της διεσπαρμένης φάσης, η καθίζηση των σωματιδίων επιταχύνεται. Ως πηκτικά χρησιμοποιούνται άλατα σιδήρου, αλουμινίου ή άλατα άλλων πολυσθενών μετάλλων.
Η πεπτοποίηση είναι η αντίστροφη διαδικασία της πήξης, η οποία είναι η διάσπαση των συσσωματωμάτων σε πρωτογενή σωματίδια. Η πεπτοποίηση πραγματοποιείται με την προσθήκη πεπτοποιητικών ουσιών στο μέσο διασποράς. Αυτή η διαδικασία συμβάλλει στη διάσπαση των ουσιών σε πρωτογενή σωματίδια. Οι πεπτωτικοί παράγοντες μπορεί να είναι επιφανειοδραστικές ουσίες (επιφανειοδραστικές ουσίες) ή ηλεκτρολύτες όπως χουμικά οξέα ή χλωριούχος σίδηρος. Η διαδικασία πεπτοποίησης χρησιμοποιείται για τη λήψη συστημάτων υγρής διασποράς από πάστες ή σκόνες.
Με τη σειρά του, η κροκίδωση είναι ένα είδος πήξης. Σε αυτή τη διαδικασία, μικρά σωματίδια που αιωρούνται σε αέρια ή υγρά μέσα σχηματίζουν κροκιδώδη συσσωματώματα, τα οποία ονομάζονται κροκιδώματα. Διαλυτά πολυμερή, όπως οι πολυηλεκτρολύτες, χρησιμοποιούνται ως κροκιδωτικά. Οι κροκιδωτικές ουσίες μπορούν εύκολα να αφαιρεθούν με διήθηση ή καθίζηση. Η κροκίδωση χρησιμοποιείται για την επεξεργασία του νερού και τον διαχωρισμό πολύτιμων ουσιών από τα λύματα, καθώς και για την επεξεργασία ορυκτών. Στην περίπτωση επεξεργασίας νερού, τα κροκιδωτικά χρησιμοποιούνται σε χαμηλές συγκεντρώσεις (από 0,1 έως 5 mg/l).
Προκειμένου να καταστραφούν τα αδρανή σε υγρά συστήματα, χρησιμοποιούνται πρόσθετα που προκαλούν φορτία στα σωματίδια που εμποδίζουν τη σύγκλισή τους. Αυτό το αποτέλεσμα μπορεί επίσης να επιτευχθεί αλλάζοντας το pH του μέσου. Αυτή η μέθοδος ονομάζεται αποφλοίωση.
Επίπλευση είναι η διαδικασία διαχωρισμού στερεών υδρόφοβων σωματιδίων από μια υγρή συνεχή φάση με επιλεκτική στερέωσή τους στη διεπιφάνεια μεταξύ της υγρής και της αέριας φάσης (η επιφάνεια επαφής υγρού και αερίου ή η επιφάνεια των φυσαλίδων στην υγρή φάση). στερεά σωματίδια και εγκλείσματα αερίων απομακρύνονται από την επιφάνεια της υγρής φάσης. Αυτή η διαδικασία χρησιμοποιείται όχι μόνο για την απομάκρυνση των σωματιδίων της διεσπαρμένης φάσης, αλλά και για τον διαχωρισμό διαφορετικών σωματιδίων λόγω διαφορών στη διαβρεξιμότητά τους. Σε αυτή τη διαδικασία, τα υδρόφοβα σωματίδια στερεώνονται στη διεπιφάνεια και διαχωρίζονται από τα υδρόφιλα σωματίδια που κατακάθονται στον πυθμένα. Τα καλύτερα αποτελέσματα επίπλευσης εμφανίζονται όταν το μέγεθος των σωματιδίων είναι μεταξύ 0,1 και 0,04 mm.
Υπάρχουν διάφοροι τύποι επίπλευσης: αφρός, λάδι, φιλμ κ.λπ. Το πιο συνηθισμένο είναι η επίπλευση αφρού. Αυτή η διαδικασία επιτρέπει στα σωματίδια που έχουν υποστεί επεξεργασία με αντιδραστήρια να μεταφερθούν στην επιφάνεια του νερού με τη βοήθεια φυσαλίδων αέρα. Αυτό επιτρέπει τον σχηματισμό ενός στρώματος αφρού, η σταθερότητα του οποίου ελέγχεται από έναν παράγοντα αφρισμού.
Η ταξινόμηση χρησιμοποιείται σε συσκευές μεταβλητής διατομής. Με τη βοήθειά του, είναι δυνατό να διαχωριστεί μια ορισμένη ποσότητα μικρών σωματιδίων από το κύριο προϊόν, που αποτελείται από μεγάλα σωματίδια. Η ταξινόμηση πραγματοποιείται με χρήση φυγόκεντρων και υδροκυκλώνων λόγω της επίδρασης της φυγόκεντρης δύναμης.
Ο διαχωρισμός των αναρτήσεων με χρήση συστημάτων μαγνητικής επεξεργασίας είναι μια πολλά υποσχόμενη μέθοδος. Το νερό που έχει υποστεί επεξεργασία σε μαγνητικό πεδίο διατηρεί αλλαγμένες ιδιότητες για μεγάλο χρονικό διάστημα, για παράδειγμα, μειωμένη ικανότητα διαβροχής. Αυτή η διαδικασία καθιστά δυνατή την εντατικοποίηση του διαχωρισμού των αναρτήσεων.
ΜΕ μέθοδοι διαχωρισμού μείγματος (τόσο ετερογενείς όσο και ομοιογενείς) βασίζονται στο γεγονός ότι οι ουσίες που αποτελούν το μείγμα διατηρούν τις ατομικές τους ιδιότητες. Τα ετερογενή μείγματα μπορεί να διαφέρουν ως προς τη σύνθεση και την κατάσταση φάσης, για παράδειγμα: αέριο + υγρό. στερεό+υγρό; δύο μη αναμίξιμα υγρά κ.λπ. Οι κύριες μέθοδοι διαχωρισμού των μιγμάτων φαίνονται στο παρακάτω διάγραμμα. Ας εξετάσουμε κάθε μέθοδο ξεχωριστά.
Διαχωρισμός ετερογενών μιγμάτων
Για διαχωρισμός ετερογενών μιγμάτων,τα οποία είναι συστήματα στερεού-υγρού ή στερεού αερίου, υπάρχουν τρεις κύριοι τρόποι:
- διήθηση,
- καθίζηση (μετάγγιση,
- μαγνητικός διαχωρισμός
ΔΙΗΘΗΣΗ
μια μέθοδο που βασίζεται στη διαφορετική διαλυτότητα των ουσιών και στα διαφορετικά μεγέθη σωματιδίων των συστατικών του μείγματος. Η διήθηση διαχωρίζει ένα στερεό από ένα υγρό ή αέριο.
Για το φιλτράρισμα των υγρών, μπορεί να χρησιμοποιηθεί διηθητικό χαρτί, το οποίο συνήθως διπλώνεται στα τέσσερα και εισάγεται σε γυάλινη χοάνη. Το χωνί τοποθετείται σε ποτήρι ζέσεως στο οποίο διήθημαείναι το υγρό που έχει περάσει από το φίλτρο.
Το μέγεθος πόρων στο διηθητικό χαρτί είναι τέτοιο που επιτρέπει στα μόρια του νερού και στα μόρια της διαλυμένης ουσίας να διαπερνούν ανεμπόδιστα. Σωματίδια μεγαλύτερα από 0,01 mm συγκρατούνται στο φίλτρο και όχιπεράσουν μέσα από αυτό, σχηματίζοντας έτσι ένα στρώμα ιζήματος.
Θυμάμαι!Με τη βοήθεια της διήθησης, είναι αδύνατο να διαχωριστούν αληθινά διαλύματα ουσιών, δηλαδή διαλύματα στα οποία η διάλυση έγινε σε επίπεδο μορίων ή ιόντων.
Εκτός από το διηθητικό χαρτί, τα χημικά εργαστήρια χρησιμοποιούν ειδικά φίλτρα με
διαφορετικά μεγέθη πόρων.
Η διήθηση των μιγμάτων αερίων δεν διαφέρει θεμελιωδώς από τη διήθηση υγρών. Η μόνη διαφορά είναι ότι κατά το φιλτράρισμα αερίων από σωματίδια (SPM), χρησιμοποιούνται φίλτρα ειδικών σχεδίων (χαρτί, άνθρακας) και αντλίες για την ώθηση του μείγματος αερίων μέσω του φίλτρου, για παράδειγμα, διήθηση αέρα στο εσωτερικό του αυτοκινήτου ή στην κουκούλα εξάτμισης πάνω από μια σόμπα.
Το φιλτράρισμα μπορεί να χωριστεί:
- δημητριακά και νερό
- κιμωλία και νερό
- άμμος και νερό κ.λπ.
- σκόνη και αέρας (διάφορα σχέδια ηλεκτρικών σκουπών)
ΕΠΙΛΥΣΗ
Η μέθοδος βασίζεται σε διαφορετικούς ρυθμούς καθίζησης στερεών σωματιδίων με διαφορετικά βάρη (πυκνότητες) σε υγρό ή αέρα μέσο. Η μέθοδος χρησιμοποιείται για τον διαχωρισμό δύο ή περισσότερων στερεών αδιάλυτων ουσιών στο νερό (ή σε άλλο διαλύτη). Ένα μείγμα αδιάλυτων ουσιών τοποθετείται σε νερό, αναμειγνύεται επιμελώς. Μετά από κάποιο χρονικό διάστημα, ουσίες με πυκνότητα μεγαλύτερη από τη μονάδα κατακάθονται στον πυθμένα του δοχείου και ουσίες με πυκνότητα μικρότερη από τη μονάδα επιπλέουν. Εάν υπάρχουν πολλές ουσίες με διαφορετική βαρύτητα στο μείγμα, τότε βαρύτερες ουσίες θα εγκατασταθούν στο κάτω στρώμα και στη συνέχεια ελαφρύτερες. Αυτά τα στρώματα μπορούν επίσης να διαχωριστούν. Προηγουμένως, με αυτόν τον τρόπο απομονώνονταν κόκκοι χρυσού από θρυμματισμένα πετρώματα που φέρουν χρυσό. Η χρυσοφόρος άμμος τοποθετήθηκε σε κεκλιμένο αυλάκι, μέσω του οποίου εκτοξεύτηκε ένα ρεύμα νερού. Η ροή του νερού μάζεψε και παρέσυρε τον άχρηστο βράχο και βαρείς κόκκοι χρυσού εγκαταστάθηκαν στον πάτο της υδρορροής. Στην περίπτωση των μιγμάτων αερίων, υπάρχει επίσης η καθίζηση στερεών σωματιδίων σε σκληρές επιφάνειες, όπως η καθίζηση σκόνης σε έπιπλα ή φύλλα φυτών.
Τα μη αναμίξιμα υγρά μπορούν επίσης να διαχωριστούν με αυτή τη μέθοδο. Για να το κάνετε αυτό, χρησιμοποιήστε μια διαχωριστική χοάνη.
Για παράδειγμα, για να διαχωριστεί η βενζίνη και το νερό, το μείγμα τοποθετείται σε διαχωριστική χοάνη, περιμένοντας τη στιγμή μέχρι να εμφανιστεί ένα καθαρό όριο φάσης. Στη συνέχεια ανοίξτε απαλά τη βρύση και το νερό ρέει στο ποτήρι.
Τα μείγματα μπορούν να διαχωριστούν με καθίζηση:
- άμμος ποταμού και άργιλος
- βαρύ κρυσταλλικό ίζημα από διάλυμα
- λάδι και νερό
- φυτικό λάδι και νερό κ.λπ.
ΜΑΓΝΗΤΙΚΟΣ ΔΙΑΧΩΡΙΣΜΟΣ
Η μέθοδος βασίζεται σε διαφορετικές μαγνητικές ιδιότητες των στερεών συστατικών του μείγματος. Αυτή η μέθοδος χρησιμοποιείται παρουσία σιδηρομαγνητικών ουσιών στο μείγμα, δηλαδή ουσιών με μαγνητικές ιδιότητες, όπως ο σίδηρος.
Όλες οι ουσίες, σε σχέση με το μαγνητικό πεδίο, μπορούν να χωριστούν υπό όρους σε τρεις μεγάλες ομάδες:
- φερομαγνητικά: έλκεται από μαγνήτη - Fe, Co, Ni, Gd, Dy
- παραμαγνήτες: ασθενώς έλξη-Al, Cr, Ti, V, W, Mo
- διαμαγνήτες: απωθείται με μαγνήτη - Cu, Ag, Au, Bi, Sn, ορείχαλκος
Ο μαγνητικός διαχωρισμός μπορεί να διαχωριστείσι:
- θείο και σκόνη σιδήρου
- αιθάλης και σιδήρου κ.λπ.
Διαχωρισμός ομοιογενών μιγμάτων
Για διαχωρισμός υγρών ομοιογενών μιγμάτων (αληθινά διαλύματα)χρησιμοποιήστε τις ακόλουθες μεθόδους:
- εξάτμιση (κρυστάλλωση),
- απόσταξη (απόσταξη),
- χρωματογραφία.
ΕΞΑΤΜΙΣΗ. ΑΠΟΚΡΥΣΤΑΛΛΩΣΗ.
Η μέθοδος βασίζεται σε διαφορετικά σημεία βρασμού διαλύτη και διαλυμένης ουσίας. Χρησιμοποιείται για την απομόνωση διαλυτών στερεών από διαλύματα. Η εξάτμιση πραγματοποιείται συνήθως ως εξής: το διάλυμα χύνεται σε ένα πορσελάνινο κύπελλο και θερμαίνεται ενώ το διάλυμα αναδεύεται συνεχώς. Το νερό εξατμίζεται σταδιακά και ένα στερεό παραμένει στον πάτο του φλιτζανιού.
ΟΡΙΣΜΟΣ
Αποκρυστάλλωση- μετάβαση φάσης μιας ουσίας από αέρια (ατμική), υγρή ή στερεή άμορφη κατάσταση σε κρυσταλλική κατάσταση.
Σε αυτή την περίπτωση, η εξατμισμένη ουσία (νερό ή διαλύτης) μπορεί να συλλεχθεί με συμπύκνωση σε ψυχρότερη επιφάνεια. Για παράδειγμα, εάν τοποθετήσετε μια κρύα γυάλινη πλάκα πάνω από ένα πιάτο που εξατμίζεται, σχηματίζονται σταγονίδια νερού στην επιφάνειά του. Η μέθοδος απόσταξης βασίζεται στην ίδια αρχή.
ΑΠΟΣΤΑΞΗ. ΑΠΟΣΤΑΞΗ.
Εάν μια ουσία, όπως η ζάχαρη, αποσυντίθεται όταν θερμαίνεται, τότε το νερό δεν εξατμίζεται πλήρως - το διάλυμα εξατμίζεται και στη συνέχεια οι κρύσταλλοι ζάχαρης καθιζάνουν από ένα κορεσμένο διάλυμα. Μερικές φορές απαιτείται καθαρισμός διαλυτών από ακαθαρσίες, για παράδειγμα, νερό από αλάτι. Σε αυτή την περίπτωση, ο διαλύτης πρέπει να εξατμιστεί και στη συνέχεια να συλλεχθούν οι ατμοί του και να συμπυκνωθούν κατά την ψύξη. Αυτή η μέθοδος διαχωρισμού ενός ομοιογενούς μείγματος ονομάζεται απόσταξη,ή απόσταξη.
Στη φύση, το νερό στην καθαρή του μορφή (χωρίς άλατα) δεν υπάρχει. Το ωκεάνιο, το θαλάσσιο, το ποτάμι, το πηγάδι και το νερό πηγής είναι ποικιλίες διαλυμάτων αλατιού στο νερό. Ωστόσο, συχνά οι άνθρωποι χρειάζονται καθαρό νερό που δεν περιέχει άλατα (χρησιμοποιείται σε κινητήρες αυτοκινήτων, στη χημική παραγωγή για τη λήψη διαφόρων διαλυμάτων και ουσιών, στην κατασκευή φωτογραφιών). Αυτό το νερό λέγεται αποσταγμένοχρησιμοποιείται στο εργαστήριο για χημικά πειράματα.
Η απόσταξη μπορεί να χωριστεί:
- νερό και αλκοόλ
- λάδι (για διάφορα κλάσματα)
- ακετόνη και νερό κ.λπ.
ΧΡΩΜΑΤΟΓΡΑΦΙΑ
Μέθοδος διαχωρισμού και ανάλυσης μειγμάτων ουσιών. Βασίζεται σε διαφορετικούς ρυθμούς κατανομής της ελεγχόμενης ουσίας μεταξύ δύο φάσεων - σταθερής και κινητής (εκλουστικό). Η στατική φάση, κατά κανόνα, είναι μια ροφητική ουσία (λεπτή σκόνη, όπως οξείδιο αλουμινίου ή οξείδιο ψευδαργύρου ή διηθητικό χαρτί) με ανεπτυγμένη επιφάνεια και η κινητή φάση είναι μια ροή αερίου ή υγρού. Η ροή της κινητής φάσης φιλτράρεται μέσω της ροφητικής κλίνης ή κινείται κατά μήκος της ροφητικής κλίνης, για παράδειγμα, στην επιφάνεια του διηθητικού χαρτιού.
Μπορείτε να πάρετε μόνοι σας ένα χρωματογράφημα και να δείτε την ουσία της μεθόδου στην πράξη. Είναι απαραίτητο να αναμίξετε πολλά μελάνια και να εφαρμόσετε μια σταγόνα από το μείγμα που προκύπτει σε διηθητικό χαρτί. Στη συνέχεια, ακριβώς στη μέση του χρωματιστού σημείου, θα αρχίσουμε να ρίχνουμε καθαρό νερό σταγόνα-σταγόνα. Κάθε σταγόνα πρέπει να εφαρμόζεται μόνο αφού έχει απορροφηθεί η προηγούμενη. Το νερό παίζει το ρόλο του εκλούτη που μεταφέρει την υπό δοκιμή ουσία κατά μήκος του ροφητικού - πορώδους χαρτιού. Οι ουσίες που συνθέτουν το μείγμα συγκρατούνται από το χαρτί με διάφορους τρόπους: μερικές συγκρατούνται καλά από αυτό, ενώ άλλες απορροφώνται πιο αργά και συνεχίζουν να εξαπλώνονται μαζί με το νερό για κάποιο χρονικό διάστημα. Σύντομα, ένα πραγματικό πολύχρωμο χρωματογράφημα θα αρχίσει να απλώνεται σε ένα φύλλο χαρτιού: ένα σημείο του ίδιου χρώματος στο κέντρο, που περιβάλλεται από πολύχρωμους ομόκεντρους δακτυλίους.
Η χρωματογραφία λεπτής στιβάδας έχει γίνει ιδιαίτερα διαδεδομένη στην οργανική ανάλυση. Το πλεονέκτημα της χρωματογραφίας λεπτής στιβάδας είναι ότι είναι δυνατή η χρήση της απλούστερης και πιο ευαίσθητης μεθόδου ανίχνευσης - οπτικού ελέγχου. Κηλίδες αόρατες στο μάτι μπορούν να αναπτυχθούν χρησιμοποιώντας διάφορα αντιδραστήρια, καθώς και με χρήση υπεριώδους φωτός ή αυτοραδιογραφίας.
Στην ανάλυση οργανικών και ανόργανων ουσιών χρησιμοποιείται χρωματογραφία χαρτιού. Έχουν αναπτυχθεί πολυάριθμες μέθοδοι για τον διαχωρισμό πολύπλοκων μιγμάτων ιόντων, όπως μείγματα στοιχείων σπανίων γαιών, προϊόντα σχάσης ουρανίου, στοιχεία της ομάδας της πλατίνας
ΜΕΘΟΔΟΙ ΔΙΑΧΩΡΙΣΜΟΥ ΜΕΙΓΜΑΤΩΝ ΠΟΥ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΣΤΗ ΒΙΟΜΗΧΑΝΙΑ.
Οι μέθοδοι διαχωρισμού μειγμάτων που χρησιμοποιούνται στη βιομηχανία διαφέρουν ελάχιστα από τις εργαστηριακές μεθόδους που περιγράφονται παραπάνω.
Η διόρθωση (απόσταξη) χρησιμοποιείται συχνότερα για τον διαχωρισμό του λαδιού. Αυτή η διαδικασία περιγράφεται λεπτομερέστερα στο θέμα. «Διύλιση πετρελαίου».
Οι πιο συνηθισμένες μέθοδοι καθαρισμού και διαχωρισμού ουσιών στη βιομηχανία είναι η καθίζηση, η διήθηση, η ρόφηση και η εκχύλιση. Οι μέθοδοι διήθησης και καθίζησης πραγματοποιούνται παρόμοια με την εργαστηριακή μέθοδο, με τη διαφορά ότι χρησιμοποιούνται δεξαμενές καθίζησης και φίλτρα μεγάλου όγκου. Τις περισσότερες φορές, αυτές οι μέθοδοι χρησιμοποιούνται για την επεξεργασία των λυμάτων. Επομένως, ας ρίξουμε μια πιο προσεκτική ματιά στις μεθόδους εξαγωγήΚαι ρόφηση.
Ο όρος "εκχύλιση" μπορεί να εφαρμοστεί σε διάφορες ισορροπίες φάσεων (υγρό-υγρό, αέριο-υγρό, υγρό-στερεό, κ.λπ.), αλλά πιο συχνά εφαρμόζεται σε συστήματα υγρού-υγρού, επομένως μπορεί συχνά να βρεθεί ο ακόλουθος ορισμός:
ΟΡΙΣΜΟΣ
Εξαγωγή i - μέθοδος διαχωρισμού, καθαρισμού και απομόνωσης ουσιών, που βασίζεται στη διαδικασία κατανομής μιας ουσίας μεταξύ δύο μη αναμίξιμων διαλυτών.
Ένας από τους μη αναμίξιμους διαλύτες είναι συνήθως νερό, ο άλλος είναι οργανικός διαλύτης, αλλά αυτό δεν απαιτείται. Η μέθοδος εκχύλισης είναι ευέλικτη· είναι κατάλληλη για την απομόνωση σχεδόν όλων των στοιχείων σε διάφορες συγκεντρώσεις. Η εκχύλιση σάς επιτρέπει να διαχωρίζετε πολύπλοκα μείγματα πολλαπλών συστατικών συχνά πιο αποτελεσματικά και πιο γρήγορα από άλλες μεθόδους. Η εκτέλεση ενός διαχωρισμού ή διαχωρισμού εξαγωγής δεν απαιτεί περίπλοκο και ακριβό εξοπλισμό. Η διαδικασία μπορεί να αυτοματοποιηθεί, εάν είναι απαραίτητο, μπορεί να ελεγχθεί εξ αποστάσεως.
ΟΡΙΣΜΟΣ
Ρόφηση- μέθοδος απομόνωσης και καθαρισμού ουσιών που βασίζεται στην απορρόφηση από στερεό σώμα (προσρόφηση) ή υγρό-ροφητικό (απορρόφηση) διαφόρων ουσιών (σορβικά) από μείγματα αερίων ή υγρών.
Τις περισσότερες φορές στη βιομηχανία, χρησιμοποιούνται μέθοδοι απορρόφησης για τον καθαρισμό των εκπομπών αερίου-αέρα από σωματίδια σκόνης ή καπνό, καθώς και από τοξικές αέριες ουσίες. Στην περίπτωση απορρόφησης αερίων ουσιών, μπορεί να συμβεί μια χημική αντίδραση μεταξύ του ροφητικού και της διαλυμένης ουσίας. Για παράδειγμα, όταν απορροφάται αέρια αμμωνίαNH3ένα διάλυμα νιτρικού οξέος HNO 3 σχηματίζει νιτρικό αμμώνιο NH 4 NO 3(νιτρικό αμμώνιο), το οποίο μπορεί να χρησιμοποιηθεί ως πολύ αποτελεσματικό αζωτούχο λίπασμα.
Μέθοδοι διαχωρισμού μειγμάτων
Οι περισσότερες ουσίες στον πλανήτη μας δεν βρίσκονται στην καθαρή τους μορφή, αλλά σε ενώσεις και μείγματα, μαζί με άλλες ουσίες.
Έτσι, η σύνθεση του γρανίτη περιλαμβάνει τρεις ουσίες που είναι ορατές με γυμνό μάτι.
Όμως το γάλα μας φαίνεται ομοιογενές μέχρι να ξινίσει. Θυμώνω
το γάλα διαχωρίζεται σε ένα διαυγές ορό γάλακτος και ένα λευκό στερεό ίζημα - πρωτεΐνη
κασεΐνη. Άνθρωπος πριν από πολύ καιρό χρησιμοποιεί αυτές τις ουσίες , περιλαμβάνονται στο γάλα, αναδεικνύοντάς τα
από το μείγμα. Το τυρόπηγμα παρασκευάζεται από αδιάλυτη πρωτεΐνη - καζεΐνη, και διαλυτό
Οι πρωτεΐνες ορού γάλακτος χρησιμοποιούνται για κλινική διατροφή.
Πώς μπορούν να διαχωριστούν τα μείγματα;
1. Εάν η ουσία είναι αδιάλυτη στο νερό, όπως δημητριακά (ρύζι, φαγόπυρο, σιμιγδάλι κ.λπ.), άμμος ποταμού, κιμωλία, άργιλος, τότε μπορείτε να χρησιμοποιήσετε τη μέθοδο διήθησης.
Διήθηση-διήθηση υγρών (αερίων) μέσω φίλτρου για τον καθαρισμό τους από στερεές ακαθαρσίες.

1. Τοποθέτηση φίλτρου. Το τοποθετούμε σε χωνί βρέχοντάς το λίγο με νερό.
2. Τοποθετήστε το χωνί με το φίλτρο στη φιάλη.
3. Περάστε ένα μείγμα αδιάλυτης ύλης και νερού μέσα από το φίλτρο.
Συμπέρασμα. Νερό καθαρισμένο με διήθηση, περασμένο ελεύθερα μέσα από το φίλτρο. μια ουσία αδιάλυτη στο νερό παραμένει στο φίλτρο.
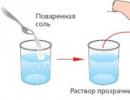
2. Εάν το στερεό είναι διαλυτό στο νερό (αλάτι, ζάχαρη, κιτρικό οξύ), τότε να διαχωριστείμίγματα, μπορεί να χρησιμοποιηθεί η μέθοδος της εξάτμισης.
Εξάτμιση- διαχωρισμός στερεών διαλυμένων σε ένα υγρό με τη μετατροπή του σε ατμό.
Σε ένα ποτήρι νερό, το αλάτι δεν εξαφανίστηκε, αν και έγινε αόρατο - το διάλυμα είναι διαφανές. Η εξάτμιση κατέστησε δυνατή την απομόνωση μιας ουσίας διαλυμένης στο νερό από ένα μείγμα ουσιών (νερό και αλάτι). Στο γυαλί φαίνονται κρύσταλλοι αλατιού. Αυτό επιβεβαιώνει το συμπέρασμα ότι ότι κάθε ουσία (τόσο το νερό όσο και το αλάτι) του μείγματος διατηρεί τις ιδιότητές της.
Συμπέρασμα. Οι διαλυτές ουσίες μπορούν να απομονωθούν από ένα διάλυμα.
3 .Για διαχωρισμό υγρών διαλυτών μεταξύ τους, για λήψη καθαρού (χωρίς ακαθαρσίες) νερού, χρησιμοποιείται η μέθοδος απόσταξης
(ή απόσταξη)
Απόσταξη-απόσταξη, διαχωρισμός ουσιών που περιέχονται σε υγρά μείγματα ανάλογα με τα σημεία βρασμού, ακολουθούμενος από ψύξη του ατμού.
Στη φύση, το νερό στην καθαρή του μορφή (χωρίς άλατα) δεν υπάρχει. Το ωκεάνιο, το θαλάσσιο, το ποτάμι, το πηγάδι και το νερό πηγής είναι ποικιλίες διαλυμάτων αλατιού στο νερό. Ωστόσο, συχνά οι άνθρωποι χρειάζονται καθαρό νερό που δεν περιέχει άλατα (χρησιμοποιείται σε κινητήρες αυτοκινήτων, στη χημική παραγωγή για τη λήψη διαφόρων διαλυμάτων και ουσιών, στην κατασκευή φωτογραφιών). Αυτό το νερό ονομάζεται αποσταγμένο και η μέθοδος λήψης του ονομάζεται απόσταξη.

Ζεσταίνουμε το νερό της βρύσης πάνω από τη φλόγα μιας λάμπας αλκοόλης σε δοκιμαστικό σωλήνα, κλεισμένο με φελλό με σωλήνα εξαγωγής αερίου. Χαμηλώνουμε το άκρο του σωλήνα σε ένα καθαρό, στεγνό δοκιμαστικό σωλήνα τοποθετημένο σε ένα ποτήρι με πάγο. Σταγόνες απεσταγμένου (καθαρισμένου από άλατα και ακαθαρσίες) νερού θα εμφανιστούν στον πυθμένα και στα τοιχώματα ενός δοκιμαστικού σωλήνα σε ένα ποτήρι με πάγο.
Ασκηση
1. Κοιτάξτε σε ένα άδειο βραστήρα στο οποίο βράζει νερό. Υπάρχουν λευκές εναποθέσεις (λέπια) στα τοιχώματα και στον πυθμένα ουσιών που έχουν διαλυθεί στο νερό;
2. Σταγονίδια νερού ρέουν από το καπάκι του βραστήρα στο οποίο βράζουν νερό. Ποιο νερό -στο καπάκι ή στο ίδιο το βραστήρα- περιέχει περισσότερα άλατα; Εξήγησε την απάντησή σου.
3. Πώς ονομάζεται η διαδικασία που φαίνεται στην εικόνα;

4. Εάν το μείγμα περιέχει σίδηρο, τότε μπορεί να χρησιμοποιηθεί μαγνήτης για να το απομονώσει, γιατί. ο σίδηρος και τα κράματά του έλκονται από έναν μαγνήτη.
5. Για να διαχωρίσετε δύο μη αναμίξιμα υγρά (έλαιο και νερό, ηλιέλαιο και νερό), πρέπει να χρησιμοποιήσετε μια διαχωριστική χοάνη.

Το υγρό με μεγαλύτερη πυκνότητα θα συγχωνευθεί σε ένα ποτήρι και ένα ελαφρύτερο υγρό θα παραμείνει στη διαχωριστική χοάνη.