Metody rozdzielania mieszanin. Przygotowanie mieszanin i metody ich rozdzielania. Proces rozdzielania mieszanin ciekłych
Cele Lekcji:
Edukacyjne - Stworzenie warunków do zapoznania się z pojęciem mieszanin jednorodnych i niejednorodnych, substancji czystej jako posiadającej stałe właściwości, wykazania jej odmienności od mieszanin. Pokaż różne metody rozdzielania mieszanin.
Edukacyjne - Stwórz warunki do kształtowania zainteresowania wiedzą, umiejętnościami i odpowiednią oceną swoich działań. Kontynuowanie edukacji ekologicznej i poszanowania środowiska.
Rozwojowe - Stworzenie warunków do dalszego rozwoju umiejętności uczniów w zakresie tworzenia receptur substancji nieorganicznych według nazwy i nazywania substancji wzorami; dalsze doskonalenie umiejętności studentów w zakresie rozpoznawania klas związków nieorganicznych za pomocą wzorów; rozwijanie umiejętności rozpoznawania substancji czystych i mieszanin substancji; wykształcenie umiejętności opracowania planu działania w zakresie rozdzielania mieszanin substancji; rozwijanie umiejętności rozdzielania mieszanin poprzez osadzanie, filtrowanie, użycie magnesu i odparowanie.
Cele dla ucznia:
-znać pojęcie czystej substancji
– zna pojęcia mieszaniny heterogenicznej i jednorodnej
– zna metody rozdzielania mieszanin: osadzanie, filtrowanie, odparowywanie, destylacja
Poznaj nowoczesne metody oczyszczania wody
Potrafić rozdzielać mieszaniny poprzez osadzanie, filtrowanie, użycie magnesu, odparowanie
Podczas zajęć
1. Moment organizacyjny
(organizacja rozpoczęcia lekcji)
Powitanie, stworzenie sprzyjającego tła emocjonalnego, sprawdzenie obecnych, sprawdzenie gotowości do lekcji.
2. Sprawdzenie odrobienia pracy domowej (sprawdzenie pracy domowej)
§ 1
Zadania 7–10
§ 4
3. Wyznaczanie celów, motywacja (przesłanie tematu, cele lekcji)
Temat lekcji: Czyste substancje i mieszaniny. Metody rozdzielania mieszanin.
Jak myślisz, jakie cele możemy wyznaczyć na dzisiejszą lekcję?
(Cele dla ucznia)
Doskonale wiemy, czym jest czystość. Czysty pokój, czysty notatnik, czyste ubrania... Co oznacza pojęcie czystej substancji? Czym różni się czysta substancja od mieszaniny substancji?
4. Aktualizowanie podstawowej wiedzy i umiejętności
Odpowiedzmy na pytania: Jak nazywa się substancja? (Materia to to, z czego zbudowane są ciała fizyczne)
5. Nauka nowego materiału (nauka nowej wiedzy i metod działania)
Czysta substancja.
W dwóch naczyniach podgrzano do wrzenia wodę destylowaną i wodę morską. Po pewnym czasie mierzono temperatury wrzenia w tych naczyniach). Uczniowie omawiają wyniki eksperymentu. Pytanie-problem, które wypowiada nauczyciel, w naturalny sposób nasuwa się samo: „Dlaczego t wz wody morskiej nie jest stałe w różnych okresach czasu w porównaniu z t wz wody destylowanej”. Uczniowie dochodzą do wniosku, że zasolenie wody morskiej wpływa na t kip.Przy pomocy nauczyciela formułuje się definicję: „Substancja czysta to substancja, która ma stałe właściwości fizyczne (temperatura wrzenia, temperatura topnienia, gęstość).
Mieszaniny i ich klasyfikacja
Nauczyciel zaprasza uczniów do obejrzenia mieszanin znajdujących się na stole demonstracyjnym. Następnie chłopaki definiują mieszaninę jako połączenie kilku substancji, które są ze sobą w bezpośrednim kontakcie. Nauczyciel dodaje, że w przyrodzie nie ma substancji absolutnie czystych. Substancje występują głównie w postaci mieszanin. Mówi o powietrzu jako mieszaninie gazów - azotu, tlenu, argonu itp. Zanieczyszczenia powietrza: Zmiany zawartości siarki i dwutlenku siarki w powietrzu prowadzą do żółknięcia lub przebarwienia liści drzew i karłowatości. U ludzi gaz ten podrażnia górne drogi oddechowe. Wzrost zawartości tlenku węgla w powietrzu prowadzi do zmniejszenia zdolności hemoglobiny w czerwonych krwinkach do przenoszenia tlenu, co powoduje spowolnienie reakcji człowieka, osłabienie percepcji, pojawienie się bólów głowy, senności i nudności. Pod wpływem dużych ilości tlenku węgla może nastąpić omdlenie, śpiączka, a nawet śmierć.
Ta mętna ciecz jest mieszaniną wody i kredy. Cząsteczki kredy w mieszance są widoczne gołym okiem. Jednak nie zawsze można zgadnąć z wyglądu, że jest to mieszanina. Na przykład mleko wydaje nam się jednorodne, ale pod mikroskopem zauważamy, że składa się z kropelek cząsteczek tłuszczu i białka unoszących się w roztworze. Czy uważasz, że woda deszczowa jest czystą substancją? A co z powietrzem? Przed tobą dwie szklanki z przezroczystym płynem, jedna zawierająca wodę, a druga wodny roztwór cukru. Cząstek cukru nie można zobaczyć nie tylko gołym okiem, ale nawet za pomocą najpotężniejszego mikroskopu. Zatem mieszaniny są różne. Na jakie dwie grupy można podzielić mieszaniny ze względu na wygląd? (Jednorodne i niejednorodne). Wypełnijmy schemat w kartach pracy. Jakie mieszaniny nazywamy heterogenicznymi? (Mieszaniny heterogeniczne to takie, w których cząstki substancji tworzących mieszaninę można zobaczyć gołym okiem lub przy pomocy mikroskopu.) Jakie mieszaniny można nazwać jednorodnymi? (Mieszaniny jednorodne to takie, w których nawet przy pomocy mikroskopu nie można wykryć cząstek substancji wchodzących w skład mieszaniny.)
Jednorodny - Roztwory cukru w wodzie, NaCl, powietrzu
Heterogeniczny - Mieszanka Fe+S, NaCl i cukru, glinka z wodą
Wstępne sprawdzenie zrozumienia nowej wiedzy
Kochani, czy często spotykamy w przyrodzie czyste substancje? (Nie, mieszaniny substancji są bardziej powszechne).
Przed tobą granit. Co to za mieszanina lub czysta substancja? (Mieszanina).
Jak zgadłeś? (Granit ma strukturę ziarnistą, widoczne są w nim cząsteczki kwarcu, miki i skalenia.)
Podstawowe metody rozdzielania mieszanin.
Doświadczenie demonstracyjne „Rozdzielanie mieszaniny oleju roślinnego i wody”.
Oto mieszanina oleju roślinnego i wody. Określ rodzaj mieszaniny. (Heterogeniczny). Porównaj właściwości fizyczne oleju i wody. (Są to substancje ciekłe, które są w sobie nierozpuszczalne i mają różną gęstość). Zaproponuj metodę rozdzielenia tej mieszaniny. (Sugestie dzieci). Ta metoda nazywa się osadzaniem. Odbywa się to za pomocą rozdzielacza. Wypełnijmy tabelę w kartach pracy „Metody rozdzielania mieszanin heterogenicznych”.
Eksperyment demonstracyjny „Rozdzielanie mieszanin”.
heterogeniczna mieszanina żelaza i siarki. Mieszaninę tę można rozdzielić przez osadzanie, ponieważ siarka i żelazo to ciała stałe nierozpuszczalne w wodzie. Jeśli wlejesz tę mieszaninę do wody, siarka wypłynie na powierzchnię, a żelazo opadnie. Mieszaninę tę można również rozdzielić za pomocą magnesu, ponieważ żelazo przyciąga magnes, ale siarka nie.
Mieszanka piasku i wody. Jest to mieszanina niejednorodna. Rozdzieliliśmy to poprzez filtrację.
Różne sposoby filtrowania mieszanin
Filtrację można przeprowadzić nie tylko za pomocą filtra papierowego. Do filtrowania można również stosować inne materiały sypkie lub porowate. Do materiałów sypkich stosowanych w tej metodzie zalicza się np. piasek kwarcowy. A dla porowatych - wypalana glina i wełna szklana. Istnieje również koncepcja metody „filtrowania na gorąco”. Metodą tą można rozdzielić mieszaniny ciał stałych o różnych temperaturach topnienia.
Roztwór soli w wodzie. Jest to jednorodna mieszanina. Rozdzieliliśmy to przez odparowanie.
Ale nadal istnieją sposoby rozdzielania jednorodnych mieszanin. Jednym z nich jest chromatografia.
Historia odkrycia chromatografii
Chromatografię jako metodę rozdzielania substancji zaproponował w 1903 roku rosyjski botanik M.S. Kolor (1872–1919). Interesowało go zagadnienie, czy naturalny zielony barwnik chlorofil, będący częścią liści roślin, jest substancją indywidualną, czy mieszaniną substancji? Aby się tego dowiedzieć, napełnił szklaną rurkę kredą, dodał do jednego końca roztwór chlorofilu i przemył go rozpuszczalnikiem. Poruszając się wzdłuż rurki, chlorofil utworzył kilka stref różniących się kolorem. W rezultacie naukowiec odkrył, że chlorofil jest mieszaniną substancji. Proponowaną metodę rozdzielania mieszanin nazwał chromatografią. W dosłownym tłumaczeniu oznacza „malowanie kolorami”.
Innym sposobem rozdzielenia jednorodnej mieszaniny jest destylacja lub destylacja.
Historia destylacji
Destylacja w tłumaczeniu z łaciny oznacza „upuszczanie”. Najstarsze opisy obwodu gorzelniczego znajdują się w dziele Marii na temat alchemii (jest to I wiek n.e.). Destylator posiadał naczynie, rurkę wylotową i odbieralnik chłodzony wilgotną gąbką. Dlatego destylacja w nim niskowrzących cieczy była niemożliwa. Do statku można było podłączyć nawet kilka odbiorników z lampami.
7. Utrwalanie wiedzy, kształtowanie umiejętności podstawowych (utrwalanie wiedzy i metod działania)
ZADANIE nr 1
Podaj przykłady mieszanin, które można rozdzielić poprzez filtrację i osadzanie. Zapisz swoją odpowiedź w tabeli.
ZADANIE nr 2
Zgnieciony korek przypadkowo dostał się do cukru. Jak oczyścić z niego cukier?
ZADANIE nr 3
Podaj przykład mieszaniny składającej się z trzech substancji i podaj kolejność czynności niezbędnych do ich rozdzielenia.
8. Generalizacja i systematyzacja wiedzy
W ten sposób, chłopaki, zapoznaliśmy się z głównymi metodami oczyszczania substancji (wymień je). Wyciągnij ogólny wniosek: na czym zawsze polega rozdzielanie mieszanin? Czy substancje w mieszaninach zachowują swoje właściwości? Pisanie w notesie: w mieszaninach substancje zachowują swoje indywidualne właściwości. Rozdzielenie mieszanin opiera się na różnicach we właściwościach fizycznych substancji wchodzących w skład mieszaniny.
9. Kontrola i samosprawdzanie wiedzy
Korzystając z tabeli, określ sprzęt niezbędny do rozdzielenia wskazanych w niej mieszanin. Z liter odpowiadających poprawnym odpowiedziom utworzysz nazwę kolejnej metody otrzymywania czystych substancji.
|
Nazwa sprzętu |
Skład mieszaniny |
|||
|
Olej słonecznikowy i woda |
Glina i woda |
Woda morska |
Żelazo i miedź |
|
|
Lejek chemiczny |
||||
|
Lejek rozdzielający |
||||
|
Zlewka |
||||
|
Lampka alkoholowa |
||||
|
Filtr |
||||
|
Porcelanowy kubek |
||||
|
Magnes |
||||
10. Podsumowanie lekcji
Sprawdzenie zagadki, Oceny za pracę na lekcji.
Na mapie nie ma białych plam,
Cała Ziemia od dawna jest otwarta,
Ale najodważniejsi czekają
Prawdziwe odkrycia!
11. Refleksja
Czego nowego nauczyłeś się dzisiaj na zajęciach?
Co pamiętasz?
Co Ci się podobało, a co nie sprawdziło się Twoim zdaniem?
12. Informacja o zadaniach domowych i instrukcja ich odrabiania (zadanie domowe, konsultacja w sprawie pracy domowej)
§ 2
Zadania 2, 4–6
Znać definicje pojęć: substancje czyste, mieszaniny jednorodne i niejednorodne; istota każdej metody rozdzielania mieszanin. Odpowiedz na pytania 2, 4-6. Opcjonalnie: przygotuj wiadomość na temat „Zastosowanie metod analizy chemicznej w pracy kryminologów, archeologów, lekarzy, historyków sztuki” lub utwórz krzyżówkę, wykorzystując pojęcia z dzisiejszej lekcji i nazwy sprzętu niezbędnego do rozdzielania mieszanin.
Blok teoretyczny.
Definicja pojęcia „mieszanina” została podana w XVII wieku. Angielski naukowiec Robert Boyle: „Mieszanina jest integralnym systemem składającym się z heterogenicznych składników.”
Charakterystyka porównawcza mieszaniny i czystej substancji
Znaki porównania | Czysta substancja | Mieszanina |
Stały | Zmienny |
|
Substancje | To samo | Różny |
Właściwości fizyczne | Stały | Zmienny |
Zmiana energii podczas formowania | Wydarzenie | Nie dzieje się |
Separacja | Poprzez reakcje chemiczne | Metodami fizycznymi |
Mieszanki różnią się między sobą wyglądem.
Klasyfikację mieszanin przedstawiono w tabeli:
Podajmy przykłady zawiesin (piasek rzeczny + woda), emulsji (olej roślinny + woda) i roztworów (powietrze w kolbie, sól kuchenna + woda, drobnostka: aluminium + miedź lub nikiel + miedź).
Metody rozdzielania mieszanin
W przyrodzie substancje występują w postaci mieszanin. Do badań laboratoryjnych, produkcji przemysłowej oraz na potrzeby farmakologii i medycyny potrzebne są czyste substancje.
Do oczyszczania substancji stosuje się różne metody rozdzielania mieszanin.
Odparowanie to oddzielenie substancji stałych rozpuszczonych w cieczy poprzez przekształcenie jej w parę.

Destylacja- destylacja, rozdzielanie substancji zawartych w ciekłych mieszaninach według temperatur wrzenia, a następnie chłodzenie pary.
W przyrodzie woda nie występuje w czystej postaci (bez soli). Woda oceaniczna, morska, rzeczna, studniowa i źródlana to rodzaje roztworów soli w wodzie. Jednak ludzie często potrzebują czystej wody, niezawierającej soli (stosowanej w silnikach samochodowych, w produkcji chemicznej do otrzymywania różnych roztworów i substancji, przy robieniu fotografii). Taka woda nazywana jest destylowaną, a sposób jej otrzymywania nazywa się destylacją.

Filtracja - przecedzanie cieczy (gazów) przez filtr w celu oczyszczenia ich z zanieczyszczeń stałych.

Metody te opierają się na różnicach we właściwościach fizycznych składników mieszaniny.
Rozważ metody separacji heterogenicznyi jednorodne mieszaniny.
Przykład mieszaniny | Metoda separacji |
Zawieszenie - mieszanina piasku rzecznego i wody | Rzecznictwo Separacja obrona w oparciu o różne gęstości substancji. Cięższy piasek osiada na dnie. Można także oddzielić emulsję: oddzielić olej lub olej roślinny od wody. W laboratorium można to zrobić za pomocą rozdzielacza. Górną, jaśniejszą warstwę tworzy ropa naftowa lub olej roślinny. W wyniku osiadania z mgły wypada rosa, z dymu osadza się sadza, a w mleku osadza się śmietanka. Rozdzielanie mieszaniny wody i oleju roślinnego poprzez osadzanie |
Mieszanka piasku i soli kuchennej w wodzie | Filtrowanie Na jakiej podstawie można rozdzielać mieszaniny heterogeniczne filtracja?O różnej rozpuszczalności substancji w wodzie i o różnej wielkości cząstek. Przez pory filtra przechodzą tylko cząstki substancji porównywalnych z nimi, natomiast większe cząstki zatrzymują się na filtrze. W ten sposób można rozdzielić niejednorodną mieszaninę soli kuchennej i piasku rzecznego. Jako filtry można zastosować różne substancje porowate: watę, węgiel, wypalaną glinę, prasowane szkło i inne. Metoda filtracji jest podstawą działania urządzeń gospodarstwa domowego, takich jak odkurzacze. Jest używany przez chirurgów - bandaże z gazy; wiertnicy i pracownicy wind - maski oddechowe. Za pomocą sitka do herbaty, aby przefiltrować liście herbaty, Ostap Bender, bohater dzieła Ilfa i Pietrowa, zdołał zabrać jedno z krzeseł Ogrzycy Ellochce („Dwanaście Krzeseł”). Oddzielenie mieszaniny skrobi i wody przez filtrację |
Mieszanka proszku żelaza i siarki | Działanie za pomocą magnesu lub wody Proszek żelaza był przyciągany przez magnes, ale proszek siarki nie. Niezwilżalny proszek siarki unosił się na powierzchnię wody, a ciężki zwilżalny proszek żelaza osiadał na dnie. Rozdzielanie mieszaniny siarki i żelaza za pomocą magnesu i wody |
Roztwór soli w wodzie jest mieszaniną jednorodną | Parowanie lub krystalizacja Woda wyparowuje, pozostawiając w porcelanowej filiżance kryształki soli. Po odparowaniu wody z jezior Elton i Baskunchak otrzymuje się sól kuchenną. Ta metoda separacji opiera się na różnicy temperatur wrzenia rozpuszczalnika i substancji rozpuszczonej. Jeśli substancja, na przykład cukier, rozkłada się po podgrzaniu, wówczas woda nie odparowuje całkowicie - roztwór odparowuje, a następnie z nasyconego roztworu wytrącają się kryształki cukru. Czasami konieczne jest usunięcie zanieczyszczeń z rozpuszczalników o niższej temperaturze wrzenia, np. soli z wody. W takim przypadku pary substancji należy zebrać, a następnie po ochłodzeniu skroplić. Ta metoda rozdzielania jednorodnej mieszaniny nazywa się destylacja lub destylacja. W specjalnych urządzeniach - gorzelnikach uzyskuje się wodę destylowaną, która wykorzystywana jest na potrzeby farmakologii, laboratoriów i układów chłodzenia samochodów. W domu możesz zbudować taki destylator: Jeśli rozdzielisz mieszaninę alkoholu i wody, to najpierw oddestyluje się alkohol o temperaturze wrzenia = 78 °C (zebrany w probówce odbiorczej), a w probówce pozostanie woda. Destylacja służy do produkcji benzyny, nafty i oleju napędowego z ropy naftowej. Rozdzielanie mieszanin jednorodnych |
Specjalną metodą rozdzielania składników, polegającą na różnym ich wchłanianiu przez określoną substancję, jest chromatografia.
Za pomocą chromatografii rosyjski botanik jako pierwszy wyizolował chlorofil z zielonych części roślin. W przemyśle i laboratoriach zamiast bibuły filtracyjnej do chromatografii stosuje się skrobię, węgiel, wapień i tlenek glinu. Czy zawsze wymagane są substancje o tym samym stopniu oczyszczenia?
Do różnych celów wymagane są substancje o różnym stopniu oczyszczenia. Wodę do gotowania należy pozostawić do odstania, aby usunąć zanieczyszczenia i chlor stosowany do jej dezynfekcji. Wodę do picia należy najpierw zagotować. A w laboratoriach chemicznych do przygotowywania roztworów i przeprowadzania eksperymentów, w medycynie potrzebna jest woda destylowana, oczyszczona w jak największym stopniu z rozpuszczonych w niej substancji. Szczególnie czyste substancje, w których zawartość zanieczyszczeń nie przekracza jednej milionowej procenta, znajdują zastosowanie w elektronice, półprzewodnikach, technologii nuklearnej i innych gałęziach przemysłu precyzyjnego.
Metody wyrażania składu mieszanin.
· Udział masowy składnika w mieszaninie- stosunek masy składnika do masy całej mieszaniny. Zwykle udział masowy wyraża się w %, ale nie jest to konieczne.
ω ["omega"] = mskładnik / mieszanina
· Udział molowy składnika w mieszaninie- stosunek liczby moli (ilości substancji) składnika do całkowitej liczby moli wszystkich substancji w mieszaninie. Na przykład, jeśli mieszanina zawiera substancje A, B i C, to:
χ [„chi”] składnik A = nskładnik A / (n(A) + n(B) + n(C))
· Stosunek molowy składników. Czasami problemy związane z mieszaniną wskazują na stosunek molowy jej składników. Na przykład:
nskładnik A: nskładnik B = 2: 3
· Udział objętościowy składnika w mieszaninie (tylko dla gazów)- stosunek objętości substancji A do całkowitej objętości całej mieszaniny gazowej.
φ ["phi"] = Vskładnik / Vmieszanina
Praktyczny blok.
Przyjrzyjmy się trzem przykładom problemów, z którymi reagują mieszaniny metali sól kwas:
Przykład 1.Po wystawieniu mieszaniny miedzi i żelaza o masie 20 g na działanie nadmiaru kwasu solnego uwolniło się 5,6 litra gazu (nie dotyczy). Określ udziały masowe metali w mieszaninie.
W pierwszym przykładzie miedź nie reaguje z kwasem solnym, to znaczy, gdy kwas reaguje z żelazem, wydziela się wodór. Zatem znając objętość wodoru, możemy od razu znaleźć ilość i masę żelaza. I odpowiednio ułamki masowe substancji w mieszaninie.
Rozwiązanie przykładu 1.
n = V / Vm = 5,6 / 22,4 = 0,25 mol.
2. Zgodnie z równaniem reakcji:
3. Ilość żelaza wynosi również 0,25 mola. Możesz znaleźć jego masę:
mFe = 0,25 · 56 = 14 g.
Odpowiedź: 70% żelaza, 30% miedzi.
Przykład 2.Kiedy mieszaninę glinu i żelaza o masie 11 g poddano działaniu nadmiaru kwasu solnego, uwolniło się 8,96 litra gazu (nr). Określ udziały masowe metali w mieszaninie.
W drugim przykładzie reakcja jest taka Zarówno metal Tutaj wodór jest już uwolniony z kwasu w obu reakcjach. Dlatego nie można tu zastosować bezpośrednich obliczeń. W takich przypadkach wygodnie jest rozwiązać problem za pomocą bardzo prostego układu równań, przyjmując x jako liczbę moli jednego z metali, a y jako ilość substancji drugiego.
Rozwiązanie przykładu 2.
1. Znajdź ilość wodoru:
n = V / Vm = 8,96 / 22,4 = 0,4 mol.
2. Niech ilość glinu będzie wynosić x moli, a ilość żelaza będzie x moli. Następnie możemy wyrazić ilość uwolnionego wodoru w kategoriach x i y:
2HCl = FeCl2+ |
4. Znamy całkowitą ilość wodoru: 0,4 mol. Oznacza,
1,5x + y = 0,4 (jest to pierwsze równanie w układzie).
5. W przypadku mieszaniny metali należy wyrazić szerokie rzesze poprzez ilość substancji.
m = Mn
A więc masa aluminium
mAl = 27x,
masa żelaza
mFe = 56у,
i masę całej mieszaniny
27x + 56y = 11 (jest to drugie równanie w układzie).
6. Mamy więc układ dwóch równań:
7. O wiele wygodniej jest rozwiązywać takie układy metodą odejmowania, mnożąc pierwsze równanie przez 18:
27x + 18 lat = 7,2
i odejmując pierwsze równanie od drugiego:
8. (56 - 18)y = 11 - 7,2
y = 3,8 / 38 = 0,1 mol (Fe)
x = 0,2 mola (Al)
mFe = n M = 0,1 · 56 = 5,6 g
mAl = 0,2 · 27 = 5,4 g
ωFe = mFe / mmmieszanina = 5,6 / 11 = 0,50,91%),
odpowiednio,
ωAl = 100% − 50,91% = 49,09%
Odpowiedź: 50,91% żelaza, 49,09% aluminium.
Przykład 3.16 g mieszaniny cynku, glinu i miedzi zadano nadmiarem roztworu kwasu solnego. W tym przypadku wydzieliło się 5,6 litra gazu (n.o.), a 5 g substancji nie uległo rozpuszczeniu. Określ udziały masowe metali w mieszaninie.
W trzecim przykładzie dwa metale reagują, ale trzeci metal (miedź) nie reaguje. Dlatego pozostała część 5 g to masa miedzi. Ilości pozostałych dwóch metali – cynku i aluminium (należy pamiętać, że ich łączna masa wynosi 16 − 5 = 11 g) można wyznaczyć korzystając z układu równań, jak w przykładzie nr 2.
Odpowiedź na przykład 3: 56,25% cynku, 12,5% aluminium, 31,25% miedzi.
Przykład 4.Mieszaninę żelaza, aluminium i miedzi potraktowano nadmiarem zimnego stężonego kwasu siarkowego. W tym przypadku część mieszaniny uległa rozpuszczeniu i wydzieliło się 5,6 litra gazu (n.o.). Pozostałą mieszaninę potraktowano nadmiarem roztworu wodorotlenku sodu. Wydzieliło się 3,36 litra gazu i pozostało 3 g nierozpuszczonej pozostałości. Określ masę i skład początkowej mieszaniny metali.
W tym przykładzie musimy o tym pamiętać zimny skoncentrowany kwas siarkowy nie reaguje z żelazem i aluminium (pasywacja), ale reaguje z miedzią. Powoduje to uwolnienie tlenku siarki (IV).
Z alkaliami reaguje tylko aluminium- metal amfoteryczny (oprócz aluminium, cynku i cyny rozpuszczają się również w zasadach, a beryl można również rozpuścić w gorących stężonych zasadach).
Rozwiązanie przykładu 4.
1. Tylko miedź reaguje ze stężonym kwasem siarkowym, liczba moli gazu:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
2H2SO4 (stężony) = CuSO4 + |
2. (nie zapominaj, że takie reakcje należy wyrównać za pomocą wagi elektronicznej)
3. Ponieważ stosunek molowy miedzi i dwutlenku siarki wynosi 1:1, wówczas miedź również wynosi 0,25 mola. Można znaleźć masę miedzi:
mCu = n M = 0,25 64 = 16 g.
4. Aluminium reaguje z roztworem alkalicznym, tworząc hydroksykompleks glinu i wodoru:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Liczba moli wodoru:
nH2 = 3,36 / 22,4 = 0,15 mola,
stosunek molowy glinu i wodoru wynosi 2:3, a zatem
nAl = 0,15 / 1,5 = 0,1 mol.
Waga aluminium:
mAl = n M = 0,1 27 = 2,7 g
6. Pozostałość to żelazo o wadze 3 g. Masę mieszaniny można znaleźć:
mieszanka = 16 + 2,7 + 3 = 21,7 g.
7. Ułamki masowe metali:
ωCu = mCu / mmmieszanina = 16 / 21,7 = 0,7,73%)
ωAl = 2,7 / 21,7 = 0,1,44%)
ωFe = 13,83%
Odpowiedź: 73,73% miedzi, 12,44% aluminium, 13,83% żelaza.
Przykład 5.21,1 g mieszaniny cynku i glinu rozpuszczono w 565 ml roztworu kwasu azotowego zawierającego 20% wag. % НNO3 i mający gęstość 1,115 g/ml. Objętość wydzielonego gazu, który jest substancją prostą i jedynym produktem redukcji kwasu azotowego, wynosiła 2,912 l (nr). Określ skład powstałego roztworu w procentach masowych. (RHTU)
Tekst tego problemu wyraźnie wskazuje produkt redukcji azotu – „substancję prostą”. Ponieważ kwas azotowy z metalami nie wytwarza wodoru, jest to azot. Obydwa metale rozpuszczone w kwasie.
Problem nie dotyczy składu początkowej mieszaniny metali, ale składu powstałego roztworu po reakcjach. To utrudnia zadanie.
Rozwiązanie przykładu 5.
1. Określ ilość substancji gazowej:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 mol.
2. Określ masę roztworu kwasu azotowego, masę i ilość rozpuszczonego HNO3:
mrozwiązanie = ρ V = 1,115 565 = 630,3 g
mHNO3 = ω mroztwór = 0,2 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mole
Należy pamiętać, że skoro metale całkowicie się rozpuściły, oznacza to - zdecydowanie było dość kwasu(metale te nie reagują z wodą). W związku z tym konieczne będzie sprawdzenie Czy jest za dużo kwasu? i ile go pozostało po reakcji w powstałym roztworze.
3. Układamy równania reakcji ( nie zapomnij o wadze elektronicznej) i dla wygody obliczeń przyjmujemy, że 5x to ilość cynku, a 10y to ilość aluminium. Następnie, zgodnie ze współczynnikami w równaniach, azot w pierwszej reakcji będzie wynosić x mol, a w drugiej - 3y mol:
12HNO3 = 5Zn(NO3)2 + |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3 + |
Al0 − 3e = Al3+ | ||
5. Następnie biorąc pod uwagę, że masa mieszaniny metali wynosi 21,1 g, ich masy molowe wynoszą 65 g/mol dla cynku i 27 g/mol dla aluminium, otrzymujemy następujący układ równań:
6. Wygodnie jest rozwiązać ten układ, mnożąc pierwsze równanie przez 90 i odejmując pierwsze równanie od drugiego.
7. x = 0,04, co oznacza nZn = 0,04 5 = 0,2 mol
y = 0,03, co oznacza nAl = 0,03 10 = 0,3 mol
8. Sprawdź masę mieszanki:
0,2 65 + 0,3 27 = 21,1 g.
9. Przejdźmy teraz do składu rozwiązania. Wygodnie będzie ponownie zapisać reakcje i zapisać nad reakcjami ilości wszystkich przereagowanych i powstałych substancji (z wyjątkiem wody):
10. Następne pytanie: czy w roztworze pozostał kwas azotowy i ile go zostało?
Zgodnie z równaniami reakcji ilość kwasu, która przereagowała:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
tzn. kwasu było w nadmiarze i możesz obliczyć jego resztę w roztworze:
nHNO3res. = 2 - 1,56 = 0,44 mola.
11. A więc w ostateczne rozwiązanie zawiera:
azotan cynku w ilości 0,2 mola:
mZn(NO3)2 = n M = 0,2 · 189 = 37,8 g
azotan glinu w ilości 0,3 mola:
mAl(NO3)3 = n M = 0,3 213 = 63,9 g
nadmiar kwasu azotowego w ilości 0,44 mola:
mHNO3reszta. = n M = 0,44 63 = 27,72 g
12. Jaka jest masa roztworu końcowego?
Pamiętajmy, że na masę końcowego roztworu składają się składniki, które wymieszaliśmy (roztwory i substancje) minus produkty reakcji, które opuściły roztwór (osady i gazy):
13.
Następnie dla naszego zadania:
14. mnowy roztwór = masa roztworu kwasu + masa stopu metalu - masa azotu
mN2 = n M = 28 (0,03 + 0,09) = 3,36 g
nowy roztwór = 630,3 + 21,1 - 3,36 = 648,04 g
ωZn(NO3)2 = mv-va / mr-ra = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mv-va / mr-ra = 63,9 / 648,04 = 0,0986
ωHNO3reszta. = mv-va / mr-ra = 27,72 / 648,04 = 0,0428
Odpowiedź: 5,83% azotan cynku, 9,86% azotan glinu, 4,28% kwas azotowy.
Przykład 6.Gdy 17,4 g mieszaniny miedzi, żelaza i aluminium potraktowano nadmiarem stężonego kwasu azotowego, uwolniło się 4,48 litra gazu (niewymienionego), a gdy tę mieszaninę wystawiono na działanie tej samej masy nadmiaru kwasu solnego, wypłynęło 8,96 litra gazu gaz (nie) został uwolniony. y.). Określ skład mieszaniny początkowej. (RHTU)
Rozwiązując ten problem, musimy po pierwsze pamiętać, że stężony kwas azotowy z nieaktywnym metalem (miedzią) wytwarza NO2, natomiast żelazo i aluminium nie reagują z nim. Przeciwnie, kwas solny nie reaguje z miedzią.
Odpowiedź na przykład 6: 36,8% miedzi, 32,2% żelaza, 31% aluminium.
Problemy do samodzielnego rozwiązania.
1. Proste zadania z dwoma składnikami mieszaniny.
1-1. Mieszaninę miedzi i aluminium o masie 20 g potraktowano 96% roztworem kwasu azotowego i wydzieliło się 8,96 litra gazu (nie dotyczy). Określ udział masowy aluminium w mieszaninie.
1-2. Mieszaninę miedzi i cynku o masie 10 g potraktowano stężonym roztworem alkalicznym. W tym przypadku wyemitowano 2,24 litra gazu (nr). Oblicz udział masowy cynku w początkowej mieszaninie.
1-3. Mieszaninę magnezu i tlenku magnezu o masie 6,4 g potraktowano odpowiednią ilością rozcieńczonego kwasu siarkowego. W tym przypadku wyemitowano 2,24 litra gazu (n.o.). Znajdź udział masowy magnezu w mieszaninie.
1-4. Mieszaninę cynku i tlenku cynku o masie 3,08 g rozpuszczono w rozcieńczonym kwasie siarkowym. Otrzymaliśmy siarczan cynku o masie 6,44 g. Oblicz udział masowy cynku w wyjściowej mieszaninie.
1-5. Po wystawieniu mieszaniny proszków żelaza i cynku o masie 9,3 g na działanie nadmiaru roztworu chlorku miedzi(II) powstało 9,6 g miedzi. Określ skład mieszaniny początkowej.
1-6. Jaka masa 20% roztworu kwasu solnego będzie potrzebna do całkowitego rozpuszczenia 20 g mieszaniny cynku i tlenku cynku, jeśli uwolni się wodór w objętości 4,48 l (nr.)?
1-7. Po rozpuszczeniu 3,04 g mieszaniny żelaza i miedzi w rozcieńczonym kwasie azotowym uwalnia się tlenek azotu (II) o objętości 0,896 l (nr.). Określ skład mieszaniny początkowej.
1-8. Po rozpuszczeniu 1,11 g mieszaniny opiłków żelaza i aluminium w 16% roztworze kwasu solnego (ρ = 1,09 g/ml) wydzieliło się 0,672 litra wodoru (nie dotyczy). Znajdź ułamki masowe metali w mieszaninie i określ objętość zużytego kwasu solnego.
2. Zadania są bardziej złożone.
2-1. Mieszaninę wapnia i glinu o masie 18,8 g kalcynowano bez powietrza z nadmiarem proszku grafitowego. Produkt reakcji potraktowano rozcieńczonym kwasem solnym i uwolniono 11,2 litra gazu (n.o.). Określ udziały masowe metali w mieszaninie.
2-2. Do rozpuszczenia 1,26 g stopu magnezowo-aluminiowego użyto 35 ml 19,6% roztworu kwasu siarkowego (ρ = 1,1 g/ml). Nadmiar kwasu przereagował z 28,6 ml roztworu wodorowęglanu potasu o stężeniu 1,4 mol/l. Określ udział masowy metali w stopie i objętość gazu (nr.) uwolnionego podczas rozpuszczania stopu.
Jeżeli zdyspergowane cząstki są powoli uwalniane z ośrodka lub konieczne jest wstępne sklarowanie układu heterogenicznego, stosuje się metody takie jak flokulacja, flotacja, klasyfikacja, koagulacja itp.
Koagulacja to proces adhezji cząstek w układach koloidalnych (emulsjach lub zawiesinach) z utworzeniem agregatów. Adhezja zachodzi w wyniku zderzenia cząstek podczas ruchu Browna. Koagulacja odnosi się do spontanicznego procesu, który ma tendencję do przechodzenia w stan o niższej energii swobodnej. Próg krzepnięcia to minimalne stężenie podanej substancji powodujące krzepnięcie. Sztucznie koagulację można przyspieszyć dodając do układu koloidalnego specjalne substancje - koagulatory, a także przykładając do układu pole elektryczne (elektrokoagulacja), działanie mechaniczne (wibracje, mieszanie) itp.
Podczas koagulacji do wydzielonej heterogenicznej mieszaniny często dodaje się koagulanty chemiczne, które niszczą solwatowane powłoki, redukując jednocześnie część dyfuzyjną podwójnej warstwy elektrycznej znajdującej się na powierzchni cząstek. Ułatwia to aglomerację cząstek i tworzenie agregatów. Tym samym, w wyniku powstawania większych frakcji fazy rozproszonej, następuje przyspieszenie osadzania cząstek. Jako koagulanty stosuje się sole żelaza, glinu lub sole innych metali wielowartościowych.
Peptyzacja to proces odwrotnej koagulacji, który polega na rozkładzie agregatów na cząstki pierwotne. Peptyzację przeprowadza się poprzez dodanie substancji peptyzujących do ośrodka dyspersyjnego. Proces ten sprzyja dezagregacji substancji na cząstki pierwotne. Środkami peptyzującymi mogą być środki powierzchniowo czynne lub elektrolity, takie jak kwasy humusowe lub chlorek żelazowy. Proces peptyzacji służy do otrzymywania ciekłych układów zdyspergowanych z past lub proszków.
Flokulacja z kolei jest rodzajem koagulacji. W tym procesie małe cząstki zawieszone w środowisku gazowym lub ciekłym tworzą kłaczkowate agregaty zwane kłaczkami. Jako flokulanty stosuje się rozpuszczalne polimery, na przykład polielektrolity. Substancje tworzące kłaczki podczas flokulacji można łatwo usunąć poprzez filtrację lub osadzanie. Flokulacja stosowana jest do uzdatniania wody i oddzielania wartościowych substancji ze ścieków, a także do wzbogacania w składniki mineralne. W przypadku uzdatniania wody flokulanty stosuje się w niskich stężeniach (od 0,1 do 5 mg/l).
W celu zniszczenia agregatów w układach ciekłych stosuje się dodatki indukujące na cząstkach ładunki uniemożliwiające ich wzajemne zbliżanie się. Efekt ten można uzyskać także poprzez zmianę pH środowiska. Ta metoda nazywa się deflokulacją.
Flotacja to proces oddzielania stałych cząstek hydrofobowych od fazy ciekłej ciągłej poprzez selektywne mocowanie ich na granicy faz ciekłej i gazowej (powierzchnia kontaktu cieczy i gazu lub powierzchnia pęcherzyków w fazie ciekłej). cząstki stałe i wtrącenia gazowe są usuwane z powierzchni fazy ciekłej. Proces ten służy nie tylko do usuwania cząstek fazy rozproszonej, ale także do oddzielania różnych cząstek ze względu na różnice w ich zwilżalności. W tym procesie cząstki hydrofobowe są mocowane na granicy faz i oddzielane od cząstek hydrofilowych, które osiadają na dnie. Najlepsze wyniki flotacji uzyskuje się, gdy wielkość cząstek wynosi od 0,1 do 0,04 mm.
Istnieje kilka rodzajów flotacji: pianka, olej, folia itp. Najbardziej powszechną metodą jest flotacja piany. Proces ten umożliwia wyniesienie cząstek poddanych działaniu odczynników na powierzchnię wody za pomocą pęcherzyków powietrza. Pozwala to na wytworzenie warstwy piany, której trwałość reguluje się za pomocą koncentratu piany.
Klasyfikacja stosowana jest w urządzeniach o zmiennym przekroju. Za jego pomocą można oddzielić pewną liczbę małych cząstek od głównego produktu, składającego się z dużych cząstek. Klasyfikacja odbywa się za pomocą wirówek i hydrocyklonów ze względu na działanie siły odśrodkowej.
Bardzo obiecującą metodą jest rozdział zawiesin za pomocą obróbki magnetycznej układu. Woda poddana działaniu pola magnetycznego przez długi czas zachowuje zmienione właściwości, np. zmniejszoną zdolność zwilżania. Proces ten umożliwia zintensyfikowanie separacji zawiesin.
Z metody rozdzielania mieszanin (zarówno heterogenicznych, jak i jednorodnych) polegają na tym, że substancje zawarte w mieszaninie zachowują swoje indywidualne właściwości. Mieszaniny heterogeniczne mogą różnić się składem i stanem fazowym, na przykład: gaz + ciecz; ciało stałe + ciecz; dwie niemieszające się ciecze itp. Główne metody rozdzielania mieszanin przedstawiono na poniższym schemacie. Rozważmy każdą metodę osobno.
Rozdzielanie mieszanin heterogenicznych
Dla rozdzielanie mieszanin heterogenicznych, reprezentujących układy ciało stałe-ciecz lub ciało stałe-gaz, istnieją trzy główne metody:
- filtrowanie,
- osadzanie (dekantowanie,
- separacja magnetyczna
FILTROWANIE
metoda oparta na różnej rozpuszczalności substancji i różnej wielkości cząstek składników mieszaniny. Filtracja pozwala na oddzielenie ciała stałego od cieczy lub gazu.
Do filtrowania cieczy można użyć bibuły filtracyjnej, którą zwykle składa się na cztery części i wkłada do szklanego lejka. Lejek umieszcza się w szklance, w której się gromadzi przesącz- ciecz przechodząca przez filtr.
Rozmiar porów w bibule filtracyjnej jest taki, że umożliwia swobodny przepływ cząsteczek wody i substancji rozpuszczonych. Cząsteczki większe niż 0,01 mm zatrzymują się na filtrze i nie są zatrzymywaneprzejść przez nią, tworząc w ten sposób warstwę osadu.
Pamiętać! Za pomocą filtracji nie da się wydzielić prawdziwych roztworów substancji, czyli roztworów, w których nastąpiło rozpuszczenie na poziomie cząsteczek lub jonów.
Oprócz bibuły filtracyjnej laboratoria chemiczne stosują specjalne filtry
różne rozmiary porów.
Filtracja mieszanin gazowych nie różni się zasadniczo od filtrowania cieczy. Jedyna różnica polega na tym, że przy filtrowaniu gazów z zawieszonych cząstek stałych (SPM) stosuje się filtry o specjalnej konstrukcji (papierowe, węglowe) oraz pompy, które przetłaczają mieszaninę gazów przez filtr, np. filtrując powietrze w samochodzie lub okapie wydechowym nad piecem.
Można oddzielić przez filtrowanie:
- zboża i woda,
- kreda i woda
- piasek i woda itp.
- kurz i powietrze (różne konstrukcje odkurzaczy)
OSADA
Metoda opiera się na różnym tempie osiadania cząstek stałych o różnej masie (gęstości) w środowisku cieczy lub powietrza. Metodę tę stosuje się do rozdzielenia dwóch lub więcej substancji stałych nierozpuszczalnych w wodzie (lub innym rozpuszczalniku). Mieszaninę substancji nierozpuszczalnych umieszcza się w wodzie i dokładnie miesza. Po pewnym czasie substancje o gęstości większej niż jeden osiadają na dnie naczynia, a substancje o gęstości mniejszej niż jeden wypływają na powierzchnię. Jeśli w mieszaninie znajduje się kilka substancji o różnym ciężarze, wówczas w dolnej warstwie osiądą substancje cięższe, a następnie lżejsze. Warstwy takie można również rozdzielać. Wcześniej w ten sposób izolowano ziarna złota z pokruszonej skały złotonośnej. Złotonośny piasek umieszczano na pochyłym rowie, przez który uwalniał się strumień wody. Strumień wody podniósł i uniósł skałę płonną, a ciężkie ziarna złota osiadły na dnie rowu. W przypadku mieszanin gazowych cząstki stałe osadzają się również na twardych powierzchniach, np. kurz osiada na meblach czy liściach roślin.
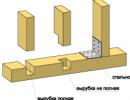
Metodę tę można również stosować do oddzielania niemieszających się cieczy. Aby to zrobić, użyj rozdzielacza.
Na przykład, aby oddzielić benzynę od wody, mieszaninę umieszcza się w rozdzielaczu i czeka, aż pojawi się wyraźna granica faz. Następnie ostrożnie odkręć kran i woda zacznie spływać do szklanki.
Mieszaniny można rozdzielić przez osadzanie:
- piasek i glina rzeczna,
- ciężki krystaliczny osad z roztworu
- olej i woda
- olej roślinny i woda itp.
SEPARACJA MAGNETYCZNA
Metoda opiera się na różnych właściwościach magnetycznych stałych składników mieszaniny. Metodę tę stosuje się, gdy mieszanina zawiera substancje ferromagnetyczne, czyli substancje o właściwościach magnetycznych, takie jak żelazo.
Wszystkie substancje ze względu na pole magnetyczne można podzielić na trzy duże grupy:
- feromagnetyki: przyciągany przez magnes - Fe, Co, Ni, Gd, Dy
- paramagnetyki: słabo przyciągany - Al, Cr, Ti, V, W, Mo
- materiały diamagnetyczne: łuszczone magnetycznie - Cu, Ag, Au, Bi, Sn, mosiądz
Separacja magnetyczna może się rozdzielić B:
- siarka i proszek żelaza
- sadza i żelazo itp.
Rozdzielanie mieszanin jednorodnych
Dla rozdzielanie ciekłych mieszanin jednorodnych (roztwory prawdziwe) użyj następujących metod:
- parowanie (krystalizacja),
- destylacja (destylacja),
- chromatografia.
ODPAROWANIE. KRYSTALIZACJA.
Metoda opiera się na różnych temperaturach wrzenia rozpuszczalnika i substancji rozpuszczonej. Służy do oddzielania rozpuszczalnych substancji stałych od roztworów. Odparowanie zwykle przeprowadza się w następujący sposób: roztwór wlewa się do porcelanowego kubka i podgrzewa, ciągle mieszając roztwór. Woda stopniowo odparowuje, a na dnie kubka pozostaje osad.
DEFINICJA
Krystalizacja- przejście fazowe substancji ze stanu gazowego (pary), ciekłego lub stałego amorficznego do stanu krystalicznego.
W takim przypadku odparowaną substancję (wodę lub rozpuszczalnik) można zebrać poprzez kondensację na zimniejszej powierzchni. Na przykład, jeśli umieścisz zimne szkiełko nad naczyniem do odparowywania, na jego powierzchni utworzą się kropelki wody. Metoda destylacji opiera się na tej samej zasadzie.
DESTYLACJA. DESTYLACJA.
Jeśli substancja, na przykład cukier, rozkłada się po podgrzaniu, wówczas woda nie odparowuje całkowicie - roztwór odparowuje, a następnie z nasyconego roztworu wytrącają się kryształki cukru. Czasami konieczne jest usunięcie zanieczyszczeń z rozpuszczalników, np. soli z wody. W takim przypadku rozpuszczalnik należy odparować, a następnie zebrać jego pary i zatężyć po ochłodzeniu. Ta metoda rozdzielania jednorodnej mieszaniny nazywa się destylacja, lub destylacja.
W przyrodzie woda nie występuje w czystej postaci (bez soli). Woda oceaniczna, morska, rzeczna, studniowa i źródlana to rodzaje roztworów soli w wodzie. Jednak ludzie często potrzebują czystej wody, niezawierającej soli (stosowanej w silnikach samochodowych, w produkcji chemicznej do otrzymywania różnych roztworów i substancji, przy robieniu fotografii). Ta woda nazywa się destylowany, Tego właśnie używa się w laboratorium do przeprowadzania eksperymentów chemicznych.
Destylację można podzielić na:
- woda i alkohol
- olej (na różne frakcje)
- aceton i woda itp.
CHROMATOGRAFIA
Metoda rozdzielania i analizy mieszanin substancji. W oparciu o różne szybkości dystrybucji substancji badanej pomiędzy dwiema fazami – stacjonarną i ruchomą (eluent). Fazą stacjonarną jest z reguły sorbent (drobny proszek, np. tlenek glinu lub tlenek cynku lub bibuła filtracyjna) o rozwiniętej powierzchni, a fazą ruchomą jest przepływ gazu lub cieczy. Strumień fazy ruchomej jest filtrowany przez warstwę sorbentu lub przemieszcza się wzdłuż warstwy sorbentu, na przykład po powierzchni bibuły filtracyjnej.
Można samodzielnie uzyskać chromatogram i przekonać się o istocie metody w praktyce. Należy wymieszać kilka atramentów i nałożyć kroplę powstałej mieszaniny na bibułę filtracyjną. Następnie dokładnie w środku kolorowego miejsca zaczniemy wlewać kropla po kropli czystą wodę. Każdą kroplę należy aplikować dopiero po wchłonięciu poprzedniej. Woda pełni rolę eluentu, który przenosi substancję badaną przez sorbent – porowaty bibułkę. Substancje tworzące mieszaninę są zatrzymywane przez papier na różne sposoby: niektóre są przez niego dobrze zatrzymywane, inne natomiast wchłaniają się wolniej i przez pewien czas rozprowadzają się wraz z wodą. Wkrótce na kartce papieru zacznie się rozprzestrzeniać prawdziwy kolorowy chromatogram: plama jednego koloru pośrodku, otoczona wielobarwnymi koncentrycznymi pierścieniami.
Chromatografia cienkowarstwowa stała się szczególnie rozpowszechniona w analizie organicznej. Zaletą chromatografii cienkowarstwowej jest to, że można zastosować najprostszą i bardzo czułą metodę detekcji – kontrolę wizualną. Plamy niewidoczne dla oka można ujawnić za pomocą różnych odczynników, a także za pomocą światła ultrafioletowego lub autoradiografii.
Chromatografię bibułową wykorzystuje się do analizy substancji organicznych i nieorganicznych. Opracowano wiele metod rozdzielania złożonych mieszanin jonów, na przykład mieszanin pierwiastków ziem rzadkich, produktów rozszczepienia uranu, pierwiastków z grupy platynowców
METODY ROZDZIELANIA MIESZANIN STOSOWANYCH W PRZEMYŚLE.
Metody rozdzielania mieszanin stosowane w przemyśle niewiele różnią się od opisanych powyżej metod laboratoryjnych.
Do oddzielania oleju najczęściej stosuje się rektyfikację (destylację). Proces ten opisano bardziej szczegółowo w temacie „Rafinacja ropy naftowej”.
Najpopularniejszymi metodami oczyszczania i separacji substancji w przemyśle są sedymentacja, filtracja, sorpcja i ekstrakcja. Metody filtracji i sedymentacji przeprowadza się analogicznie do metody laboratoryjnej, z tą różnicą, że stosuje się osadniki i filtry o dużej objętości. Najczęściej metody te stosuje się do oczyszczania ścieków. Dlatego przyjrzyjmy się bliżej metodom ekstrakcja I sorpcja.
Termin „ekstrakcja” można odnieść do różnych równowag fazowych (ciecz – ciecz, gaz – ciecz, ciecz – ciało stałe itp.), ale częściej odnosi się go do układów ciecz – ciecz, dlatego najczęściej można spotkać się z następującą definicją :
DEFINICJA
Ekstrakcja i to metoda rozdzielania, oczyszczania i izolacji substancji polegająca na procesie rozdziału substancji pomiędzy dwa niemieszające się rozpuszczalniki.
Jednym z niemieszających się rozpuszczalników jest zwykle woda, drugim jest rozpuszczalnik organiczny, ale nie jest to konieczne. Metoda ekstrakcji jest uniwersalna, nadaje się do wyizolowania niemal wszystkich pierwiastków w różnych stężeniach. Ekstrakcja pozwala na rozdzielenie złożonych mieszanin wieloskładnikowych, często skuteczniej i szybciej niż inne metody. Przeprowadzenie separacji ekstrakcyjnej lub separacji nie wymaga skomplikowanego ani drogiego sprzętu. Proces można zautomatyzować i w razie potrzeby sterować zdalnie.
DEFINICJA
Sorpcja- metoda izolowania i oczyszczania substancji polegająca na absorpcji przez ciało stałe (adsorpcja) lub ciekły sorbent (absorpcja) różnych substancji (sorbaty) z mieszanin gazowych lub ciekłych.
Najczęściej w przemyśle metody absorpcyjne stosuje się do oczyszczania emisji gazowo-powietrznych z cząstek pyłów lub dymu, a także toksycznych substancji gazowych. W przypadku absorpcji substancji gazowych może nastąpić reakcja chemiczna pomiędzy sorbentem a substancją rozpuszczoną. Na przykład podczas absorpcji gazowego amoniakuNH 3roztwór kwasu azotowego HNO 3 wytwarza azotan amonu NH 4 NO 3(azotan amonu), który może być stosowany jako wysoce efektywny nawóz azotowy.
Metody rozdzielania mieszanin
Większość substancji na naszej planecie nie występuje w czystej postaci, ale w związkach i mieszaninach wraz z innymi substancjami.
Zatem granit zawiera trzy substancje widoczne gołym okiem.
Ale mleko wydaje nam się jednorodne, dopóki nie zakwasi się. Kwaśny
mleko rozdziela się na klarowną serwatkę i biały, gęsty osad – białko
kazeina. Człowieku, dawno temu używa tych substancji , zawarte w mleku, wydzielając je
z mieszanki. Twarożek przygotowywany jest z nierozpuszczalnego białka – kazeiny i rozpuszczalnego
Białka serwatkowe wykorzystywane są w żywieniu terapeutycznym.
W jaki sposób można rozdzielić mieszaniny?
1. Jeśli substancja jest nierozpuszczalna w wodzie, np. zbożach (ryż, kasza gryczana, kasza manna itp.), piasku rzecznym, kredzie, glinie, wówczas można zastosować metodę filtracji.
Filtrowanie-filtrowanie cieczy (gazów) przez filtr w celu oczyszczenia ich z zanieczyszczeń stałych.

1. Złóż filtr. Umieścić go w lejku, lekko zwilżając wodą.
2. Włóż lejek z filtrem do kolby.
3. Przepuścić mieszaninę nierozpuszczonej substancji i wody przez filtr.
Wniosek. Przefiltrowana woda swobodnie przepływała przez filtr; Na filtrze pozostała substancja nierozpuszczalna w wodzie.
2. Jeśli ciało stałe jest rozpuszczalne w wodzie (sól kuchenna, cukier, kwas cytrynowy), to do separacjimieszaninę można stosować metodą odparowania.
Odparowanie- oddzielanie ciał stałych rozpuszczonych w cieczy poprzez przekształcenie jej w parę.
W szklance wody sól nie zniknęła, choć stała się niewidoczna – roztwór jest przezroczysty. Odparowanie umożliwiło wyizolowanie substancji rozpuszczonej w wodzie z mieszaniny substancji (wody i soli). Na szkle widoczne są kryształki soli kuchennej. To potwierdza wniosek, że aby każda substancja (zarówno woda, jak i sól) mieszaniny zachowała swoje właściwości.
Wniosek. Substancje rozpuszczalne można wyizolować z roztworu.
3 .Do oddzielenia rozpuszczalnych w sobie cieczy i uzyskania czystej (bez zanieczyszczeń) wody stosuje się metodę destylacji
(lub destylacja)
Destylacja-destylacja, rozdzielanie substancji zawartych w ciekłych mieszaninach według temperatur wrzenia, a następnie chłodzenie pary.
W przyrodzie woda nie występuje w czystej postaci (bez soli). Woda oceaniczna, morska, rzeczna, studniowa i źródlana to rodzaje roztworów soli w wodzie. Jednak ludzie często potrzebują czystej wody, niezawierającej soli (stosowanej w silnikach samochodowych, w produkcji chemicznej do otrzymywania różnych roztworów i substancji, przy robieniu fotografii). Taka woda nazywana jest destylowaną, a sposób jej otrzymywania nazywa się destylacją.

Wodę kranową podgrzewamy nad płomieniem lampy alkoholowej w probówce zamkniętej korkiem z rurką wylotową gazu. Końcówkę probówki należy umieścić w czystej, suchej probówce umieszczonej w szklance z lodem. Krople wody destylowanej (oczyszczonej z soli i zanieczyszczeń) pojawią się na dnie i ściankach probówki w szklance z lodem.
Ćwiczenia
1. Zajrzyj do pustego czajnika, w którym gotuje się woda. Czy na ściankach i dnie znajduje się biały nalot (kamień) substancji rozpuszczonych w wodzie?
2. Z pokrywy czajnika, w którym zagotowała się woda, wypływają kropelki wody. Która woda – na pokrywce czy w samym czajniku – zawiera więcej soli? Wyjaśnij swoją odpowiedź.
3. Jak nazywa się proces pokazany na rysunku?

4. Jeśli mieszanina zawiera żelazo, możesz użyć magnesu, aby ją wyizolować, ponieważ żelazo i jego stopy przyciągane są przez magnes.
5. Aby oddzielić dwie niemieszające się ciecze (olej i woda, olej słonecznikowy i woda), należy użyć rozdzielacza.

Ciecz o większej gęstości spłynie do szkła, a lżejsza ciecz pozostanie w rozdzielaczu.